水溶液中L-抗坏血酸氧化反应影响因素的UV-Vis动力学研究
2020-07-09敖尼苏卢亚超康香蕊
鲜 亮,敖尼苏,席 蓓,杨 梅,卢亚超,康香蕊
(1. 西北民族大学 化工学院,甘肃 兰州 730124;2.甘肃省高校环境友好复合材料及生物质利用省级重点实验室,甘肃 兰州 730124)
L-抗坏血酸(AA)是人体必需的营养物质之一,也是维持人体机能的一种重要的维生素.蔬菜、水果类食品是AA的日常主要来源.AA稳定性较差,其结构中含有烯二醇结构,故而呈现出一定的酸性(图1),在空气中较稳定,但其水溶液易被空气和其他氧化剂氧化,生成脱氢抗坏血酸.其在碱性条件下易分解,见光加速分解,在弱酸条件中相对比较稳定,在食品工业中常用作抗氧化剂、酸味剂及强化剂等[1-2].
由于AA具有较强的还原性,所以,在食品加工和存储过程中,其含量易受环境的影响.AA可以和空气中的氧或溶解氧发生反应,丧失其营养价值.因此,有必要对AA在水溶液中的存在状态及其稳定性影响因素进行深入细致的研究[3-4].
目前,有多种方法可以检测AA水溶液状态下的含量和稳定性变化,包括色谱法、化学分析法、分光光度法以及点化学方法等[5-6].这些方法中,从准确性、方便性和实用性而言,紫外-可见分光光度法(UV-Vis)是一个较佳的选择[7].
由于AA分子结构当中含有刚性结构,所以,其在紫外光区243~265 nm范围内有较为明显的最大吸收峰.稀溶液的吸收峰强度应当符合Lambert-Beer定律.该方法操作简单、快速、准确,不受还原性物质干扰,回收率高,也无需特殊仪器和试剂,具有较高的使用价值.目前,对于食品中水溶液状态下的AA含量检测大多采用此种方法.但在实际的检测过程中,因为样品本身的提取液pH不同、化学组成成分极其复杂、其他维生素的存在以及在空气中的氧化还原反应等因素的影响,会导致AA吸收峰强度和波长发生相应的变化.这些UV-Vis吸收峰强度和波长的变化都会影响AA检测结果的准确性.鉴于此,本文针对UV-Vis分光光度法中浓度和pH值对AA的吸收光谱的影响进行了深入细致的研究.
1 实验部分
1.1 试剂和仪器
主要试剂为L-抗坏血酸(AR)、盐酸(AR,6 mol/L),试剂使用前未经进一步纯化.主要仪器为紫外-可见分光光度计(UV-1200,上海美谱达仪器有限公司)、移液枪(TopPette手动单道可调式,大龙兴创实验仪器有限公司)、电子天平(凯丰高精密电子天平,凯丰集团有限公司)、pH酸度计(上海雷磁 PHB-4).
1.2 不同浓度AA水溶液的配制
典型的配制过程如下:在室温下称取AA 0.080 0 g,置于1 000 mL容量瓶中,以去离子水定容,配制成80 μg/mL的溶液.再从其中分别量取75 mL、50 mL、37.5 mL、25 mL、12.5 mL以及6.25 mL的溶液置于100 mL容量瓶中后以去离子水定容,从而得到包括反应母液在内的80 μg/mL、60 μg/mL、40 μg/mL、30 μg/mL、20 μg/mL、10 μg/mL和5 μg/mL的AA水溶液样品.其pH值分别为3.66、3.73、3.83、3.91、4.21及4.43.摇匀后于4 ℃冰箱中避光静置待用.
1.3 不同pH值AA水溶液的配制
典型的配制过程如下:从配制好的80 μg/mL溶液中平行取4份50 mL AA水溶液,转移至100 mL容量瓶中后以去离子水定容,配制成40 μg/mL的AA水溶液.以移液枪分别加入10 μL、20 μL以及40 μL的6 mol/L的盐酸,获得pH值分别为3.19、2.91及2.62的不同pH的AA水溶液样品(加入盐酸导致的总体积变化忽略不计),摇匀后于4 ℃冰箱中避光静置待用.
1.4 UV-Vis吸收光谱测量
AA的氧化反应速率主要以UV-Vis吸收曲线进行检测.主要检测不同浓度和不同酸度条件下UV-Vis最大吸收峰波长和强度变化以及随时间变化的动力学过程.典型的UV-Vis实验条件是:从上述配制好的样品溶液取出样品至具塞石英比色皿中,在200~700 nm范围内每隔一定时间测定其UV-Vis曲线.
2 结果与讨论
2.1 AA水溶液的浓度、pH值对AA水溶液最大吸收峰强度及波长的影响

图2 不同浓度(80、60、40、30、20、10和5 μg/mL)AA水溶液UV-Vis吸收曲线(插图为最大吸收峰强度的Lambert-Beer线性拟合)
通过对不同浓度AA水溶液(80、60、40、30、20、10、5 μg/mL)的UV-Vis最大吸收的测定(图2),获得吸收峰和浓度之间的线性拟合方程为y=0.0391+0.1287,拟合度为0.9996,说明在5~80 μg/mL的浓度范围内,AA的吸收峰强度完全符合稀溶液Lambert-Beer定律.AA在紫外光区产生吸收峰的主要原因在于其结构当中刚性环的存在.这种吸光度和浓度的高度线性相关性是水溶液中AA含量的UV-Vis检测方法可靠性的理论基础.
值得注意的是,虽然前期的文献报道中大多数以265 nm或243 nm处的吸收峰强度检测AA浓度[8],但较少有文献关注最大吸收峰位置随酸度的变化情况.而在上述UV-Vis实验中,除验证了已知的线性相关性以外,从图2中发现UV-Vis最大吸收峰发生了显著的蓝移.如图3a所示,其浓度和最大吸收峰波长呈现明显的线性负相关性.而在添加了盐酸的pH值减小的40 μg/mL样品中,也观察到了最大吸收峰的蓝移现象.以上述样品pH值为横坐标,以最大吸收峰波长为纵坐标,可以获得最大吸收峰蓝移和pH值的关系曲线(图3b).
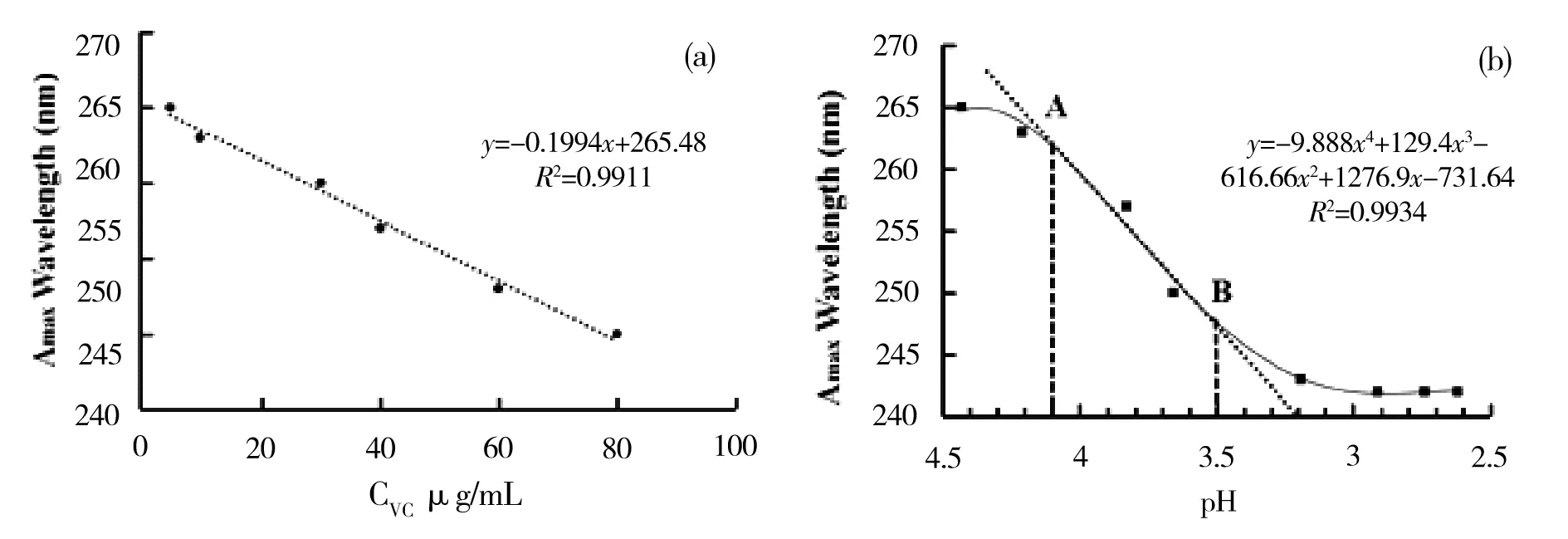
图3 a. AA水溶液最大吸收峰波长和浓度(5、20、30、40、60、80 μg/mL)之间线性负相关;b. AA水溶液最大吸收峰波长随溶液pH变化曲线
从图3b中可以看到,随着溶液样品的pH值从4.4变化到2.6,最大吸收峰从265 nm逐渐蓝移至243 nm.其四次方多项式拟合方程曲线呈现了一个明显的拐点.拟合曲线拐点切线和拟合曲线相交的A、B两点(图3b)pH值分别为4.1和3.5.pH值降低,c(H+)迅速增大,随后产生AA羰基质子化.这导致羰基氧原子与C=C的共轭程度降低,π-π*跃迁能量升高,从而发生蓝移.
2.2 浓度对AA水溶液稳定性影响的动力学研究

图4 不同浓度(80 μg/mL和60 μg/mL)AA水溶液归一化最大吸收峰强度随时间(h)变化速率
为了研究浓度对AA氧化速率的影响,考察不同浓度AA最大吸收峰随时间变化的速率.图5及图6分别为80、60、30、5 μg/mL的AA水溶液随时间变化曲线.从图中可以看到,在较高的浓度下(60~80 μg/mL),AA在实验条件下(室温18~20 ℃,溶液静置在具塞石英比色皿中)的氧化反应中,最大吸收峰随时间线性负相关,呈现零级反应的特征.而在较稀的AA溶液中(5~30 μg/mL),最大吸收峰的自然对数值和时间线性负相关,呈现一级反应的特征.

图5 不同浓度(30 μg/mL和5 μg/mL)AA水溶液ln(Amax)随时间变化速率
2.3 c(H+)对AA抗氧化性的影响
为了解c(H+)对AA抗氧化性的影响,实验研究了40 μg/mL浓度的AA水溶液在不同pH值下的最大吸收峰强度和时间的关系.从图6可以看到,随着盐酸加入量的增加(10 μL、20 μL、40 μL),归一化的最大吸收峰强度和时间呈现线性负相关,从而表观反应速率常数分别为0.012 7 h-1、0.012 2 h-1和0.009 7 h-1,呈现逐渐减缓的趋势.该实验结果说明,酸性的增加有助于AA在水溶液中的稳定性.结合前述图3b的讨论,该实验结果合理的推论是:在酸度调节到小于3.5之后,能将稀AA水溶液空气环境下的氧化反应从一级反应转变为零级反应,从而降低了氧化还原反应速率,即达到对水溶液中的低浓度AA抗氧化保护作用的最大化.

图6 不同酸度(盐酸加入量40 μL、20 μL、10 μL)AA水溶液(浓度40 μg/mL)归一化最大吸收峰强度随时间(h)变化速率的线性拟合
3 结论
AA水溶液的不同浓度和不同酸度对AA的UV-Vis最大吸收峰的波长和强度具有较大的影响,而这种影响对AA的UV-Vis检测结果的准确与否至关重要.实验结果显示,AA的Amax随着浓度的增加而逐渐发生蓝移.高浓度AA在空气环境中的氧化反应为零级反应,而低浓度AA在空气环境中的氧化反应为一级反应.c(H+)的加大对AA稳定性具有显著的帮助.当pH值调节到<3.5以后,即能够使相对较烯的AA溶液也能够以零级反应方式进行.上述结论对于AA的UV-Vis测定结果的准确性以及研究果蔬的AA提取、保护和提取液酸度的选择具有一定的参考价值.
