利用ΔS总判断自发变化过程的方向
2020-07-09李克昌杨晓敏夏宝辉郭玉鹏
杨 桦,李克昌,杨晓敏,夏宝辉,邹 博,周 兵,郭玉鹏
(吉林大学 化学学院, 吉林 长春 130012)
在物理化学课程中,关于变化方向与限度的问题,是重要的学习内容.其中涉及可逆过程与不可逆过程,自发过程与非自发过程等重要概念[1-7].对于自发性的判断,常用的直接判据有孤立系统的熵ΔS孤判据与封闭系统的吉布斯自由能ΔG判据,即
ΔS孤≥0, -(ΔG)T,p,W`=0≥0
(1)
式(1)中“>”表示自发过程、“=”表示可逆过程或平衡、W`表示非体积功.其他热力学判据(如:热力学能增量ΔU、焓变ΔH、亥姆霍兹自由能增量ΔA及吉布斯自由能增量ΔG)都不能直接判断过程的自发性,只能直接判断不可逆性.为判断变化过程是否为自发过程,必须先判断出过程为不可逆的,然后再根据过程中做功情况进一步判断之.笔者称热力学判据为间接的自发性判据.人们不禁要问,ΔS总判据是否也能间接判断过程的自发性,答案是肯定的.
1 ΔS总判据
常见的系统都是封闭的非孤立系统.为判断这类系统变化过程的方向,常将系统熵变ΔS体与系统相关的环境熵变ΔS环联系在一起.变化过程总熵变用ΔS总表示,则
ΔS总=ΔS体+ΔS环≥ 0
(2)
式(2)称为ΔS总判据,其中的“ > ”表示不可逆过程、“ = ”表示可逆过程或平衡、恒温时ΔS环=-Q/T环(Q为系统与环境交换的热量).对于ΔS总判据,文献中存在两种不同的观点:一种观点认为,用式(2)可以判断过程的自发性.此种看法是将ΔS总视为孤立系统,其熵变为ΔS孤,即
ΔS孤=ΔS体+ΔS环≥0
(3)
式(3)孤立系统的ΔS总可以判断变化过程的自发性.另一种观点则认为, 用式(2)不能判断过程的自发性,只能判断不可逆性.有学者认为,与ΔS总判据相应的新系统,只是个绝热系统而不是孤立系统,它与外界虽无热量交换,但有功的交换.虽然根据功的交换情况可以判断这个绝热系统的自发性,但判断不了它所包含的原系统的自发性 (认为新系统自发时,原系统可有自发过程与非自发过程存在).
笔者认为,上述两种观点都是不正确的.由于ΔS总判据相应的新系统与外界可以有功的交换,因此它不是孤立系统.若将此功也纳入新系统,从而构成认为的孤立系统,那么自然界内所有的变化都可认为是在孤立系统内进行的,而这种处理问题的方法显然是错误的.第二种观点也是不正确的.因为与ΔS总判据相应的新系统是由原系统与原环境中的热源部分所组成.而作为热源,不论它是以系统原因还是以环境原因出现,它同外界只能有热量的传递而绝无功的交换,因此新系统与外界功的交换情况就是原系统与原环境间功的交换情况,即新、原两个系统在做功的问题上是完全一致的.又因变化过程自发性的判断仅与功有关,而与热量无关,因而两个系统在自发性的判断上应是完全一致的.若新系统自发,原系统必也自发(绝无非自发的问题);反之,若原系统自发,新系统也必自发.由于原系统的自发性可以用热力学判据进行间接判断(例如,恒温恒压下用吉布斯自由能增量ΔG判据等),并且热力学判据与ΔS总判据是等效的(见下节),因而用ΔS总判据可以判断原系统的自发性,亦即新系统的自发性.
2 ΔS总判据与热力学判据的关系
2.1 问题的提出
ΔS总判据用于判断变化过程的不可逆性,还可根据做功情况进一步判断变化过程的自发性.虽然说自发过程与不可逆过程是两个不同的概念,但是自发过程的实质仍属于热力学不可逆过程,所不同的只是多了个“不需要总环境中得到功”的附加条件而已.由于在ΔS总判据的不等式中,没有功这一物理量出现,从而也就影响了人们对它作为变化过程自发性判断的认可.考虑到这两种判据都是在克劳修斯不等式基础上导出的,因此ΔS总判据与其他热力学判据是等效的.而在各热力学判据中都有功这个物理量出现(如恒温时为总功,恒温恒容(压)时为非体积功).这样,便可推断出用ΔS总判据判断变化过程自发性时,要考虑涉及到的功是非体积功W`还是总功Wtot。于是,ΔS总作为变化过程中自发性的判据,考虑不同功自然也就被人们所认知了.
2.2 关系式的确立
从逻辑关系上看,ΔS总判据与热力学判据应是等效的,但是在不同条件下,其具体形式有所不同.现以恒温恒压条件下的ΔS总判据与吉布斯自由能增量ΔG判据的关系导出为例,进行说明.
恒T、p下的吉布斯自由能判据: ΔG≤W'(W'为非体积功)
恒T、p下的ΔS总判据:
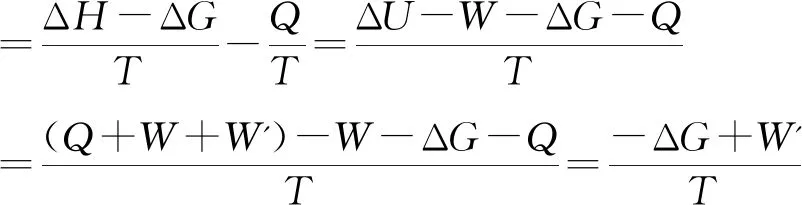
(4)
式(4)中的W`为原系统(也是新系统)与环境间交换的非体积功.因T>0, 所以式(4)中的ΔS总≥ 0与ΔG≤W'是一致的,即恒温恒压条件下的ΔS总判据就是该条件下的吉布斯自由能ΔG判据.而用吉布斯自由能增量ΔG判据判断过程的不可逆性时只考虑非体积功.由于一切不可逆过程不是自发过程就是非自发过程,因而用吉布斯自由能增量ΔG判据判断自发性(自发或非自发)时,也只能考虑非体积功.这样,用ΔS总判据判断自发过程时也只看非体积功,无需计算体积功.
用类似的方法,同样可推断出,恒熵恒容及恒熵恒压下的ΔS总判据分别与热力学能ΔU及焓ΔH判据等同.恒温恒容及恒温下的ΔS总判据分别等同于相应条件下的亥姆霍兹自由能增量ΔA判据.相应的功分别为非体积功W`和总功Wtot。为便于比较将其汇总如下:
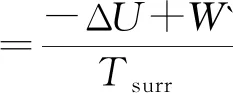
(5)
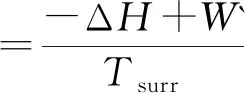
(6)
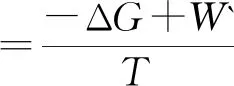
(7)
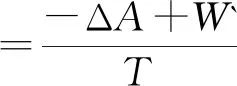
(8)
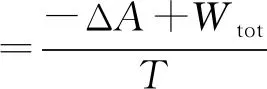
(9)
式(5)~(9)中的W` 及Wtot为不同条件下的非体积功及总功.式(5)~(9)表示不同条件下的ΔS总表示式.不同条件下,ΔS总的表达式涉及的功是不同的.
3 用ΔS总判据判断变化过程的自发性
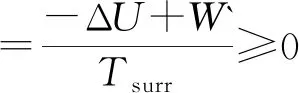
(10)
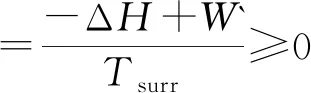
(11)
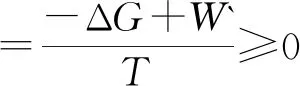
(12)
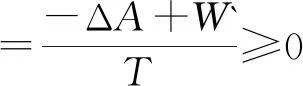
(13)
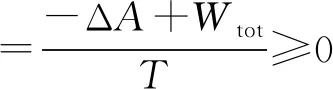
(14)
式(10)~(14)表示不同条件下ΔS总作为判据判断变化过程的自发性.其中的“ > ”表示不可逆过程、“ = ”表示可逆过程或平衡.用ΔS总判据判断自发时,计算出总熵变ΔS总,并判断过程的不可逆性,然后再根据过程中做功的情况判断变化过程自发与否.由式(14)可知,对于恒温过程,用于界定自发与否的功为总功(通常此类变化过程无非体积功).恒温以外条件下的变化,只考虑非体积功.现以恒温恒压的化学反应为例加以验证.
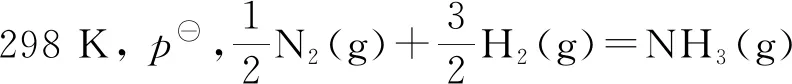
解用吉布斯自由能增量ΔG判据:
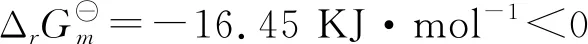
又非体积功W`=0,反应为不可逆的.系统未接受非体积功.因此,此过程为自发.
用ΔS总判据:
ΔS体=-99.41 J·K-1· mol-1
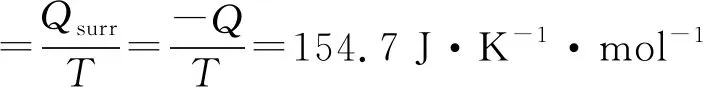
ΔS总=ΔS体+ ΔS环=55.29 J·K-1·mol-1>0
因为ΔS总>0,故反应为不可逆.又因W`=0,故该过程为自发过程(该反应过程中系统得到了体积功,不能以此判断,否则将得出非自发的错误结论).显然,应用ΔS总判据仍可对自发与否做出正确判断.
4 结论
ΔS总判据不仅用于判断变化过程的不可逆性,还可间接判断变化过程的自发性.由于实际发生的过程以恒温、恒温恒容及恒温恒压过程最为常见,因此在这些条件下ΔS总判据是最具有实际意义的,也有很强的可操作性,建议在物理化学课程的教学中应予以适当介绍.
