当归芍药散对缺血性脑卒中小鼠脑保护作用的影响
2020-07-09李海燕杨勇高晨任长虹
李海燕,杨勇,高晨,任长虹
论著·实验研究
当归芍药散对缺血性脑卒中小鼠脑保护作用的影响
李海燕1,杨勇2,高晨1,任长虹1
1.首都医科大学宣武医院低氧医学研究所,北京 100053;2.北京中医药大学基础医学院,北京 100029
观察当归芍药散对缺血性脑卒中小鼠脑保护作用的影响,探讨其可能的作用机制。取成年C57雄性小鼠,制备大脑中动脉梗阻(MCAO)模型。实验小鼠随机分为假手术组(Sham组)、模型组(MCAO组)和当归芍药散组(DSS组),进行神经功能评分和脑组织TTC染色,观察小鼠神经功能和脑梗死体积,免疫荧光染色和电化学发光法检测小鼠脑组织相关指标水平。与MCAO组比较,DSS组小鼠脑梗死体积明显减小(<0.001),细胞凋亡数目明显减少(<0.05),神经功能有一定程度的恢复(<0.01),小胶质细胞/巨噬细胞数量明显减少(<0.01),同时,当归芍药散可促进M2型巨噬细胞/小胶质细胞极化(<0.01),降低促炎因子、增加抑炎因子的表达(<0.01,<0.001)。当归芍药散对缺血性脑卒中小鼠具有脑保护作用,其机制可能与其抑制细胞凋亡、调节小胶质细胞极化有关。
当归芍药散;缺血性脑卒中;小胶质细胞极化;炎性反应;小鼠
脑中风以其高发病率、高复发率、高致残率、高死亡率及逐年递增的防治费用成为危害人民健康最为严重的疾病之一,其人群叠加效应和快速增长给社会、家庭造成巨大的经济负担和精神压力,已成为严重影响国计民生的重要公共卫生问题[1-2]。因此,研究有效治疗药物对社会意义重大。当归芍药散对脑缺血再灌注损伤的神经保护作用已得到共识[3],然而其确切机制尚不十分明确。小胶质细胞是中枢神经系统免疫细胞,参与缺血性脑损伤的炎症反应和损伤修复[4]。在缺血性脑损伤中,小胶质细胞表现为M1和M2两种不同的极化表型[5-6]。本研究制备小鼠大脑中动脉梗阻(MCAO)模型,观察当归芍药散对缺血/再灌注脑损伤模型小鼠保护作用的影响,探讨其可能的作用机制。
1 实验材料
1.1 动物
SPF级C57/BL6雄性小鼠88只,体质量20~24 g,北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2007-0001。饲养于首都医科大学宣武医院实验动物中心,温度(22±2)℃、相对湿度(45±5)%,日照时间12 h。小鼠分笼喂养,每5只1笼,自由摄食饮水。
1.2 药物及制备
当归芍药散(当归、川芎、白芍、泽泻、茯苓、白术比例为3∶3∶16∶8∶4∶4),饮片购自北京同仁堂,采用醇提水沉法提取各个样品,按1∶5(W/V)比例加入95%乙醇,室温过夜,然后煮沸2次×2 h。过滤,离心,留取提取液,剩余药物残渣加入蒸馏水(1∶4,W/V)煮沸2次×1 h。过滤,离心,留取提取液,将2次提取液混合测浓度,调至为1 g/mL,4 ℃冰箱保存备用。
1.3 主要试剂与仪器
恩氟烷(河北一品制药制药股份有限公司,批号C001180702),2,3,5-氯化三苯基四氮唑蓝(TTC)(Sigma,货号17779),抗cleaved Caspase3多克隆抗体(Abcam,货号ab2302),抗CD68多克隆抗体(Santa Cruze,货号sc-20060),抗CD16/32多克隆抗体(Abcam,货号ab25235),抗CD206多克隆抗体(Abcam,货号ab64693),抗Iba1抗体(Wako,货号019-19741),免疫荧光二抗(Lifetechnologies,货号A-21203,A-32723)。小动物肛温检测仪(Harvard Apparatus),电子分析天平(瑞士Mettler公司,型号AE160),高频小电刀(上海医疗器械技术公司,型号1411),ROTO-ROD仪(IITC Life Science,型号092517-755),激光共聚焦显微镜(Leika,型号TCS SP8)。
2 实验方法
2.1 造模
小鼠称重后予5%恩氟烷诱导麻醉,1%~2%恩氟烷混合70%N2O和30%O2维持麻醉,采用Zea Longa线栓法[7]制备小鼠右侧MCAO模型,小鼠腹下垫恒温垫,术中肛温维持在(37±2)℃。术中小心分离右侧颈总动脉、颈内动脉、颈外动脉,将线拴由颈外动脉残端插入颈内动脉,至距颈内动脉和颈外动脉分叉处约1.8 cm,栓塞60 min后拔除栓子,制备缺血/再灌注损伤模型。手提小鼠尾部,可见左侧前肢屈曲,视为模型成功。假手术组(Sham组)仅分离上述各血管,不插入线拴。
2.2 分组及给药
实验小鼠随机分为Sham组、MCAO组和当归芍药散组(DSS组),每组8只。根据前期研究工作[8],换算小鼠每日当归芍药散给药量为866 mg/kg。DSS组给予当归芍药散药液灌胃,MCAO组给予等量生理盐水灌胃。各组均在缺血30 min后第1次给药,给药体积10 mL/kg,每日1次,给药1 d或3 d。
2.3 脑梗死体积测定
术后3 d(每组7只)处死小鼠,在视交叉处向后切厚度为1 mm冠状切片4片,视交叉前切2片。将脑片置于用PBS(pH 7.4)配制1%TTC染液,37 ℃染色5 min。正常脑组织染成深红色,缺血脑组织染成苍白色。相机拍摄,使用ImagePro Plus图像分析软件计算脑梗死面积[9]。梗死面积百分率(%)=梗死区脑组织体积÷正常侧大脑半球体积×100%。
2.4 神经功能缺损严重程度评分
术前1 d及术后1、3、5、7 d(每组8只)进行神经功能缺损严重程度评分,包括运动功能和感觉功能检测[10]。运动功能检测:提起小鼠尾部(正常0分,前肢屈曲1分,后肢屈曲1分,头部在30 s内沿垂直轴移动>10°1分,最大值3分);将小鼠放置地面(正常0分,无法直走1分,向轻瘫侧打转2分,向轻瘫测倾倒3分)。感觉功能检测:触觉反应通过用牙签碰触前爪掌区来实现(正常0分,减缓反应1分,无反应2分);本体感觉反应通过用棉棒放在双侧脖颈处实现(正常0分,减缓反应1分,没有反应2分)。将所有评分相加作为神经功能缺损严重程度最后分值。
2.5 转棒实验
术前1 d及术后3、5、7 d(每组8只)进行转棒实验。将小鼠放在加速旋转的转棒上(5 min内从4 r/min加速到40 r/min),直到小鼠掉落,记录停留时间,5 min内仍未掉下按5 min计算。每只小鼠每日进行3次实验,实验间隔20 min。
2.6 免疫荧光染色方法检测cleaved Caspase-3、CD68、Iba1、CD16/32和CD206的表达
术后1 d(每组6只)取材,检测cleaved Caspase-3的表达;术后3 d(每组6只)取材,检测CD68、Iba1、CD16/32和CD206的表达。小鼠麻醉后使用生理盐水由心脏灌注,取脑组织后固定于4%多聚甲醛(4%PFA),置于4 ℃冰箱,经30%蔗糖脱水,至脑组织自然沉淀,冰冻切片10 µm。用1%BSA-PBST,室温封闭60 min。甩去封闭液,滴加一抗,湿盒内4 ℃孵育过夜。PBS清洗3次,每次10 min。二抗用Alex488或Alex594标记。不加一抗作为阴性对照,以确认抗体免疫反应特异性。室温避光孵育1 h,PBS清洗3次,每次10 min。用含有DAPI的封片剂封片,激光共聚焦显微镜观察,使用Image Pro Plus V软件进行分析。
2.7 电化学发光法检测促炎因子和抑炎因子的表达
小鼠术后3 d(每组6只)取梗死侧脑组织,用RIPA buffer按照1∶9(W/V)比例裂解蛋白。用BCA法检测蛋白浓度。配制1×PBS(0.05%吐温-20)清洗液,配制2×读板液,每孔加150 μL Blocker H溶液,并用封口膜封上,室温孵育1 h,清洗电化学发光板3次,每次150 μL清洗液,每孔加入50 μL样本、标准品和质控品,并用封口膜封上,室温振荡2 h,清洗电化学发光板3次,每次150 μL清洗液,每孔加入配制好的25 μL检测抗体,并用封口膜封上,室温振荡2 h,清洗电化学发光板3次,每次150 μL清洗液,每孔加入150 μL配制好的读板液,上机检测。
3 统计学方法
4 结果
4.1 当归芍药散对模型小鼠脑梗死体积及神经细胞凋亡的影响
与MCAO组比较,DSS组小鼠脑梗死体积明显减小,差异有统计学意义(<0.001),结果见图1。
4.2 当归芍药散对模型小鼠神经细胞凋亡的影响
术后1 d检测梗死周边区细胞凋亡的数量,用抗cleaved Caspase-3抗体标记凋亡细胞,结果显示,与MCAO组比较,DSS组小鼠细胞凋亡数量减少,差异有统计学意义(<0.05),结果见图2、图3。
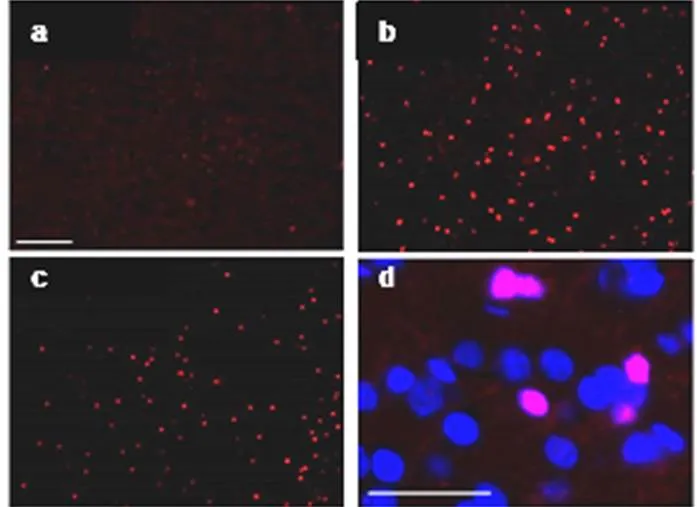
注:a. Sham组;b. MCAO组;c. DSS组;d.高倍图(DSS组)
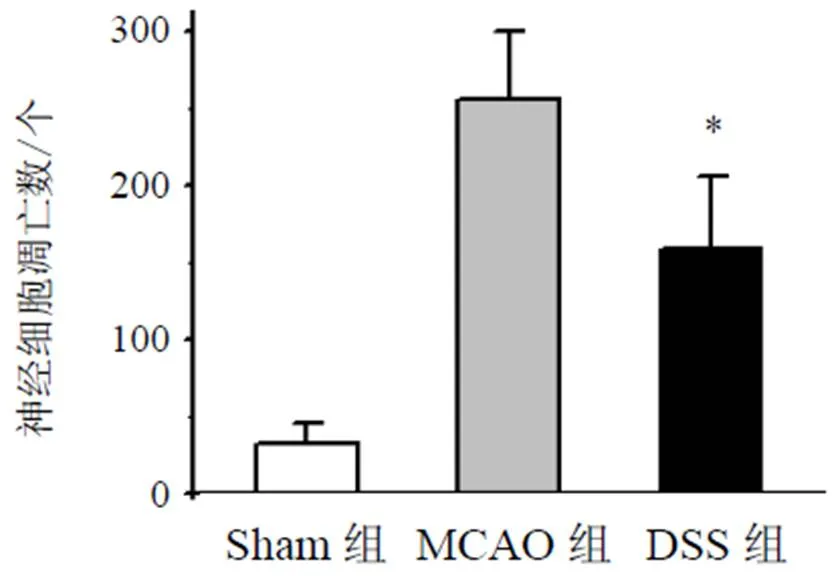
注:与MCAO组比较,*P<0.05
4.3 当归芍药散对小鼠神经功能评分和转棒停留时间的影响
与MCAO组比较,DSS组小鼠脑组织神经功能有所改善,各时间点神经功能评分较MCAO组低,转棒停留时间更长,差异有统计学意义(<0.01)。结果见图4。

注:与MCAO组比较,**P<0.01
4.4 当归芍药散对模型小鼠脑组织梗死周边区小胶质细胞/巨噬细胞数量的影响
采用CD68抗体标记小胶质细胞/巨噬细胞,结果显示,与MCAO组比较,DSS组降低脑组织小胶质细胞/巨噬细胞活力,差异有统计学意义(<0.01)。结果见图5、图6。
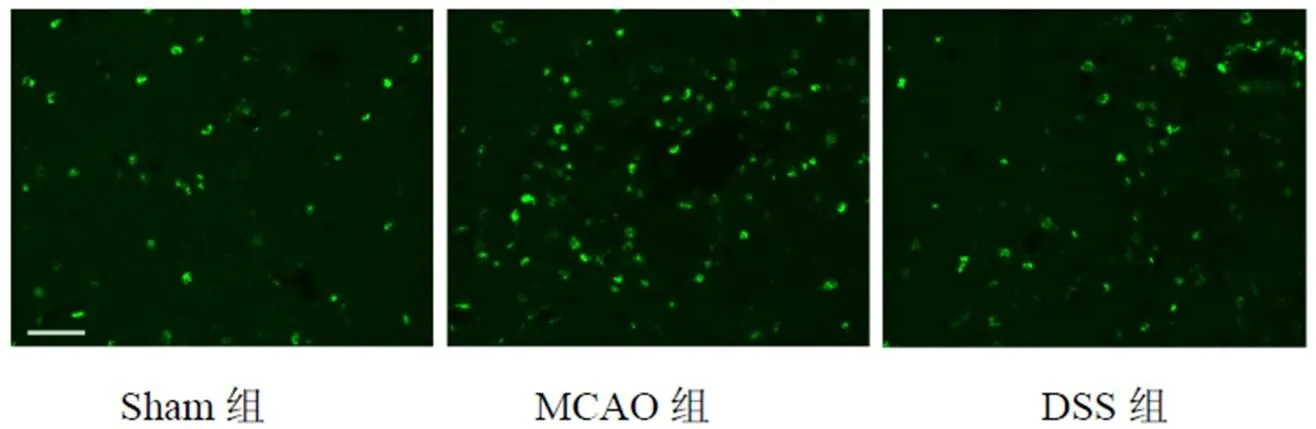
图5 各组小鼠脑组织小胶质细胞/巨噬细胞形态(免疫荧光染色,标尺=50 μm)
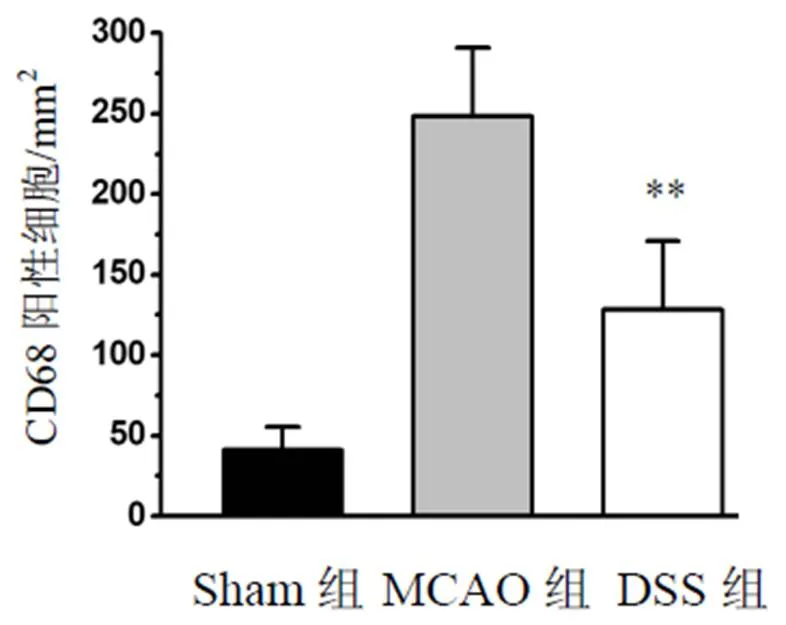
注:与MCAO组比较,**P<0.01
4.5 当归芍药散对模型小鼠脑组织M1和M2型巨噬细胞/小胶质细胞极化的影响
免疫荧光双标方法检测M1型(CD16/32)及M2型(CD206)小胶质细胞,与MCAO组比较,DSS组小鼠脑组织M1阳性标志物CD16/32+/Iba1+表达显著降低,差异有统计学意义(<0.01),见图7、图8。同时,DSS组小鼠脑组织M2型巨噬细胞/小胶质细胞数量(标志物为CD206+/Iba1+细胞)显著增加,差异有统计学意义(<0.01),见图9~图10。
4.6 当归芍药散对模型小鼠脑组织促炎因子和抑炎因子水平的影响
与MCAO组比较,DSS组小鼠脑组织促炎因子肿瘤坏死因子(TNF)-α和白细胞介素(IL)-6水平降低,抑炎因子IL-10水平增加,差异有统计学意义(<0.01),结果见图11。

图7 各组小鼠脑组织M1型小胶质细胞阳性表达(免疫荧光染色,标尺=50 μm)
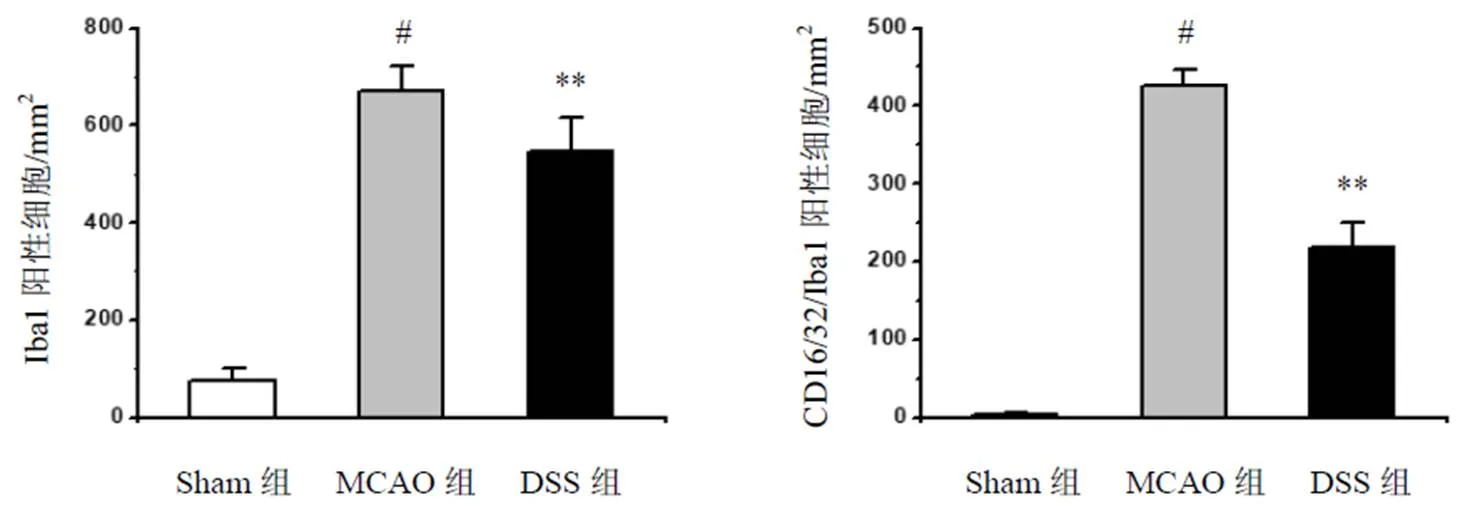
注:与Sham组比较,#P<0.05;与MCAO组比较,**P<0.01
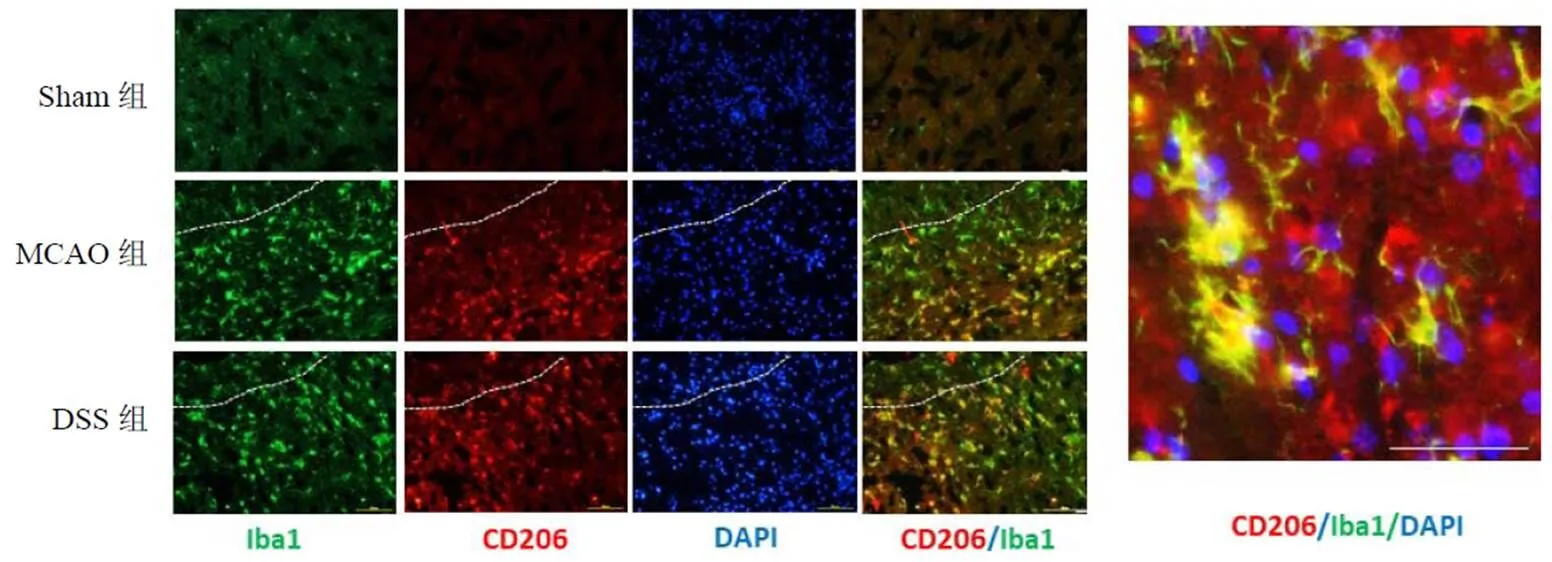
图9 各组小鼠脑组织M2型小胶质细胞阳性表达(免疫荧光染色,标尺=50 μm)
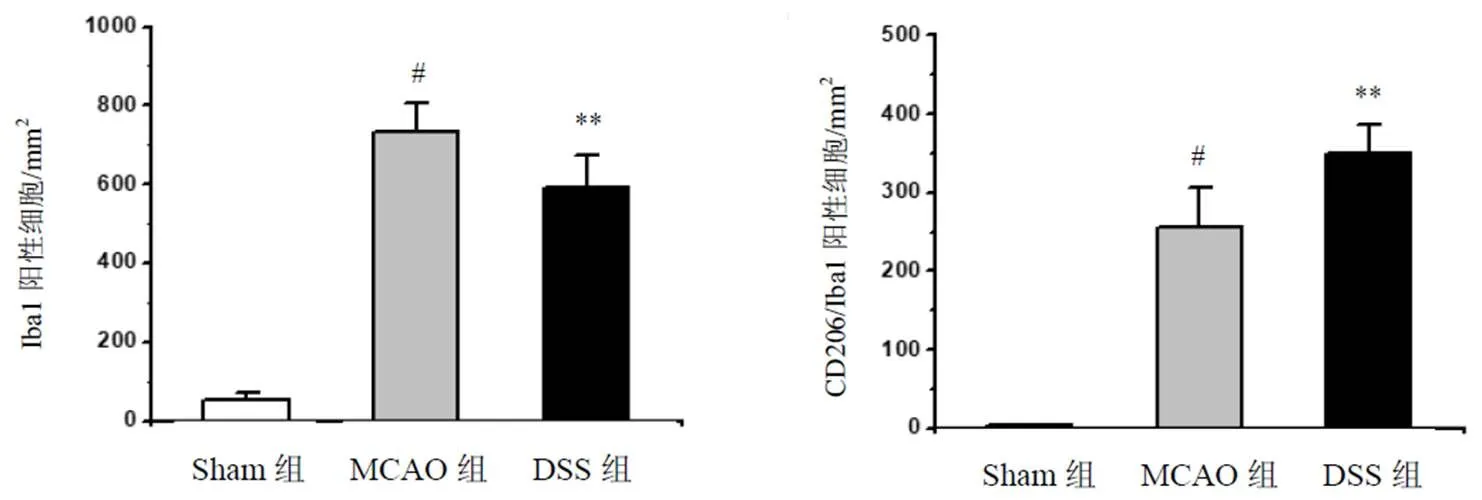
注:与Sham组比较,#P<0.05;与MCAO组比较,**P<0.01
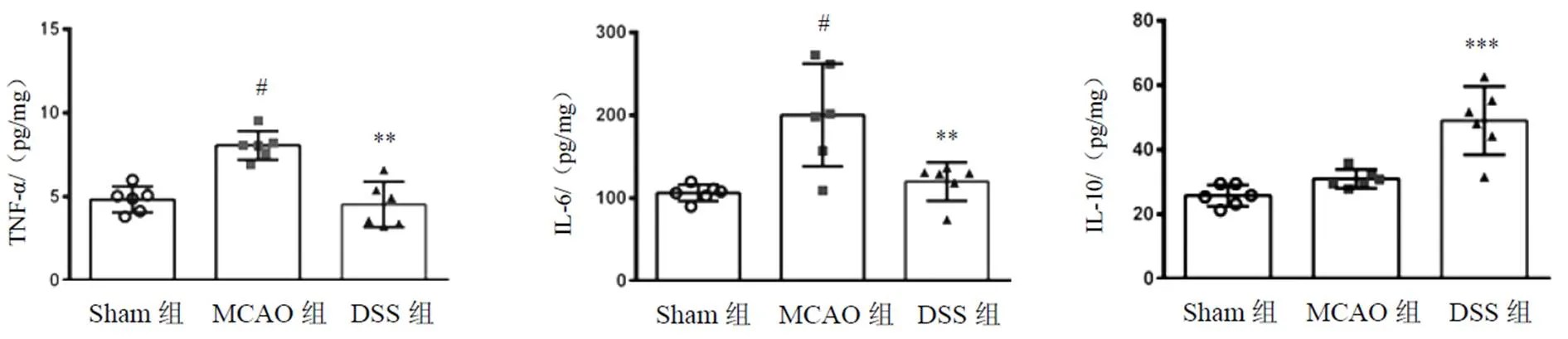
注:与Sham组比较,#P<0.05;与MCAO组比较,**P<0.01,***P<0.001
5 讨论
当归芍药散出自《金匮要略》,主治“妇人怀妊,腹中疞痛”及“妇人腹中诸疾痛”。近年来,该方被用于脑血管疾病,如血管性痴呆、脑梗死等[11-13]。有研究报道,当归芍药散治疗脑梗死机制可能是通过干预基质金属蛋白酶-9发挥脑保护作用[14]。
小胶质细胞是大脑中的巨噬细胞,在发育、维持机体的稳态和在疾病的病理生理中具有重要的作用[15-16]。在生理条件下,小胶质细胞主要处于静息状态(M0),组织遭受缺血缺氧等损伤后,小胶质细胞被激活,出现2种主要表型,即“经典激活”(M1型)和“选择性激活”(M2型)。M1型小胶质细胞分泌多种促炎因子,如IL-1、IL-6、IL-8、TNF-α[17-18],而M2型小胶质细胞产生具有抑炎作用的细胞因子IL-10和转化生长因子-β等。
本研究结果显示,当归芍药散治疗后,模型小鼠神经功能得到改善,神经细胞凋亡数量减少。同时,与MCAO组比较,DSS组小胶质细胞总量减少,M1型小胶质细胞数量减少,促炎因子TNF-α、IL-6水平降低,M2型小胶质细胞数量增加,抑炎因子IL-10水平升高。由此我们推断,当归芍药散对缺血性脑损伤具有比较明确的保护作用,可能与调控小胶质细胞的极化有关。脑为奇恒之府,是髓之海,由肾精充养,是神明所居,亦为心神之机关,脑髓由经络和血络贯连,脑络是脑神的功能和结构载体,具有贯通营卫、环流经气、渗透气血、互化津血的生理功能,是内外沟通的桥梁,脑髓之络脉畅达,气血充盈是其发挥功用的结构和物质基础。脾主化生气血,升发清阳,是脑髓发挥正常功能的物质源泉,肝主疏泄调达,能保障脑髓络脉的疏通畅达,如果脾失健运,水湿内停,上犯脑络,肝失疏泄,血瘀络阻,均可影响脑络,而致脑络受损,神机失养,造成神机运动物质基础匮乏,脏腑形骸信息联络欠畅,如果损伤日久,湿聚成痰,瘀久生热,甚至化火动风,则中风病的发生在所难免。当归芍药散以当归、白芍、川芎调肝理血,白术、茯苓、泽泻健脾调津,全方三血三水之品相济并用,共奏调肝健脾、活血利水之功。有研究报道,当归芍药散能改善中风后患者生存质量,提高独立生活能力[3]。我们以往的研究结果发现,当归芍药散能促进缺血性中风亚急性期神经功能恢复,促进血管新生、神经再生[8]。
综上,临床实践的拓展和基础研究的深入以及中医脑病理论的创新让我们对古方新用研究有了长足发展,当归芍药散在神经保护作用方面的应用有待深入研究。
[1] FEIGIN V L, NGUYEN G, CERCY K, et al. Global, regional, and country-specific lifetime risks of stroke, 1990 and 2016[J]. N Engl J Med,2018,379(25):2429-2437.
[2] HERON M. Deaths leading causes for 2007. National vital statistics reports:from the Centers for Disease Control and Prevention, National Center for Health Statistics[R]. National Vital Statistics System,2011,59(8):1-95.
[3] 赵义纯,陆曙.当归芍药散在中枢神经系统作用的研究进展[J].中国中医急症,2011,20(12):1993-1994.
[4] LIU X, WEN S, YAN F, et al. Salidroside provides neuroprotection by modulating microglial polarization after cerebral ischemia[J]. J Neuroinflammation,2018,15(1):39.
[5] HU X, LEAK R K, SHI Y, et al. Microglial and macrophage polarization-new prospects for brain repair[J]. Nat Rev Neurol, 2015,11(1):56-64.
[6] MIRON V E, BOYD A, ZHAO J W, et al. M2 microglia and macrophages drive oligodendrocyte differentiation during CNS remyelination[J]. Nat Neurosci,2013,16(9):1211-1218.
[7] LONGA E Z , WEINSTEIN P R , CARLSON S , et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989,20(1):84-91.
[8] REN C, BRIAN W, LI N, et al. Herbal formula Danggui-Shaoyao- San promotes neurogenesis and angiogenesis in rat following middle cerebral artery occlusion[J]. Aging and Disease,2015, 6(4):245-253.
[9] REN C, LIU K, CUI X, et al. Neural transmission pathways are involved in the neuroprotection induced by post but not per-ischemic limb remote conditioning[J]. Brain Circ,2016,1(2):160-167.
[10] BELAYEV L, ALONSO O F, BUSTO R, et al. Middle cerebral artery occlusion in the rat by intraluminal suture. Neurological and pathological evaluation of an improved model[J]. Stroke,1996,27:1616-1622.
[11] 刘慧兰,尉中民.尉中民应用当归芍药散治疗妇科病经验[J].中国中医药信息杂志,2015,22(8):108-109.
[12] 马鸿斌.经方临床活用举隅[J].中国中医药信息杂志,2012,19(11):83.
[13] 李萍,李忠业.当归芍药散治疗内科疾病研究进展[J].广西中医药, 2012,35(6):313-315.
[14] 赵义纯,陆曙,易晓净.当归芍药散治疗脑梗死风痰瘀阻证及对MMP-9的干预作用[J].中国中医急症,2013,22(2):323-324.
[15] LEHNARDT S. Innate immunity and neuroinflammation in the CNS:the role of microglia in Toll-like receptor-mediated neuronal injury[J]. Glia,2010,58(3):253-263.
[16] WENG L, ZHANG H, LI X, et al. Ampelopsin attenuates lipopolysaccharide-induced inflammatory response through the inhibition of the NF-kappa B and JAK2/STAT3 signaling pathways in microglia[J]. International Immunopharmacology,2017,44:1-8.
[17] AMOR S, PUENTES F, BAKER D, et al. Inflammation in neurodegenerative diseases[J]. Immunology,2010,129(2):154-169.
[18] PERRY V H, NICOLL J A, HOLMES C. Microglia in neurodegenerative disease[J]. Nature reviews Neurology,2010,6(4):193-201.
Protective Effects ofPowder on the Brain of Mice with Cerebral Ischemic Stroke
LI Haiyan1, YANG Yong2, GAO Chen1, REN Changhong1
To observe the protective effects ofPowder (DSS) on the brain of mice with cerebral ischemic stroke; To explore its possible mechanism.Adult C57 male mice were used to create the middle cerebral artery obstruction (MCAO) model. Mice which were randomly divided into sham-operation group, MCAO group and DSS group. The mice were scored for neurological function and TTC staining of brain tissue, and the neurological function and cerebral infarction volume were observed. Immunofluorescence staining and electrochemical luminescence were used to detect the levels of brain tissue related indicators.Compared with the MCAO group, the cerebral infarction volume of DSS group was reduced (<0.001), the number of apoptosis decreased (<0.05), the neurological function was restored (<0.01), and the number of microglia/macrophages decreased (<0.01). Meanwhile, DSS promoted the polarization of M2-type macrophages/microglias (<0.01), decreased the expression of pro-inflammatory factors and increased the expression of anti-inflammatory factors (<0.01,<0.001).DSS has brain protective effects on brain of male mice with ischemic stroke, and the mechanism may be related to inhibiting cell apoptosis and regulating microglial polarization.
Powder; cerebral ischemic stroke; microglia polarization; inflammatory reaction; mice

R285.5
A
1005-5304(2020)06-0038-06
10.3969/j.issn.1005-5304.201911279
国家自然科学基金(81573867、81473591)
任长虹,E-mail:rench@xwhosp.org
(2019-11-14)
(2019-12-18;编辑:华强)
