UPLC-MS/MS法测定人全血中吲达帕胺浓度及其生物等效性研究
2020-07-08郑桂茹张梦琪张荷丽陆晓佩董春霞曹维锷
郑桂茹,张梦琪,张荷丽,陆晓佩,董春霞,曹维锷
(1.浙江省金华市人民医院药剂科,浙江金华 321000;2.上海市徐汇区中心医院中心实验室,上海药物Ⅰ期临床暨药物一致性评价工程技术研究中心,上海 200031;3.重庆药友制药有限责任公司医学部,重庆 401121;4.上海市徐汇区中心医院急诊科,上海 200031)
吲达帕胺是一种噻嗪类利尿剂,对轻、中度原发性高血压效果良好。除了利尿特性外,该药对高血压动物模型的靶器官损伤还具有保护作用,因此在临床上通常作为大多数高血压患者尤其是老年高血压患者的首选治疗药物。吲达帕胺口服吸收迅速且完全,生物利用度高达96%,血浆蛋白结合率为71%~79%。吲达帕胺的检测方法有LC-MS/MS[1-6]、LC-MS[7]或HPLC-UV[8-10]法,近年来更多的研究采用了LC-MS/MS法对血清、血浆、全血等不同基质中的吲达帕胺浓度进行检测。由于吲达帕胺与红细胞的结合率高,其全血浓度较血浆浓度、血清浓度更为稳定[1],因此以全血浓度作为一致性评价更为恰当。本研究参考文献方法,建立了一种检测人全血中吲达帕胺浓度的UPLC-MS/MS法,按照《中华人民共和国药典》2015年版附录9012的生物样品定量分析指导原则[11]进行方法学验证,对重庆药友制药有限责任公司生产的吲达帕胺片(2.5 mg/片)与法国Les Laboratoires Servier公司生产的吲达帕胺片(2.5 mg/片)进行了生物等效性评价。
1 材料和方法
1.1 仪器 LC-30超高效液相色谱系统(日本岛津公司);Acquity UPLC BEH C18色谱柱、Acquity UPLC柱专用在线过滤器(美国Waters公司);API 4000三重四级杆串联质谱仪(美国Sciex公司);BS110S万分之一电子天平、CP225D十万分之一电子天平(德国赛多利斯公司);Mikro 22R台式冷冻高速离心机(德国海蒂诗公司);Vortex-2旋涡混合器(美国Scientific Industries公司);SB3200超声仪(上海必能信超声有限公司)。
1.2 药品和试剂 吲达帕胺对照品(纯度98%,美国药典委员会公司,批号H2M026);氘3-吲达帕胺(纯度97%,加拿大TRC公司,批号4-YSW-58-1);甲醇、乙腈(色谱纯,德国Merck公司);甲酸、甲酸铵(色谱纯,美国CNW公司);超纯水[上海市徐汇区中心医院使用超纯水机(美国Millpore公司)自制]。
1.3 色谱条件 色谱柱:Acquity UPLC BEH C18柱(50 mm×2.1 mm,1.7 μm);流动相:含0.001%甲酸和0.5 mmol/L甲酸铵的水溶液-乙腈(60∶40,V/V),流速为0.6 ml/min;进样量3 μl;洗针液:甲醇;清洗体积:1 ml;以氘3-吲达帕胺为内标。
1.4 质谱条件 采用电喷雾离子源(ESI),负离子多反应监测(MRM)扫描模式。离子源电压为-4500 V,离子源温度550 ℃;雾化气压力413.7 kPa(60 psi),辅助气压力413.7 kPa(60 psi),气帘气压力172.4 kPa(25 psi),碰撞气压力68.95 kPa(10 psi)。吲达帕胺和内标的离子通道分别选择m/z364.0 →188.9和m/z367.0 →188.9。
1.5 溶液的配制 精密称量吲达帕胺对照品及内标适量,溶解于甲醇中,制得吲达帕胺对照品储备液(1×106ng/ml)和内标对照品储备液(1.0×105ng/ml),4 ℃储存。取适量吲达帕胺对照品储备液,用含50%甲醇的水溶液稀释,配制成浓度为30、60、150、300、1200、2400、3000 ng/ml的标准曲线工作液和浓度为30、90、450、2250、11 250 ng/ml的质控工作液。取适量内标对照品储备液,用含50%甲醇的水溶液稀释,配制成浓度为200 ng/ml的内标工作液。
1.6 全血样品预处理 取50 μl全血样品置1.5 ml EP管中,添加5 μl内标工作液及50 μl含20%甲醇的水溶液,混旋10 s,超声振荡30 s,然后添加乙腈200 μl,混旋30 s,放入4 ℃离心机中以相对离心力2.515×104×g离心10 min,吸取上清液进样分析。
2 结 果
2.1 质谱分析 取吲达帕胺和内标对照品储备液,用甲醇稀释至1000 ng/ml,按1.4项下质谱条件操作。以吲达帕胺和内标的[M-H]-峰为母离子,分别进行碎片离子扫描。结果显示,吲达帕胺和内标的主要碎片均为188.9 amu,相应的二级质谱扫描图见图1。
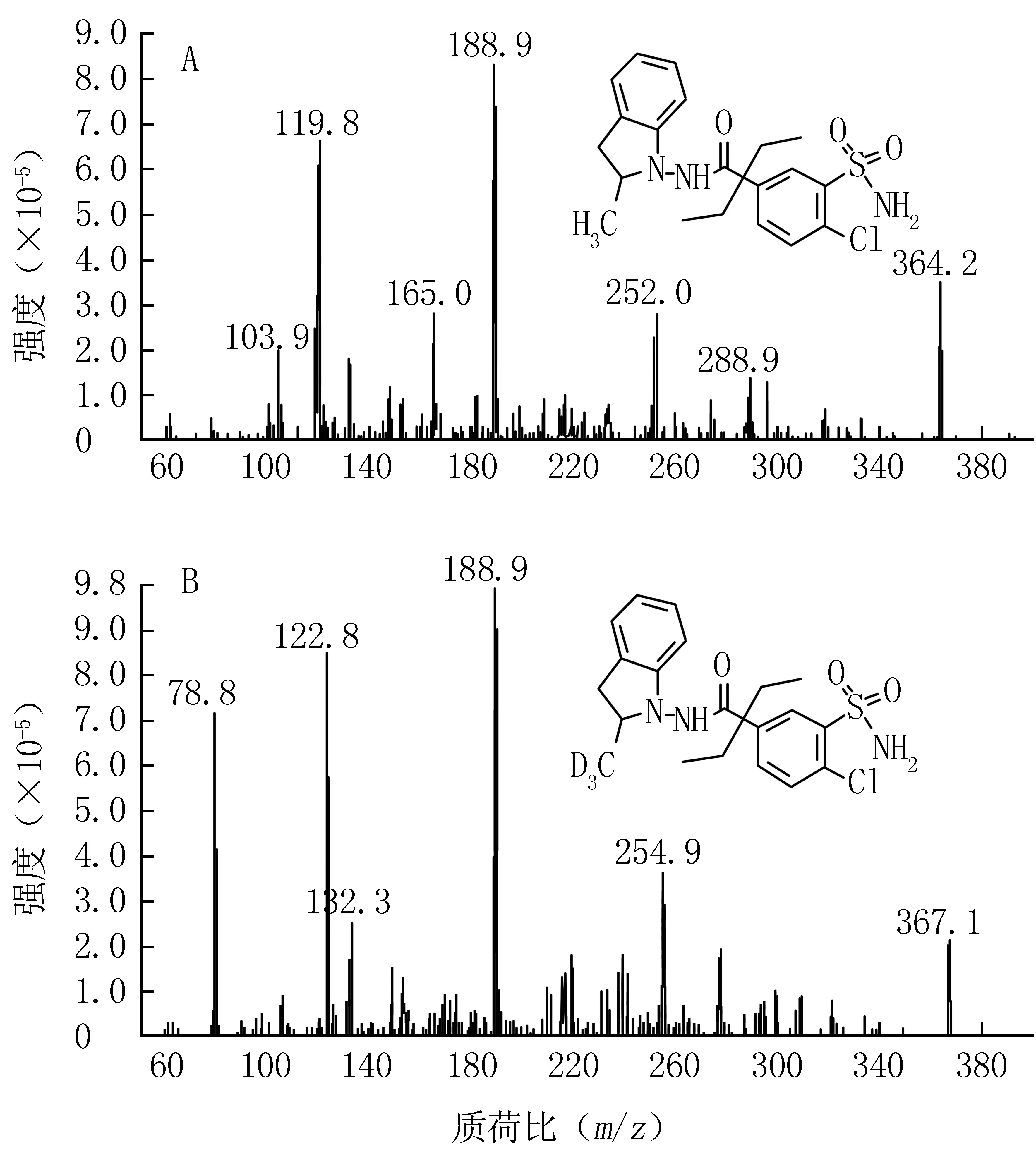
图1 吲达帕胺和内标(氘3-吲达帕胺)的碎片离子扫描图Figure 1 Ion scanning mass spectra of indapamide and internal standard (deuterium 3-indapamide)A:吲达帕胺;B:内标(氘3-吲达帕胺)
2.2 特异性考察 选取6份独立来源的空白全血基质,除用5 μl含50%甲醇的水溶液代替内标工作液外,其余步骤按1.6项下全血样品预处理的方法操作,之后进样分析。结果发现,在吲达帕胺和内标的保留时间处都没有内源性物质的干扰。取上述6份独立来源的空白全血基质各45 μl,添加吲达帕胺质控工作液5 μl,配制成最低定量限(3 ng/ml)和高浓度(225 ng/ml)的质控样品,每份来源每个浓度各3份,按1.6项下全血样品预处理的方法操作,然后进样检测。结果显示,吲达帕胺的准确度为86.52%~103.1%,RSD<2%,表明不同来源的全血基质不影响测定结果的准确性。色谱图见图2。
2.3 线性范围的考察 取空白全血45 μl,添加吲达帕胺标准曲线工作液5 μl,配制成浓度分别为3、6、15、30、120、240、300 ng/ml的全血标准曲线工作液,按1.6项下全血样品预处理的方法操作,然后进样分析。以理论浓度为横坐标(X),吲达帕胺与内标的峰面积比值为纵坐标(Y),经“1/X”权重,进行线性回归分析,得到标准曲线方程:Y=0.030 9X+0.013 2(r=0.999 9)。结果表明,吲达帕胺全血样品在3~300 ng/ml浓度范围内线性良好,本方法的最低定量浓度为3 ng/ml,信噪比>300。
2.4 精密度和准确度实验 取空白全血45 μl,添加吲达帕胺质控工作液5 μl,配制成浓度分别为3、9、45、225、1125 ng/ml的全血质控样品各6份,其中1125 ng/ml的全血质控样品用空白全血稀释至5倍体积。所有全血质控样品连续测定3批,求得准确度及批内、批间精密度。结果显示,所有质控样品的批内、批间准确度在93.11%~105.1%,批内、批间RSD均<5.76%,结果见表1。
2.5 提取回收率的测定 测定低、中、高浓度(9、45、225 ng/ml)的全血质控样品各6份,得到峰面积A1, 同时取空白全血样品, 按1.6项下全血样品预处理方法操作后,加入适量吲达帕胺和内标工作溶液,配制成相当于低、中、高浓度的全血质控样品理论进样浓度的溶液各6份,进样分析,得到峰面积A2,以A1/A2的比值计算吲达帕胺和内标的提取回收率。结果吲达帕胺低、中、高浓度的提取回收率分别为(92.48±7.72)%、(91.78±6.61)%、(88.66±4.05)%(n=6),内标的提取回收率为(91.31±2.46)%(n=18)。
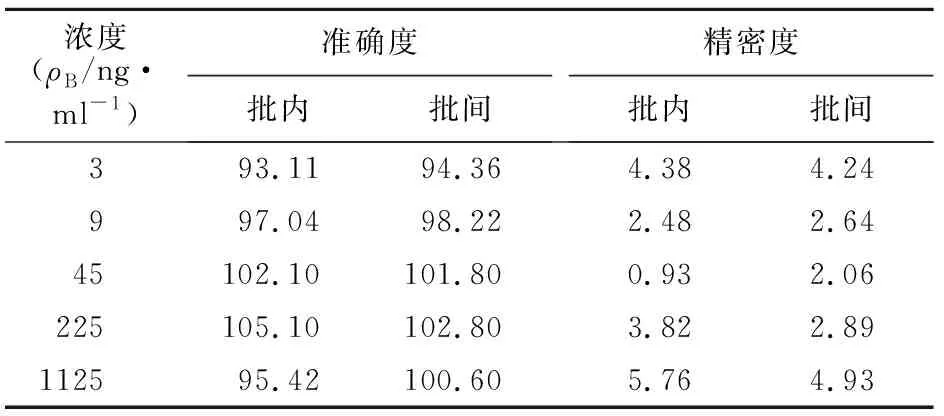
表1 吲达帕胺含量测定的准确度和精密度实验结果Table 1 Results of accuracy and precision tests in content determination of indapamide (%)
2.6 基质效应 取6个不同来源的空白全血各3份,除不添加内标工作液外,其余步骤按1.6项下全血样品预处理方法操作,然后在所得上清液中添加5 μl低、高浓度(90、2250 ng/ml)质控工作液和5 μl内标工作液进样分析,所得峰面积与相同浓度吲达帕胺和内标的对照品溶液峰面积比较,计算吲达帕胺、内标及内标归一化基质因子。结果显示,6份不同来源低、高浓度全血的内标归一化基质因子分别为(0.99±0.68)%和(1.00±1.76)%(n=18),RSD<2%。
2.7 稳定性试验 考察低、高浓度(9、225 ng/ml)的全血样品在室温存放24 h、反复冻融3次、-20 ℃冻存31 d、-80 ℃冻存59 d、在2~8 ℃自动进样器中存放43 h的稳定性。结果表明,以上条件下全血样品中的吲达帕胺均能保持稳定。结果见表2。
2.8 生物等效性考察 26例健康受试者空腹口服单剂量2.5 mg吲达帕胺片受试制剂(规格:2.5 mg/片,重庆药友制药有限责任公司)与参比制剂(规格:2.5 mg/片,法国Les Laboratoires Servier公司,商品名 Natrilix)后,于给药前(0 h)和给药后0.25、0.5、1、1.5、2、2.5、3、3.5、4、6、8、12、24、48、72 h采集全血样本各约3 ml,使用本研究建立的UPLC-MS/MS方法对全血中吲达帕胺浓度进行检测,评价两制剂间是否具有生物等效性。该研究经上海市徐汇区中心医院伦理委员会批准,受试者均签署了知情同意书。26例健康受试者空腹口服吲达帕胺片受试制剂和参比制剂后的主要药动学参数见表3,平均血药浓度-时间曲线见图3。
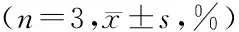
储存条件低浓度(9 ng/ml)高浓度(225 ng/ml)室温放置24 h96.64±3.0296.00±5.64反复冻融3次92.79±2.8693.91±2.84-20 ℃冻存31 d91.68±5.2792.10±3.57-80 ℃冻存59 d98.98±6.3091.91±4.082~8 ℃自动进样器放置43 h96.91±2.3092.04±5.84
表3 单剂量口服2.5 mg吲达帕胺片后的主要药动学参数
Table 3 Main pharmacokinetic parameters of indapamide after single oral administration of 2.5 mg indapamide tablets
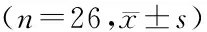

组别λz(h-1)t1/2(t/h)tmax(t/h)cmax(ρB/ng·ml-1)AUC0~t(A/ng·h·ml-1)AUC0~∞(A/ng·h·ml-1)受试制剂0.05±0.0113.99±1.712.0±0.5114.28±17.381 746.80±297.161 861.97±295.10参比制剂0.05±0.0114.21±1.782.0±1.096.27±13.361 717.94±277.491 835.28±265.85
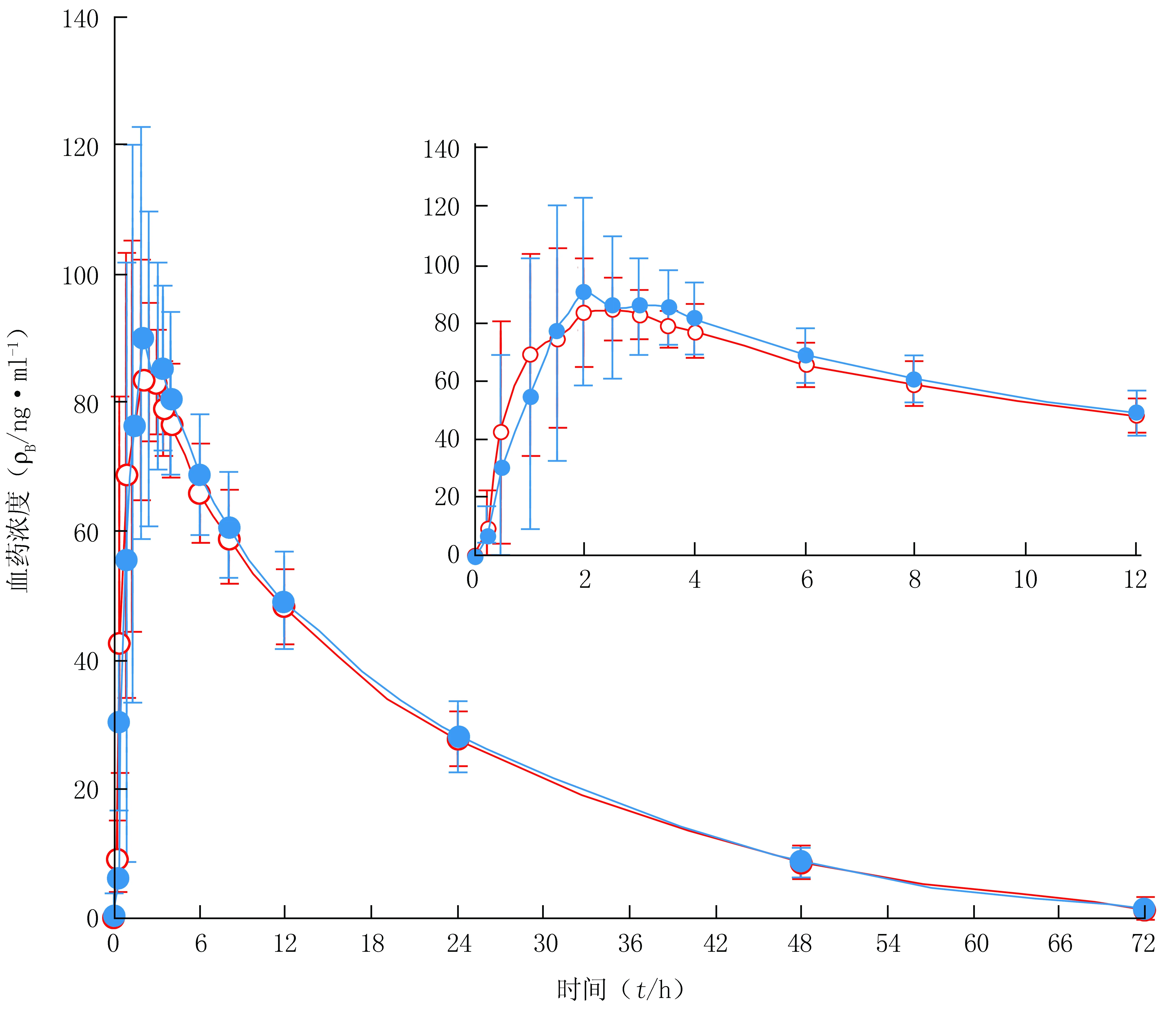
图3 受试者单剂量口服2.5 mg吲达帕胺片后的平均血药浓度-时间曲线Figure 3 Mean plasma concentration-time curves of indapamide after single oral administration of 2.5 mg indapamide tablets

3 讨 论
吲达帕胺在ESI正、负模式下均能产生分子离子峰,且MRM信号强度相似,文献报道也有不同的选择[1-7];考虑到一般情况下负离子模式的干扰更小,本研究采用了负离子模式进行检测。在流动相的选择方面,本研究以甲酸为添加剂获得了良好的色谱峰型;同时,为了避免甲酸对负离子模式下吲达帕胺电离的抑制,仅添加了0.001%的甲酸,以此兼顾了良好的色谱行为及灵敏度。另外,本研究建立的方法存在显著的基质增强效应,基质的存在使吲达帕胺及内标的绝对响应提高了70%以上,而由于内标是吲达帕胺的稳定同位素,其与吲达帕胺跟随性良好,内标归一化基质因子在0.977~1.030范围内,RSD<2%,因此基质增强效应并不影响检测的准确度。
本研究使用乙腈对全血样品进行蛋白沉淀,用UPLC-MS/MS法测定吲达帕胺浓度,方法操作简便,仅需50 μl全血样品,定量下限为3 ng/ml,分析时间为1.5 min,方法灵敏、准确、通量高、稳定性好,各项方法学参数完全满足《中华人民共和国药典》2015年版附录9012:生物样品定量分析指导原则[12]的规定,适用于吲达帕胺的临床药动学及生物等效性研究。
