急性脑梗死或短暂性脑缺血发作患者抗血小板治疗后血小板高反应性影响因素分析
2020-07-08倪晓珺逄晓云
倪晓珺,逄晓云
(上海交通大学医学院附属仁济医院药剂科,上海 200127)
阿司匹林、氯吡格雷单联或双联抗血小板治疗是非心源性脑梗死急性期及二级预防的主要治疗手段,可显著降低卒中复发风险。然而,仍有部分接受规范抗血小板治疗的患者发生缺血性事件。对抗血小板药物反应性低下被称为抗血小板药物抵抗,其中通过体外测定判定的血小板活性抑制不足被称为抗血小板治疗后血小板高反应性(high on-treatment platelet reactivity,HTPR)或实验室抵抗(laboratory resistance)。已有研究显示,血栓弹力图(thromboelastography,TEG)可同时检测氯吡格雷和阿司匹林的血小板反应性,并预测经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术后缺血性事件的发生风险,但TEG用于缺血性脑梗死的研究较少。本研究通过TEG测定血小板反应性,评估HTPR的发生率及影响因素,为进一步预测卒中复发风险提供依据。
1 资料和方法
1.1 研究对象 纳入2015年6月至2016年4月在上海交通大学医学院附属仁济医院神经内科治疗的急性脑梗死或短暂性脑缺血发作(transient ischemic attack,TIA)患者267例。纳入标准:(1)急性非心源性脑梗死或TIA发病7 d内;(2)年龄>20岁;(3)MRI证实为急性脑梗死;(4)入院后24 h内予阿司匹林和氯吡格雷双联抗血小板治疗。排除标准:(1)出血性卒中及其他出血性疾病;(2)有阿司匹林或氯吡格雷使用禁忌证;(3)患有严重肝病;(4)血小板计数<100×109/L或>500×109/L;(5)患有恶性肿瘤;(6)入院前口服抗凝药。所有患者入院时均未进行溶栓治疗。
1.2 药物治疗 所有患者入院后均予双联抗血小板治疗,阿司匹林100~300 mg/d和氯吡格雷75 mg/d。患者可同时使用他汀类、钙离子拮抗剂、质子泵抑制剂(泮托拉唑或兰索拉唑)等药物治疗。
1.3 血小板抑制率的测定 服用阿司匹林和氯吡格雷至少5 d后,抽取外周静脉血,用血栓弹力图仪(美国Haemoscope公司)按说明书进行测定。阿司匹林抑制率(%)=[(MAthrombin―MAAA)/(MAthrombin―MAfibrin)] ×100%,氯吡格雷抑制率(%)=[(MAthrombin―MAADP)/(MAthrombin―MAfibrin)] ×100%。
1.4 HTPR分组 将二磷酸腺苷(ADP)诱导的血小板聚集抑制率<30%或花生四烯酸(AA)诱导的血小板聚集抑制率<50%定义为HTPR,将ADP诱导的血小板聚集抑制率≥30%且AA诱导的血小板聚集抑制率≥50%定义为治疗后血小板正常反应性(NTPR),并据此将患者分为ADP-HTPR组和ADP-NTPR组、AA-HTPR组和AA-NTPR组。
1.5 资料分析 一般人口统计学资料:性别、年龄、身体质量指数(BMI)、既往史;实验室指标:白细胞计数(WBC)、血红蛋白(Hb)、血小板计数(PLT)、丙氨酸转氨酶(ALT)、尿素氮(BUN)、血肌酐(Scr)、尿酸(UA)、空腹血糖(Glu)、糖化血红蛋白(HbA1c)、凝血酶原时间(PT)、活化部分凝血酶时间(APTT)、纤维蛋白原(Fgb)、D-二聚体、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、红细胞沉降率(ESR)、高敏C反应蛋白(hs-CRP);TEG参数:R值、K值、α角、MAthrombin。分析上述因素与HTPR的相关性。
2 结 果
2.1 研究对象的一般情况 该回顾性观察性研究共纳入267例患者,其中255例(95.5%)脑梗死,12例(4.5%)TIA。根据服用双联抗血小板药物后的TEG检测结果,将患者分为HTPR组和NTPR组,并进一步分为ADP-NTPR组和ADP-HTPR组以及AA-NTPR组和AA-HTPR组。HTPR组45例(16.9%),NTPR组222例(83.1%),ADP-HTPR组38例(14.2%),ADP-NTPR组229例(85.8%),AA-HTPR组14例(5.2%),AA-NTPR组253例(94.8%)。NTPR组平均年龄(64.3±10.7)岁,男性153例(68.9%),女性69例(31.1%)。HTPR组平均年龄(66.8±10.9)岁,男性26例(57.8%),女性19例(42.2%)。
2.2 HTPR的单因素分析 ADP-HTPR组与ADP-NTPR组、AA-HTPR组与AA-NTPR组单因素分析结果见表1。ADP-HTPR组与ADP-NTPR组在Hb、PLT、慢性肾脏病3~4期、Scr、ESR、MAthrombin、AA-HTPR等因素方面的差异有统计学意义,其余一般资料、实验室指标、TEG参数差异均无统计学意义。AA-HTPR组与AA-NTPR组在一般资料、实验室指标、TEG参数等方面的差异均无统计学意义(P>0.05)。
2.3 HTPR的多因素分析 单因素分析中,Hb、PLT、慢性肾脏病3~4期、ESR、MAthrombin、 AA-HTPR等因素差异有统计学意义。将上述因素作为自变量,氯吡格雷治疗后的血小板反应性作为因变量,采用二分类logistic回归分析。结果显示,AA-HTPR为氯吡格雷治疗后HTPR的独立危险因素[OR=8.50,95%CI (2.48~29.14)]。结果见表2。
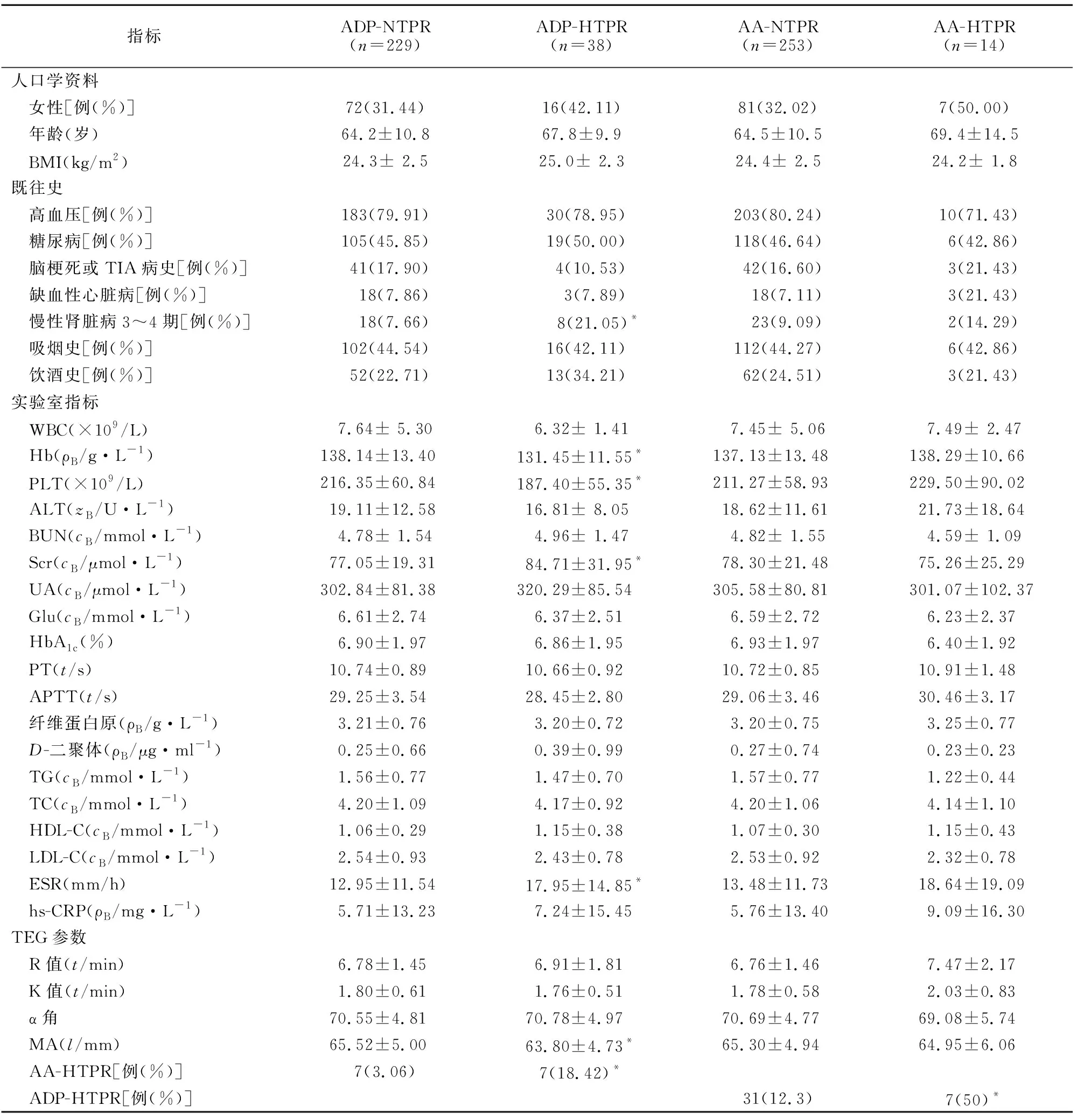
表1 阿司匹林和氯吡格雷双联抗血小板治疗中血小板高反应性与低反应性的单因素分析Table 1 Univariate analysis of HTPR and NTPR after dual antiplatelet therapy with aspirin and clopidogrel
BMI:身体质量指数;ADP:二磷酸腺苷;NTPR:治疗后血小板正常反应性;HTPR:治疗后血小板高反应性;AA:花生四烯酸;TIA:短暂性脑缺血发作;WBC:白细胞计数;Hb:血红蛋白;PLT:血小板计数;ALT:丙氨酸转氨酶;BUN:尿素氮;Scr:血肌酐;UA:尿酸;Glu:空腹血糖;HbA1c:糖化血红蛋白;PT:凝血酶原时间;APTT:活化部分凝血酶时间;TG:三酰甘油:TC:总胆固醇;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;ESR:红细胞沉降率;hs-CRP:高敏C反应蛋白;TEG:血栓弹力图;MA:血栓最大幅度;*P<0.05,与相应的NTPR组比较
3 讨 论
抗血小板治疗是非心源性脑梗死和TIA的基石,可使卒中或死亡的相对风险降低22%[1]。阿司匹林不可逆地抑制环氧合酶-1的合成,抑制血栓素A2生成,从而抑制血小板聚集。氯吡格雷活性代谢产物不可逆地抑制ADP与血小板受体结合, 随后抑制ADP介导的糖蛋白(GP) Ⅱb/Ⅲa 复合物的活化,从而抑制血小板的聚集。阿司匹林与氯吡格雷是临床证据最充分的脑梗死二级预防药物,被国内外指南推荐[2]。部分患者在控制危险因素、规范抗血小板治疗后仍不能避免脑梗死的复发,抗血小板治疗反应多样性是原因之一。

表2 ADP-HTPR的多因素回归分析Table 2 Multivariate regression analysis of ADP-HTPR
ADP-HTPR:二磷酸腺苷-治疗后血小板高反应性;CKD:慢性肾脏病;MA:血栓最大幅度;AA-HTPR:花生四烯酸-治疗后血小板高反应性
现有多种方法用于血小板功能的测定,光学比浊法是检测血小板功能的金标准,价格低廉,与临床事件相关性好,但所需血量大,技术要求高,耗时长,难以标准化,在临床推广使用困难。VerifyNow法是一种新型快速检测方法,原理类似光学比浊法,检测结果与光学比浊法有较好的相关性,优点是操作简便,可在床旁自动完成检测。在国外,VerifyNow法已逐渐成为临床主要的血小板功能检测方法,但其价格昂贵,限制了在国内的临床应用[3]。TEG是目前国内使用较多的血小板功能检测方法,通过全血直接测定凝血功能与血小板活性,操作简便、快速。Jeong等[4]的研究表明,TEG检测结果与光学比浊法有较好的相关性,故本研究采用TEG法测定阿司匹林与氯吡格雷治疗后的血小板功能。
本研究发现,脑梗死或TIA患者经阿司匹林和氯吡格雷双联抗血小板治疗后,HTPR发生率为16.9%,其中AA-HTPR 5.2%,ADP-HTPR 14.2%。RAO等[5]的研究显示,HTPR在轻度卒中或TIA患者中的发生率为22.7%,AA-HTPR 为5.4%,ADP-HTPR 为19.1%。Rosafio等[6]在对脑梗死患者的研究中发现,阿司匹林治疗后的HTPR发生率低于氯吡格雷治疗。本研究结果与上述研究结果一致。Kinsella等[7]报道单用氯吡格雷患者中有44%为HTPR。一项荟萃(meta)分析显示,脑梗死或TIA患者中,单用阿司匹林治疗患者的AA-HTPR为3%~62%,单用氯吡格雷治疗患者的ADP-HTPR为8%~61%[8]。由于不同研究的研究对象纳入标准不同,血小板反应性的检测方法亦不相同,故HTPR的结果有较大差异。
HTPR的影响因素包括遗传因素、细胞因素和临床因素。遗传因素指氯吡格雷的吸收、代谢和发挥生物活性的过程受到多种基因多态性的影响。细胞因素与血小板更新速度、P2Y12和P2Y1受体上调等因素有关。临床因素则考虑到了用药剂量、用药依从性、患者基础疾病(如糖尿病、肾功能不全)对血小板活性的影响。本研究人群中糖尿病的发生率高达46.4%,慢性肾脏病3~4期的发生率为9.7%。单因素分析显示,Hb、PLT、ESR、慢性肾脏病3~4期、Scr、MAthrombin等因素为ADP-HTPR的影响因素。研究显示,慢性肾脏病患者促凝血因子活性增强,内源性抗凝物质减少,血小板活化和聚集功能增强[9],本研究也证实了这一点。上述影响因素经logistic回归分析后发现,阿司匹林抵抗为氯吡格雷HTPR的独立危险因素。由于本研究为单中心研究,受样本量的限制,尚需要前瞻性、多中心、大样本量研究来进一步证实这些因素对HTPR的影响。
HTPR与心血管领域临床不良事件的相关性已得到充分认识,研究显示HTPR与心血管疾病患者血管事件的复发相关。Krasopoulos等[10]研究发现,阿司匹林抵抗组发生血管事件、死亡和急性冠脉综合征的风险分别为非抵抗组的3.85倍[95%CI (3.08~4.80)]、5.99倍[95%CI (2.28~15.72)]和4.06倍[95%CI (2.96~5.56)]。Geisler等[11]研究发现,冠脉支架植入术后患者的氯吡格雷HTPR与3个月内主要心血管事件的发生风险显著相关[风险比(HR) 3.71,95%CI (1.08~12.69)]。脑梗死或TIA患者中HTPR的研究相对较少。Kim等[12]的研究显示,脑梗死急性期阿司匹林治疗后HTPR会增加血管事件风险,连续测量血小板反应性可及早识别高风险人群。RAO等[13]的研究发现,ADP-HTPR增加小卒中或高风险TIA患者缺血性事件的发生风险。HTPR与脑血管病患者预后的相关性已得到临床重视,对HTPR在脑血管病人群中的作用机制和影响因素的研究,及对高风险人群采取个体化的抗血小板治疗,有望进一步减少缺血事件的发生。本研究的局限性是:单中心研究样本量少,未纳入患者的基因信息,未随访及观察患者的预后。对于缺血性脑血管病患者HTPR的影响因素尚需高质量、大样本、长随访期的临床研究,明确血小板功能指导卒中患者抗血小板治疗的价值,有选择性、有针对性地对特定人群进行血小板功能检测,实施个体化、精准的抗血小板治疗策略, 以提高脑梗死二级预防的有效性和安全性。
