药用真菌对山药基质的双向发酵适应性评价
2020-07-08李慧星郭书贤
李慧星 许 彬* 李 斌 郭书贤 李 杰
(1 南阳理工学院 生物与化学工程学院 河南南阳473004 2 河南省工业微生物资源与发酵重点实验室 河南南阳473004)
山药是我国的传统食物, 也是药食同源食物之一,为薯蓣科薯蓣属(Dioscorea opposita)植物薯蓣的块根[1]。 山药中营养成分丰富,具有很强的抗氧化活性,含有丰富的山药皂甙、山药多糖等抗氧化活性成分[2-3]。 山药皂甙对1,1-二苯基-2-三硝基苯肼(DPPH)自由基有较强的清除能力[4],山药多糖的抗氧化性随着浓度的提高而显著增强[5]。
山药中碳水化合物主要是淀粉, 同时还含有一定量纤维素,可以作为药用真菌发酵的底物;山药中的其它成分,如蛋白质、自由氨基酸、微量元素能促进药用真菌的生长代谢和抗氧化活性物质(如多糖、三萜)的生成[6]。同时,真菌在生长代谢过程中凭借菌丝的穿透能力、 水解酶和氧化酶的酶解能力[6-9],可以解聚山药基质的细胞结构,促进抗氧化活性物质(如山药多糖、多酚、皂甙)的释放。另外, 药用真菌不仅本身能代谢产生具有抗氧化活性的物质[8,10-11],还可能对山药基质中某些成分进行转化, 生成一些基质中原本不具有的抗氧化活性物质。 药用真菌在山药基质上的发酵具有双向性[12],所得菌质可能具有更高的抗氧化活性,可以开发成为具有抗氧化功能的食品, 从而显著增加山药的附加值。
本试验基于双向发酵技术, 利用云芝、 黑木耳、蛹虫草、羊肚菌、银耳、榆耳、香菇、灵芝、猴头菌、猪苓10 种药用真菌,以山药作为培养基进行固态发酵。从山药基质被利用的状况、菌质的抗氧化活性以及培养耗时几个方面,分析山药-药用真菌双向发酵体系的适应性, 筛选出适应于山药基质的药用真菌。以布满时间、菌质折干率、消耗率、抗氧化活性为指标, 利用主成分分析方法评价药用真菌对山药基质的适应性。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 马铃薯、山药,购于家乐福超市;葡萄糖、琼脂、水杨酸、无水乙醇、硫酸亚铁、过氧化氢、磷酸二氢钾、硫酸镁、三羟甲基氨基甲烷、盐酸、连苯三酚,分析纯,购于天津市科密欧化学试剂有限公司;维生素B1,购于天津市光复精细化工研究所;琼脂粉,购于北京奥博星生物技术有限责任公司;2,2-二苯基-1-苦基肼(TCI),购于合肥博美生物科技有限责任公司。
1.1.2 菌种 云芝(Trametes versicolor,50001)、黑木耳(Auricularia auricula,14008)、 蛹虫草(Cordyceps militaris,14013)、 羊肚菌(Morchella sp.,14033)、银耳(Tremella fuciformis,50179)、榆耳 (Gloeostereum incarnatum,14024)、 香菇(Lentinula sp.,14035)、 灵芝(Ganoderma lucidium,14025)、猴头(Hericium erinaceus,14026)、猪苓(Polyporus umbellatus,14069),购于中国工业微生物菌种保藏管理中心(CICC)。
1.2 主要仪器设备
PHS-3C 精密pH 计,上海仪电科学仪器股份有限公司;TDL-40C 低速台式大容量离心机,湘仪离心机仪器有限公司;TU-1901 双光束紫外可见分光光度计, 北京普析通用仪器有限责任公司;0107 超声波细胞破碎机,冠森生物科技;FreeZoneTriadFM2.5L 真空冷冻干燥机, 美国LABCONCO;TG16-WS 台式高速离心机,湘仪离心机仪器有限公司;LRHS-300-Ⅱ恒温恒湿培养箱,上海跃进医疗器械有限公司;LDZX-30FB 立式灭菌器, 上海申安医疗器械有限公司。
1.3 方法
1.3.1 固体菌种制备 采用综合PDA 培养基制备双向发酵用菌种。将灭菌后的培养基倒平板,冷却凝固后接种真菌的琼脂菌块,在25 ℃,RH 75%培养至菌丝布满平板,备用。
1.3.2 山药-药用真菌双向发酵方法 将山药洗净,切碎成2 mm 左右的颗粒,自然晾干(含水量10%)。 称取25 g 干燥山药装于培养瓶中,添加蒸馏水,调整含水量为65%,浸润2 h,得到山药基质。 将装有山药基质的培养瓶置于121 ℃下灭菌30 min。
将1.3.1 节中所得固体菌种切成约1 cm 的菌块,挑出接入山药培养基中,每个培养瓶接8 块,每种菌种接两瓶。将接种好的山药培养基放入25℃,RH 75%的恒温恒湿培养箱中, 培养时间20 d。 以不接种山药培养基作为空白对照。
1.3.3 适应性评价指标
(1)布满时间 按菌丝布满培养瓶所需时间计算,单位:d
(2)折干率和消耗率[13]
折干率=干燥发酵后菌质的质量/发酵后菌质的质量×100%
消耗率=(原山药质量-干燥发酵后菌质质量)/原山药质量×100%
(3)自由基清除率测定
1)菌质的提取 将发酵完成的山药-药用真菌菌质用真空冷冻干燥机进行冷冻干燥, 干燥完成后用研钵将干燥后的菌质研成粉末状。 用无水乙醇按固液比1∶5 超声浸提10 min, 将浸提混合物在4 000 r/min 下离心30 min,倾倒清液,重复浸提一次,合并上清液备用。
2)羟自由基清除率的测定 参考文献[14]测定菌质提取物的羟自由基(·OH)清除率。
3)DPPH 清除率的测定 参照文献[15]测定菌质提取物的2,2-二苯基-1-苦基肼(DPPH)清除率。
4)超氧自由基清除率的测定 参照文献[16]测定菌质提取物的超氧自由基(·O2)清除率。
1.3.4 数据分析 利用Matlab 对数据作主成分分析,分析前对数据进行归一化处理[17]。
2 结果分析
2.1 各菌质的比较
在试验所选10 种真菌中榆耳(14024)和猪苓(14069)在山药基质上生长极其缓慢, 培养20 d时仅有局部生长,因此在分析中剔除这两种菌种。
其余真菌与山药双向发酵后, 各菌质的菌丝布满天数、基质折干率、消耗率、菌质的·OH 清除率、DPPH 清除率、·O2清除率如表1 所示。
折干率反映了发酵后菌质的含水量, 折干率越低,菌质的含水量越高,菌质中固相成分占比越少。灵芝(14025)折干率最高为38.58%。其次是银耳(50179)为37.47%。 香菇(14035)和 蛹虫草(14013)的折干率略低于银耳, 但是折干率都在30%以上。 羊肚(14033)、黑木耳(14008)和猴头(14026)的折干率在23%~25%左右,云芝(50001)的折干率最低为19.41%。 本试验中各菌质的折干率均低于空白对照,说明在发酵过程中,菌丝代谢基质产生了水。
消耗率反映了菌种对山药基质的消耗情况,消耗率越高,说明基质被菌种分解代谢的越多。试验所选真菌中,云芝(50001)的消耗率最高,为59.99%。 羊 肚(14033)、黑 木 耳(14008)和 猴 头(14026)差别不大, 消耗率均在43%左右。 香菇(14035)的消耗率居中,为26.45%。 银耳(50179)的消耗率最低为7.37%。 蛹虫草 (14013)、 灵芝(14025)的消耗率略高于银耳,在11%~15%左右。本试验中各菌质的消耗率均高于空白对照, 说明在发酵过程中,菌种对山药基质均有分解作用,被分解的山药基质一部分转化成菌丝体, 一部分转化成了水、CO2等,因此引起菌质质量减少。
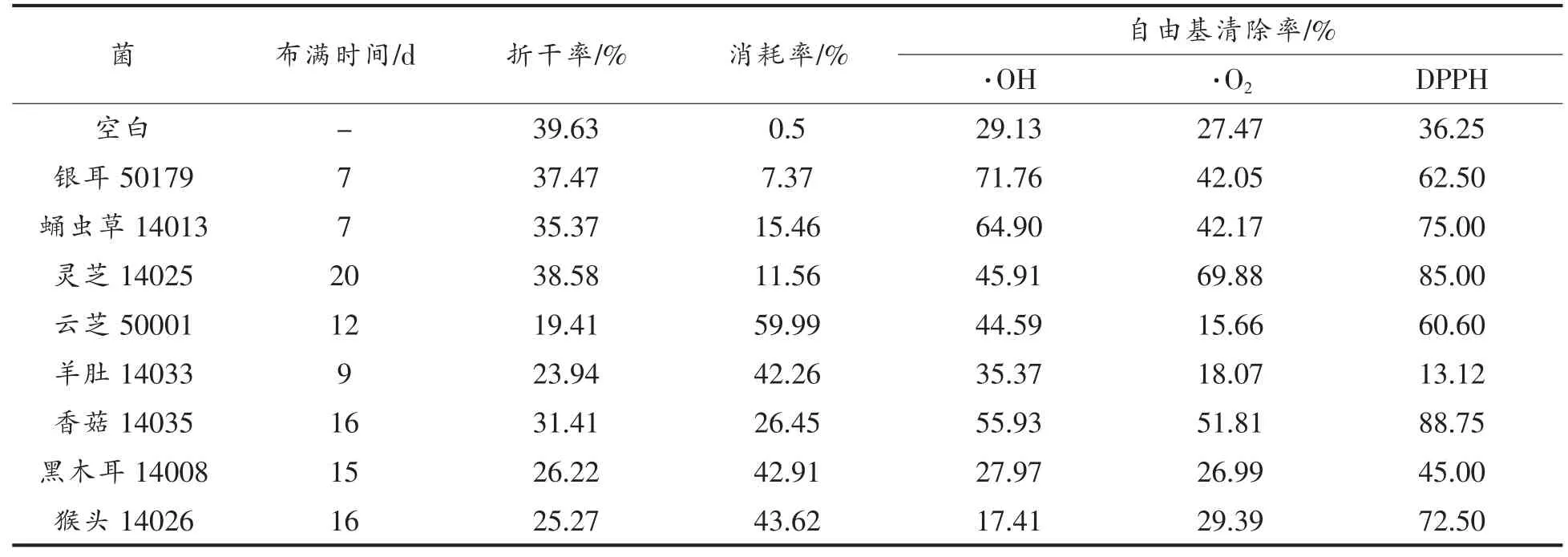
表1 试验结果Table 1 Experiment result
各菌种自由基的清除率差距很大。 黑木耳(14008)、猴头(14026)发酵后的菌质·OH 清除率低于空白对照,云芝(50001)、羊肚(14033)、黑木耳(14008)发酵后,菌质·O2清除率低于空白对照,羊肚(14033)发酵后的菌质DPPH 清除率低于空白对照。这有可能是在发酵过程中,菌丝分解掉了山药本身具有自由基清除能力的成分, 而代谢产物的自由基清除能力低于山药原成分。
2.2 主成分分析
对表1 中的原始数据归一化后采用Matlab进行主成分分析,得到载荷矩阵如表2 所示。
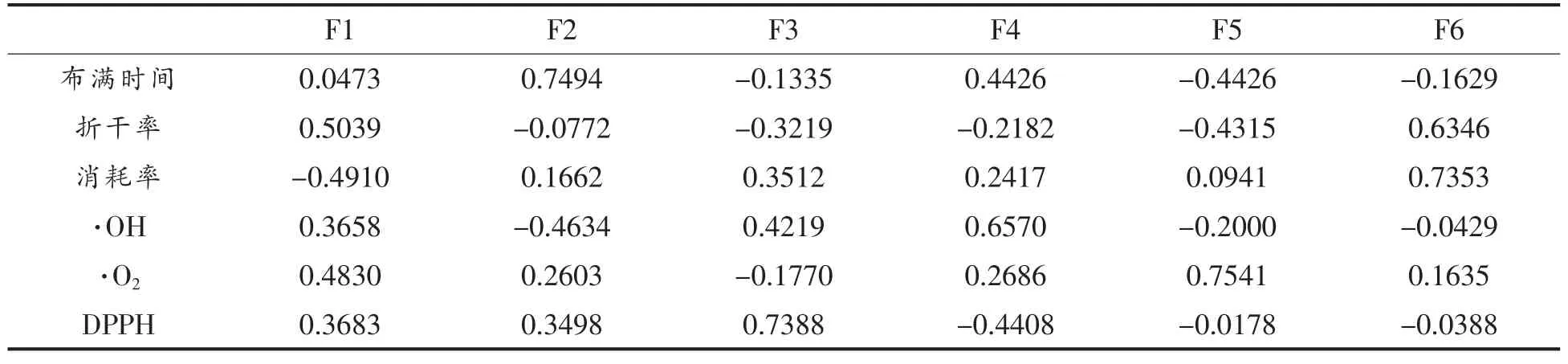
表2 主成分分析旋转后的成分载荷矩阵Table 2 Rotated component matrix of PCA (principle component analysis)
在山药基质上能进行双向发酵的菌种, 不仅能消耗山药基质供自身生长, 还能形成具有更强抗氧化活性的真菌-山药菌质,既该菌种对山药基质具有双向发酵适应性。
第1 个主成分F1 综合了折干率、 消耗率、自由基清除率的信息, 其中折干率在第1 主成分上呈正向载荷分布、消耗率呈负向载荷分布,自由基清除率呈正向载荷分布。即当折干率越高、消耗率越低、各个自由基清除率越高时,F1 越大。 所以可认为F1 是双向发酵适应性因子。第二主成分主要包含布满天数的信息,呈正向载荷分布,可以认为F2 是双向发酵耗时因子。
各主成分的方差及累计贡献率如表3 所示。

表3 方差及累计贡献率Table 3 Variance and accumulative variance contribution
主成分数目的选定既要满足数据降维目的又希望综合尽可能多的信息, 常用累积方差贡献率不低于某一阈值(如85%)来确定主成分[18-20]。本试验中前两个主成分的累计贡献率为89.36%,因此可以保留前2 个主成分进行后续的分析。
主成分的得分矩阵,如表4 所示。
利用表4 中主成分得分绘制得分图, 主成分分析F1、F2 得分图如图1 所示。
本研究中第1 主成分F1、 第2 主成分F2 分别包含了原来信息量的61.01%和28.35%。许多研究者采用主成分分析得分图反映样品与样品指标之间关系[19-20],由图1 能够直观地看出各真菌菌质与主成分F1 和F2 的关系。 灵芝(14025)、香菇(14035)落在F1、F2 的第1 区间内,两者在山药基质上发酵缓慢,但具有良好的双向发酵适应性。灵芝对山药基质的分解程度比香菇低, 但菌质的自由基清除能力高, 因此可以认为灵芝对山药基质具有更好的双向发酵适应性。 但灵芝的生长速度缓慢,发酵耗时长。黑木耳(14008)和猴头(14026)落在F1、F2 第2 区间内, 说明这两种真菌在山药基质上生长缓慢,且双向发酵适应性差,基质被真菌分解程度高, 但菌质不具有更强的自由基清除能力。 羊肚菌(14033)和云芝(50001)落在F1、F2第3 区间内,它们在山药基质上生长较快,对山药基质的分解程度较高, 但所得菌质的自由基清除能力较低,双向发酵适应性较差。蛹虫草(14013)、银耳(50179)落在F1、F2 第4 区间内,它们对山药基质的分解程度较低, 而所得菌质的自由基清除能力较高,具有双向发酵适应性,而且发酵耗时少。
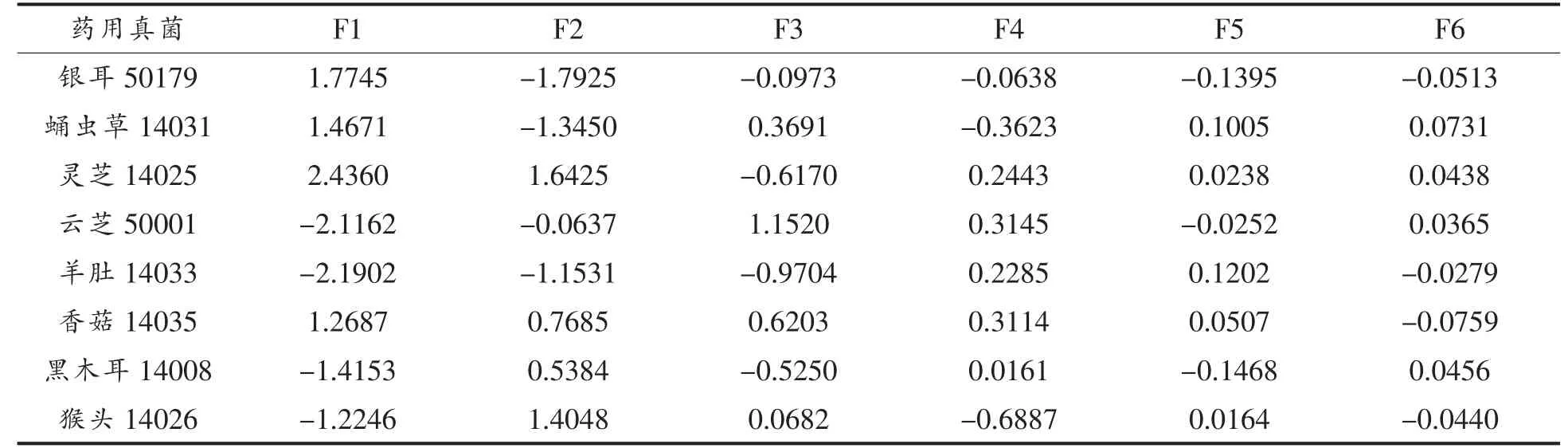
表4 主成分得分矩阵Table 4 Component score matrix

图1 主成分分析F1(双向发酵适应性因子)、F2(双向发酵耗时因子)得分图Fig.1 PCA scores on F1(bidrectional-fermentation adaptability factor )and F2(fermentation time-consuming factor)
3 结论
山药可以作为多种药用真菌的培养基质,经真菌发酵后形成的菌质整体上具有更强的抗氧化活性。
真菌在山药基质上的生长速度一方面由真菌本身性质决定, 另一方面也受到基质成分是否易于被真菌利用的影响。 本试验中所分析菌株均能在山药培养基上蔓延生长, 且菌丝能在基质上均匀分布,说明山药培养基能为这些菌种提供营养,这与杨海龙[6]的报道一致。但因菌种本身生长速度存在差异, 所以菌丝布满培养基所需的时间差别较大。不同菌种对山药基质的利用程度不同,发酵后所得菌质的抗氧化活性也因菌种的不同而存在差异。
药用真菌对山药基质的适应性差别较大。 依据主成分解释及各主成分的方差及累计贡献率,从总变量中提取了2 个主成分, 反映原变量的89.36%的信息。 第一个主成分F1 综合了折干率、消耗率、 自由基清除率的信息即双向发酵适应性因子, 第二主成分主要包含培养天数的信息即双向发酵耗时因子。 结合主成分得分图, 灵芝(14025)、香菇(14035)、蛹虫草(14013)和银耳(50179)对山药基质具有良好的适应性。其中灵芝对山药基质的适应性最好,但发酵耗时也最长。这可能与灵芝本身生长速度缓慢有关。 银耳和蛹虫草在山药基质上生长迅速, 所得菌质也具有较高的抗氧化活性。
