鼠李糖乳杆菌DHC32对小鼠肠道菌群和肠道黏膜免疫的影响
2020-07-08魏莎莎陈旭峰王如福
许 女 魏莎莎 杨 光 陈旭峰 张 浩 王如福*
(1 山西农业大学 食品科学与工程学院 山西太谷030801 2 山西农业大学 实验教学中心 山西太谷030801)
肠道是营养物质消化吸收的主要场所, 同时肠道内栖生着数量大、种类多的菌群,这些菌群在肠道特有的环境条件下发挥着调控宿主营养代谢和促进黏膜免疫系统成熟的双重作用。 正常机体中的肠道菌群与人体及外界环境间保持着相对平衡的状态,一旦有外来刺激,如食物过冷过热、药物、 外来菌等打破这种平衡, 由肠道菌群失调引发、 加重或者与肠道菌群失调有关的疾病便会产生[1]。 目前,已经证明肠道菌群在人体的新陈代谢及免疫功能等方面具有举足轻重的作用, 影响宿主的物质能量代谢及与之相关疾病(例如肥胖、糖尿病脂肪肝等)的发生和发展过程[2]。
乳酸菌能在肠道内定植,维护肠道菌群平衡,并刺激肠黏膜免疫组织, 是对肠道黏膜免疫有重要影响的有益微生物。 鼠李糖乳杆菌LGGs,最初是在上世纪80年代, 由两位美国科学家Gorbach和Goldin 从健康人的肠道中分离而得, 近年来,大量的动物实验和人体临床实验证明LGG 能够耐受动物消化道环境, 并能够在人和动物肠道内定植,起到调节肠道菌群、预防和治疗腹泻、排除毒素、提高机体免疫力和预防龋齿等作用,是重要的益生菌[3]。
本文主要研究了鼠李糖乳杆菌(Lactobacillus rhamnosus)DHC32 对正常小鼠肠道菌群和肠道黏膜免疫的影响,为精确阐明乳酸菌、肠道菌群和宿主黏膜免疫间相互作用及机制积累基础研究。
1 材料与方法
1.1 主要材料与试剂
鼠李糖乳杆菌DHC 32, 山西农业大学食品科学与工程学院生物工程实验室保存;LBS 培养基、BBL 培养基、GAM 培养基、 伊红美蓝培养基,均购自青岛海博生物技术有限公司;LgG 和SIgA测定试剂盒, 购自南京建成生物工程研究所;总RNA 提取试剂盒,购自天根生化科技(北京)有限公司;TaKaRa RR036A 反转录试剂盒、TaKaRa SYBR Premix Ex TaqTM II,购自宝生物工程(大连)有限公司。
1.2 主要仪器与设备
CFX96 荧光定量PCR 仪,美国BioRad 公司;Thermo 酶标仪,芬兰Thermo Electron 公司;电泳成套设备,美国Bio-rad 公司;凝胶成像系统,美国Alpha Innotech 公司;台式高速冷冻离心机,美国Sigam 公司;UItimate 3000 液相色谱仪,德国赛默飞公司。
1.3 试验方法
1.3.1 受试菌液的制备 将试验菌株鼠李糖乳杆菌 DHC 按3%的接种量接于MRS 液体培养基中,37 ℃静置培养24 h,8 000 r/min,离心10 min,弃掉上清液, 加入无菌生理盐水将菌体细胞洗涤2 次,之后调OD 值,使菌液浓度为108CFU/mL 和1010CFU/mL。
1.3.2 动物实验 本试验采用鼠李糖乳杆菌DHC 32 干预健康小鼠, 选用BALB/c 小鼠(SPF级)30 只,随机分成3 组,每组10 只。 每组小鼠均连续灌胃30 d。30 d 后采用颈部脱臼法处死小鼠。
1.3.3 粪便菌群、pH、水分和有机酸测定
1.3.3.1 粪便菌群的测定 无菌收集新鲜粪便测定其活菌数。 乳杆菌采用LBS 培养基,37 ℃好氧,48 h; 双歧杆菌采用BBL 琼脂培养基,37 ℃厌氧,48 h; 拟杆菌采用GAM 培养基,37 ℃厌氧,48 h;肠杆菌采用伊红美蓝琼脂,37 ℃好氧培养48 h 后计数。
1.3.3.2 粪便pH 和水分含量测定 收集大鼠新鲜粪便,测定其pH 和水分含量。 粪便pH 值的测定方法: 取2 g 新鲜粪便溶于20 mL 水中, 用pH计测定其pH 值。 粪便含水量的测定方法:将新鲜粪便置于80 ℃的烘箱中,烘干至恒重。
粪便含水量=(烘干前的粪便总质量-烘干后的粪便总质量)/烘干前的粪便总质量×100%
1.3.3.3 粪便有机酸含量的测定 收集大鼠新鲜粪便,测定其有机酸含量。取0.5 g 新鲜粪便,加入1 mL 蒸馏水混匀用去离子水浸泡3 h→抽滤→12 000 r/min 离心10 min→取上清液于0.22 μm微孔滤膜滤样→进样检测。
色谱条件:液相色谱仪UItimate 3000;色谱柱选择Agilent ZORBAX-C18 4.6 mm×150 mm,5 μm; 流动相为pH=2.7 的20 mmol/L NaH2PO4;进样量20 μL;流动速度0.8 mL/min;紫外检测波长210 nm;柱温30 ℃。
1.3.4 粪便菌群营养代谢率及相关酶活的测定在MRS 培养基(pH 6.2)中加入1%粪便菌悬液和5%的淀粉,混匀后置于37 ℃厌氧培养24 h,按照文献[4]中报道的方法测定粪便菌群代谢淀粉、油脂及蛋白质的能力。
将5 mL 粪便菌悬液超声破碎10 min,随后在10 000 r/min 条件下离心10 min,以去除样品中的不可溶性成分,收集上清液(粗酶液)按照文献[4]中报道的方法进行酶活测定。
1.3.5 小鼠血清LgG 和肠黏膜SIgA 的测定 采用ELSIA 试剂盒对小鼠血清IGG 和肠黏膜SIgA进行测定。
1.3.6 小鼠肠道中细胞因子、 抑菌蛋白及黏蛋白的mRNA 表达 取出肠道组织, 进行Q-PCR 方法分析肠道中细胞因子TNF-α、MyD88、IL-22、IL-23、IL-17A 及肠道内抑菌蛋白Reg IIIγ、黏蛋白MUC1、MUC2 mRNA 水平的变化,引物序列见表1。

表1 实时定量PCR 引物Table 1 Primers used for quantitative real-time PCR
2 结果与讨论
2.1 鼠李糖乳杆菌DHC32 对小鼠粪便氨、 水分含量和pH 值的影响
由图1 可知,与对照组相比,灌胃鼠李糖乳杆菌DHC32 的小鼠粪便中氨含量和pH 值显著降低,水分含量显著升高,且与剂量呈正相关。 鼠李糖乳杆菌DHC32 进入肠道后,定植繁殖,产生短链脂肪酸等酸性物质,降低肠道内的pH 值,可以抑制有害菌的生长,降低粪便中的氨含量。有些腐生菌在结肠中pH 较高的环境下代谢很活跃,可能产生一些致癌物质, 而降低结肠pH 值就有利于抑制这些腐生菌的生长增殖, 能预防、 治疗肠炎、结肠癌等肠道疾病[5]。粪便中水分含量升高,证明了鼠李糖乳杆菌DHC32 的通便作用。

图1 鼠李糖乳杆菌DHC32 对小鼠粪便氨、水分含量和pH 值的影响Fig.1 Effect of Lactobacillus rhamnosus DHC32 on ammonia, moisture and pH value in feces of mice
2.2 鼠李糖乳杆菌DHC32 对小鼠粪便菌群和短链脂肪酸的影响
大量研究表明,益生菌可以调节肠道菌群,稳定肠道微生态,通过粘附、竞争排斥、占位和产生抑制物等作用使一些致病菌(埃希氏菌、空肠弯曲杆菌、肠球菌等)难于接近肠黏膜上的附着位点,随粪便被宿主清除于体外, 从而在肠道中保持着菌群优势,并对肠道局部免疫产生重要的影响[6]。

图2 鼠李糖乳杆菌DHC32 对小鼠粪便菌群数量的影响Fig.2 Effect of Lactobacillus rhamnosus DHC32 on microbial population in feces of mice
由图2 可知,鼠李糖乳杆菌DHC32 对改善小鼠肠道菌群有显著性效果。 与对照组相比, 灌胃DHC32 的小鼠粪便中乳杆菌和双歧杆菌的数量显著升高,拟杆菌和肠杆菌的数量显著降低,且与剂量呈正相关性。 鼠李糖乳杆菌DHC32 进入肠道后,一方面能够快速在肠道内定植,使有益菌增加,有害菌减少;另一方面可能是通过增强机体部分免疫细胞的功能从而促进了双歧杆菌等有益菌的生长。
由图3 可知, 灌胃低剂量和高剂量鼠李糖乳杆菌DHC32 均能显著提高小鼠粪便中乙酸、丙酸、丁酸的含量。短链脂肪酸是由小肠内不被消化吸收的复杂碳水化合物进入大肠后由厌氧微生物发酵而产生的,其中乙酸、丙酸和丁酸所占比例高达85%。 肠道中乳酸菌和双歧杆菌等有益菌的增加,增加肠道内短链脂肪酸的含量,降低结肠及粪便的pH。短链脂肪酸SCFAs 具有调节肠道免疫功能以及降低肠道通透性等重要的生理功能, 并且是肠道上皮细胞以及肝脏能量的重要来源之一[7]。乳酸的产生能促进肠道蠕动, 减少营养物质在小肠内留存的时间,提高营养物质的转运速度。丁酸对很多突变物质具有抑制活性, 是肠道中强的抗癌物质。丁酸是结肠细胞首选的能源物质,并与细胞凋亡和细胞分化的调控有关[8]。

图3 鼠李糖乳杆菌DHC32 对小鼠粪便短链脂肪酸的影响Fig.3 Effect of Lactobacillus rhamnosus DHC32 on short chain fatty acid content in feces of mice
2.3 鼠李糖乳杆菌DHC32 对小鼠粪便菌群营养代谢的影响
研究发现肠道菌群主要通过参与宿主体内糖、蛋白质和脂肪等营养大分子物质的代谢,影响宿主对于营养物质的消化、代谢和吸收,进而调控宿主的营养水平、 健康状况、 免疫和肠脑神经系统。 小鼠粪便菌悬液中的菌群在营养肉汤中的营养代谢能力结果如图4 所示,结果表明,与对照组相比,灌胃鼠李糖乳杆菌DHC32 的小鼠粪便菌群的代谢淀粉、油脂及蛋白质的能力显著提升,但是高、低剂量组之间无显著差异。 肠道菌群最重要的代谢功能就是通过糖酵解途径、 磷酸戊糖途径和糖类厌氧分解途径等进行糖类的代谢。 肠道组织是食物来源氨基酸的主要场所, 这些氨基酸的代谢产物如谷胱甘肽和多胺等生物活性物质, 对维持肠黏膜完整性和肠道功能都具有重要意义[9]。肠道微生物可通过直接作用于肠道中的脂质, 或者间接改变胆固醇或其衍生物如胆盐等过程, 影响脂类的代谢[10]。

图4 鼠李糖乳杆菌DHC 32 对小鼠粪便菌群营养代谢率的影响Fig.4 Effect of Lactobacillus rhamnosus DHC32 on fecal bacterial metabolic capacity of mice
肠道微生物可以通过调节酶的活性和酶量来影响消化道中营养物质的消化、吸收与代谢。为进一步分析鼠李糖乳杆菌DHC32 对小鼠肠道菌群代谢功能的影响, 本文针对肠道菌群中物质代谢相关酶的活性进行了分析,结果如图5 所示。与对照组相比,灌胃鼠李糖乳杆菌DHC32 的小鼠粪便菌群中α-葡萄糖苷酶、酯酶和氨肽酶的活性显著提高,但乳酸脱氢酶的活性变化不明显。以上结果表明鼠李糖乳杆菌DHC32 通过改变肠道菌整体的代谢酶活性,从而改变机体对食物的消化能力,促进肠道细胞对营养物质的吸收。

图5 鼠李糖乳杆菌DHC 32 对小鼠粪便菌群代谢相关酶活性的影响Fig.5 Effect of Lactobacillus rhamnosus DHC32 on activities of metabolism-related enzymes of fecal bacterial in mice
2.4 鼠李糖乳杆菌DHC32 对小鼠血清LgG 和肠黏膜SIgA 的影响
IgG 在血清抗体总量中所占的比例达到75%以上,是血清中主要的抗体,在体液免疫中发挥着主要免疫作用。 肠道黏膜免疫系统的一个重要的功能是分泌SIgA 抗体。SIgA 可以阻止具有潜在威胁的抗原蛋白入侵机体, 同时阻断致病菌对肠道黏膜的进一步伤害。许多研究都证明,益生菌株可以有效地提高SIgA 的分泌量,并且调节由炎症细胞所产生的细胞因子的含量, 进而有效地抑制炎症的发生,同时也降低了机体自发性免疫过剩,即过敏反应的发生[11]。此外,SIgA 还能预防致病菌和非致病菌向肠道外移位, 从而维持肠道内的正常菌群的生长。
如图6 所示,鼠李糖乳杆菌DHC32 可以显著提高小鼠血清LgG 和肠黏膜SIgA 的含量。说明益生乳酸菌鼠李糖乳杆菌DHC32 对宿主的体液免疫和肠黏膜局部免疫具有调节功能。 张和平等[12]研究了L.casei Zhang 对小鼠血清及肠黏膜的影响, 结果表明益生乳酸菌可以显著增加小鼠血清LgG 质量浓度和小鼠肠黏膜SIgA 质量浓度,任贵强等[13]对益生菌MG2-1 调节小鼠机体免疫的研究也得出相似结论。

图6 鼠李糖乳杆菌DHC 32 对小鼠血清LgG 和肠黏膜SIgA 的影响Fig.6 Effect of Lactobacillus rhamnosus DHC32 on serum LgG and intestinal SIgA of mice
2.5 鼠李糖乳杆菌DHC32 对小鼠肠道细胞因子和抗菌蛋白、粘附蛋白基因表达的影响
与对照组相比, 灌胃鼠李糖乳杆菌DHC 32小鼠肠道中My D88、IL-23 及IL-22 的量显著增多。有研究证实,天然免疫中起重要作用的髓样分化因子My D88 以及细胞因子IL-23 及IL-22,有研究表明,IL-23/IL-22 适度表达对维持肠道免疫功能及损伤修复起着重要作用, 但过度表达则能够破坏肠道免疫功能继而加剧肠道炎症反应[14]。图7 结果显示,干预组小鼠肠道中的促炎因子IL-17A 及TNF-α 表达水平与对照组无显著差异,说明适量的乳酸菌的定植并未诱导机体产生炎症反应。但是有报道称乳酸菌的某些菌株:鼠李糖乳杆菌(ATCC. 53103)、植物乳杆菌(VTT)、乳酸球菌(ARH74), 双歧杆菌动物亚种是肿瘤坏死因子(TNF-α)的强有力的诱导剂,以增强免疫。 本文推理在正常肠道环境下鼠李糖乳杆菌 DHC 32 可能通过适当刺激肠道上皮先天免疫反应增强机体免疫机能, 而非直接抑制炎症产生以维护肠道健康。
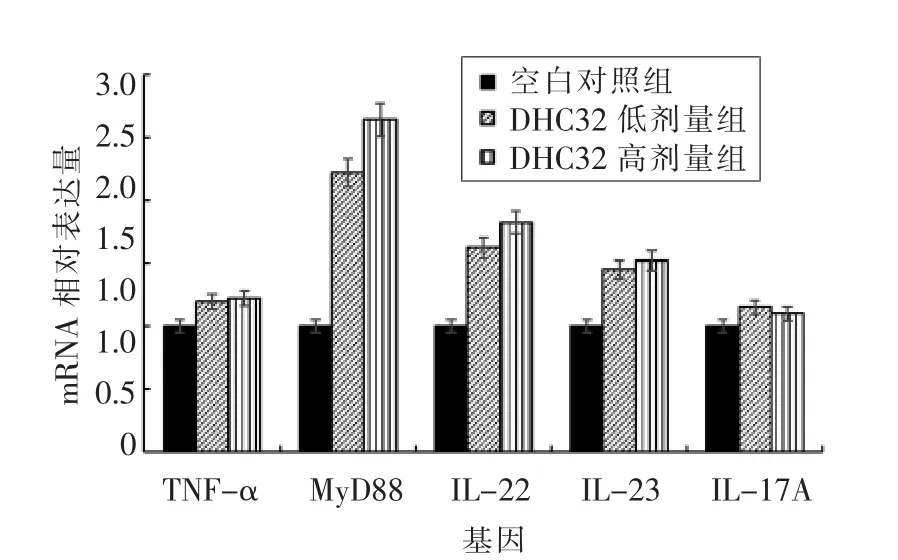
图7 鼠李糖乳杆菌DHC 32 对小鼠肠道免疫相关细胞因子表达的影响Fig.7 Effect of Lactobacillus rhamnosus DHC32 on gene expression of intestinal immunoregulatory cytokines of mice
肠道上皮是机体内最大的黏膜屏障, 其产生的抑菌因子胰岛再生源蛋白Reg IIIγ 是肠道先天黏膜免疫中重要成分[15]。 图8 结果显示,鼠李糖乳杆菌DHC 32 定植肠道后, 显著促进了Reg IIIγ的表达。 Reg IIIγ 为一种可以直接杀菌的C 型凝集素,研究发现[16]My D88 及IL-23/IL-22 等因子的产生对Reg IIIγ 的表达起促进作用。 健康肠道内Reg IIIγ 具有较强的杀菌能力, 在防止共生菌和致病菌穿透肠道屏障及炎症性肠病(Inflammatory Bowel Disease,IBD)发病机制中发挥重要作用。 鼠李糖乳杆菌DHC 32 可通过与肠道上皮相互作用调控抑菌蛋白Reg IIIγ 的表达, 进而稳定肠道内环境及加强免疫防御,从而促进肠道健康,但是具体分子机制尚不清楚。
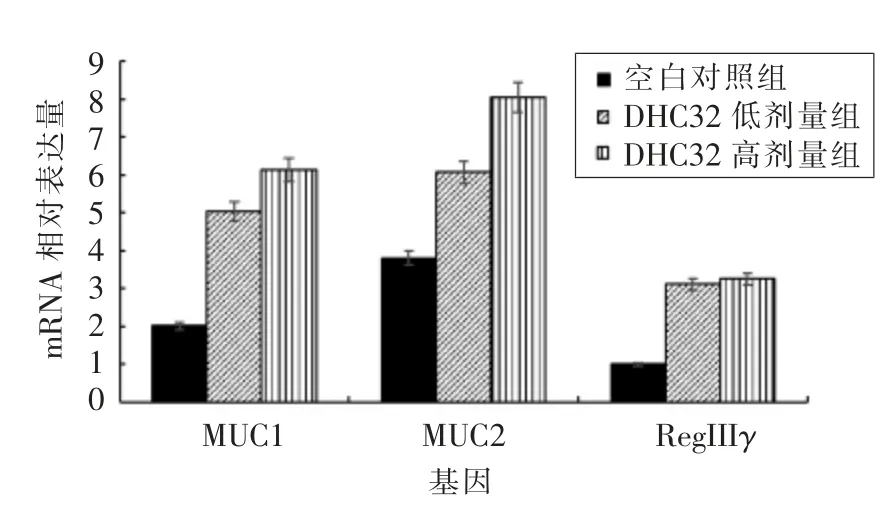
图8 鼠李糖乳杆菌DHC 32 对小鼠肠道MUC1、MUC2 及RegIIIγ 表达的影响Fig.8 Effect of Lactobacillus rhamnosus DHC32 on gene expression of intestinal MUC1,MUC2 and RegIIIγ of mice
益生乳酸菌除了通过产生一些代谢产物、竞争性占位等机制抑制肠道中多种病原菌的增殖降低肠道感染率外,还通过粘附定植到肠道,增加其与肠上皮细胞间的相互作用, 促进杯状细胞分泌黏蛋白,加速黏蛋白周转率,稳固黏膜屏障功能,增强宿主的免疫机能而改善动物的肠道健康。 黏蛋白是黏液层的主要组分, 其中MUC1 和MUC2是肠道组织中两种最主要的黏蛋白。 MUC1 是膜结合型,主要参与肠道先天性免疫,通过与致病菌表面成分特异性结合有效阻止其入侵机体;MUC2是分泌型黏蛋白, 通过参与形成黏稠的凝胶型网状结构进而形成物理性屏障,抵御致病菌入侵[17]。本文研究了鼠李糖乳杆菌DHC 32 对小鼠肠道MUC1、MUC2 基因表达的影响,结果显示,鼠李糖乳杆菌DHC 32 干预组小鼠肠道中MUC1、MUC2基因表达量显著提高,且与剂量呈正相关性。研究认为, 细菌表面的脂多糖及代谢产物能够改变黏蛋白的合成和分泌[18]。 乳酸菌对其影响主要分两个方面:1)通过改变肠道部分微生物数量影响黏蛋白表达[19];2)通过粘附素粘附于肠黏蛋白,直接提高黏蛋白mRNA 表达水平[20]。Smirnov A 等[18]和Cui H 等[21]研究发现,乳酸菌制剂能够显著提高肉仔鸡空肠黏蛋白mRNA 表达水平及黏蛋白数量,证实其能够改变黏蛋白分泌动力学特性。 Li 等[22]分离出高粘附鸡源发酵乳杆菌, 且在体内试验发现该菌株能够显著增加空肠杯状细胞密度和空肠、回肠MUC2 的mRNA 水平。
