三种酵素的抗氧化活性与微生物多样性的相关性研究
2020-07-08李佳慧
姚 笛,徐 磊,李佳慧
黑龙江八一农垦大学食品学院,大庆 163319
酵素是以动植物等为原料,经微生物发酵制得的具有特定生物活性的产品[1]。酵素含有大量的微生物代谢产物,其中酶、氨基酸等营养成分含量丰富,因此,酵素具有延缓衰老、抑菌及提高机体免疫力等功能[2,3]。酵素在发酵过程中的抗氧化活性研究是近年来关注的焦点,Chen[4]和Dong[5]等对火龙果酵素发酵过程中的抗氧化活性与功能变化规律进行了研究;Guan等[6]研究了蓝莓酵素发酵过程中抗氧化性能的变化;Wang等[7]对桑葚酵素的多酚和原花青素等生物活性成分的含量进行测定,并分析了DPPH自由基清除作用、ABTS自由基清除作用和SOD活性等指标。多项研究结果表明不同酵素的抗氧化活性存在差别,这可能与不同酵素中的微生物群落构成和丰度有关,但是,迄今关于酵素的微生物菌群多样性和抗氧化活性的相关性研究未见报道[8]。
发酵食品的微生物多样性研究方法主要有传统培养法、底物利用分析法和分子生物学等方法[9]。目前,对于酵素样品的微生物多样性研究十分贫乏,Jiao等[10]运用PCR-DGGE技术分析了木瓜酵素自然发酵过程中的微生物多样性。然而,随着高通量测序技术的飞速发展[11],第二代测序技术已经能够将稳定可逆的终止法边合成边测序反应应用在样品中[12]。因此,利用高通量测序技术对不同酵素的微生物多样性进行分析切实可行。
研究酵素的抗氧化活性与微生物多样性的相关性对于酵素发酵菌种的选择至关重要。发酵菌种很大程度上决定着酵素的生理活性和安全性,并能缩短发酵时间[13],同时也直接影响产品的生产工艺和品质[14],而结合微生物多样性和抗氧化活性,从酵素中筛选有益菌种的研究未见报道,因此,本研究以火龙果酵素、蓝莓酵素、桑葚酵素为样品,测定其pH值和总酚含量,以DPPH自由基、羟自由基清除能力为指标分析其抗氧化活性,同时,利用高通量测序技术对其中的16S rDNA基因V3-V4区和ITS基因1-2区进行扩增测序,分析样品中细菌和真菌的群落结构组成[15],结合pH值、总酚含量、羟自由基和DPPH清除能力,探讨微生物多样性与抗氧化活性的相关性,从而为酵素功能特性的阐释和优质酵素的开发奠定基础。
1 材料与方法
1.1 材料与主要试剂
新鲜的火龙果、桑葚、蓝莓、柠檬等均购自大型超市。
DPPH购自北京索莱宝科技有限公司;羟自由基测定试剂盒购自南京建成科技有限公司;E.Z.N.ATM Mag-Bind Soil DNA Kit购自Omega公司;Qubit3.0 DNA检测试剂盒购自Life公司;2×Taq Master Mix购自Vazyme公司;Magic Pure Size Selection DNA Beads为Transgen公司产品;碳酸钠等试剂均为国产分析纯;酵素发酵桶为特百惠(Tupperware Brands Corporation)公司产品。
1.2 仪器与设备
Q32866型Qubit®ubi荧光计,Invitrogen公司;T100TMThermal Cyeler型PCR仪,BIO-RAD公司;DELTA320型精密pH计,梅特勒-托利多仪器(上海)有限公司;A360型紫外可见分光光度计,翰艺仪器(上海)有限公司。
1.3 方法
1.3.1 酵素的制作
将火龙果去皮切块,按照火龙果∶蔗糖∶柠檬汁=5∶5∶1的比例放入酵素发酵桶中,混合均匀,发酵三个月;将桑葚、蓝莓洗净,自然晾干,按水果∶蔗糖∶柠檬汁=5∶5∶1的比例放入酵素发酵桶中,混合均匀,25 ℃发酵三个月。
1.3.2 pH值的测定
利用pH计校准后测定三种酵素的pH值。
1.3.3 总酚含量测定
在100 μL样品中加入45.9 mL去离子水,然后与1 mL Folin-Ciocalteau试剂混合,反应3 min,再向其中加入3 mL 20%的Na2CO3溶液,25 ℃恒温水浴振荡2 h,然后测定760 nm下的吸光度,总酚含量是借助没食子酸等价物来表示,根据标准曲线的方程y=0.091 7x+0.020 8,R2=0.999 6计算总酚含量(y表示吸光度,x表示样品浓度)。
1.3.4 羟自由基清除能力测定
将三种酵素样品分别混匀,取1 mL样品进行羟自由基清除能力的测定,按照试剂盒操作说明进行,羟自由基清除率按照如下公式进行计算:

1.3.5 DPPH自由基的清除能力测定
将4 mL DPPH(0.025 g/L)溶液中加入1 mL样品中,室温下避光30 min,然后测定其在517 nm下的吸光度值,DPPH自由基的清除能力按照如下公式进行计算。

1.3.6 微生物多样性的测定
1.3.6.1 样品处理
将三种酵素样品分别混匀,取4 mL样品分多次加入2 mL灭菌离心管中,10 000 rpm室温下离心3 min,弃上清液,再将离心管倒置在吸水纸上,保持1 min,至没有液体流出,取离心管内沉淀备用。
1.3.6.2 DNA提取
利用E.Z.N.ATM Mag-Bind Soil DNA Kit对样品中的DNA进行提取,具体方法参照试剂盒说明书进行。利用琼脂糖凝胶电泳检测DNA的完整性,Qubit 3.0 DNA检测试剂盒测定DNA浓度。
1.3.6.3 PCR扩增和纯化
以检测合格的DNA样品为模板,以341F(CCCTACACGACGCTCTTCCGATCTG)和805R(GA CTGGAGTTCCTTGGCACCCGAGAATTCCA)为引物,对细菌16s rDNA的V3-V4区进行扩增;同时以ITS1F(CCCTACACGACGCTCTTCCGATCTN)和ITS2R(GTGACTGGAGTTCCTTGGCACCCGAGAATTCCA)为引物,对真菌ITS区进行PCR扩增。扩增产物利用Magic Pure Size Selection DNA Beads进行纯化,具体操作按照说明书进行。
1.3.6.4 测序
利用Qubit 3.0 DNA检测试剂盒对回收的PCR产物进行精确定量,按照每个样品的测序量要求进行混合,将接头序列添加至目标区域外端后,氢氧化钠变性产生单链DNA片段,利用Illumina HISeq平台进行测序。
1.3.7 序列及相关性分析
测序获得的原始数据利用QIIME进行质控过滤及OTU聚类,然后与RDP等数据库进行比对,对各个样品的OTU在门和属水平等级上的群落组成进行注释和α-多样性分析。微生物多样性与抗氧化活性等环境因子的CCA分析采用Canoco 4.5进行。
2 结果与分析
2.1 三种酵素的pH值和总酚含量
三种酵素发酵前后的pH值和总酚含量如表1所示,由表可知,三种酵素发酵后的pH值均降低,其中,蓝莓酵素(T3)的pH值最低,酵素的pH较低是由于发酵过程中微生物利用糖产生了大量的有机酸;酵素的总酚含量比发酵前明显升高,其中,蓝莓酵素的总酚含量最高,火龙果酵素(T1)最低,桑葚酵素(T2)的两项指标居于中等水平。

表1 酵素的pH值和总酚含量
注:T1:火龙果酵素;T2:桑葚酵素;T3:蓝莓酵素。上角标字母相同表示差异不显著,P>0.05;上角标字母不相同表示差异显著,P<0.05。
Note:T1:Pitaya Jiaosu;T2:Mulberry Jiaosu;T3:Blueberry Jiaosu.Same superscript letters indicate no significant difference,P> 0.05;Different superscript letters indicate significant difference,P<0.05.
2.2 三种酵素的抗氧化活性
三种酵素发酵前后的DPPH自由基和羟自由基清除能力如表2所示,由表可知,发酵后蓝莓酵素的DPPH自由基和羟自由基清除能力最高,说明其抗氧化活性较好,火龙果酵素的抗氧化活性较低,桑葚酵素的抗氧化活性居于中等水平。比较发酵前后三种酵素的自由基清除能力可知,经微生物作用后酵素的抗氧化活性明显增强。

表2 酵素的抗氧化活性
注:T1:火龙果酵素;T2:桑葚酵素;T3:蓝莓酵素。上角标字母相同表示差异不显著,P>0.05;上角标字母不相同表示差异显著,P<0.05。
Note:T1:Pitaya Jiaosu;T2:Mulberry Jiaosu;T3:Blueberry Jiaosu.Same superscript letters indicate no significant difference,P> 0.05;Different superscript letters indicate significant difference,P<0.05.
2.3 三种酵素中细菌和真菌的α-多样性分析
对样品进行α-多样性分析,可反映出微生物群落的多样性与丰度。三种酵素样品中细菌和真菌的α-多样性分析结果如图1、2、3和表3所示。根据Shannon、Ace和Chao指数分析可知,随着测序量的增加,细菌和真菌的稀释曲线均趋向平坦,说明实验测序量合理,可涵盖酵素样品中的物种总数,反映样品内细菌、真菌等微生物信息全貌,其中蓝莓酵素的细菌测序量少于其他两种酵素,而真菌的测序量高于其他两种酵素,这与样品中的物种构成和丰度相关。由表3可知,三种酵素的覆盖率均大于98%,覆盖率表示检测样品文库覆盖率(Max=1),数值越大表示更真实的反映样品情况。三种酵素的细菌Shannon指数均大于真菌的Shannon指数,说明三种酵素的细菌多样性高于真菌多样性,其中蓝莓酵素细菌和真菌的Shannon指数最高,分别为4.03和2.37,说明蓝莓酵素的微生物多样性高于其他两种酵素。根据Chao指数可确定酵素样品的物种丰度,细菌中蓝莓酵素的Chao指数最高,为9 721.56,说明蓝莓酵素的细菌丰度高于其他两种酵素,真菌中火龙果酵素的Chao指数最高,为7 883.88,说明火龙果酵素的真菌丰度高于其他两种酵素。Ace指数与Chao指数的算法不同,也能反映OTU的数目和物种丰度。综上所述,三种酵素样品原料的差异性可诱导微生物群落多样性的不同。

图1 酵素中细菌(A)与真菌(B)的Shannon指数

图2 酵素中细菌(A)与真菌(B)的Ace指数

图3 酵素中细菌(A)与真菌(B)Chao指数

表3 酵素中细菌和真菌的α-多样性指标统计
2.4 OTU分布韦恩图分析
韦恩图用于表示多个样本共有和特有 OTU的情况[16]。如图4所示,三种酵素样品的细菌OTU总数为2 122,对3种酵素含有的细菌和真菌分别进行基于OTU的韦恩分析,发现T1(火龙果酵素)有757个细菌OTU,T2(桑葚酵素)有705个细菌OTU,T3(蓝莓酵素)有965个细菌OTU,其中T1、T2共有117个细菌OTU,T2、T3共有127个细菌OTU,T1、T3共有149个细菌OTU,T1、T2、T3具有88个共有细菌OTU。T3(蓝莓酵素)的特有细菌OTU数目最多。三种酵素样品的真菌OTU 总数为2592,T1有1140个真菌OTU,T2有669个真菌OTU,T3有1012个真菌OTU,其中T1、T2具有116个共有真菌OTU,T2、T3具有70个共有真菌OTU,T1、T3共有78个真菌OTU,T1、T2、T3共有36个真菌OTU。T1(火龙果酵素)的特有真菌OTU数目最多。

图4 酵素样品中细菌(A)及真菌(B)的OTU分布韦恩图
2.5 群落结构组分分析
基于各样本物种丰度通过Bray-Curtis算法构建样本聚类树[17],与物种丰度柱状图结合能直观的看出样本间的关系及物种构成。由图5可知,在细菌的门水平群落结构组分中共分析了29个细菌门,三种酵素的细菌门水平的群落构成相似,其中变形菌门(Proteobacteria)丰度最高,其次是厚壁菌门(Firmicutes),第三是放线菌门(Actinobacteria);在细菌属水平群落结构组分中共分析了50个细菌属,其中火龙果酵素与蓝莓酵素的细菌属水平的群落构成相似,桑葚酵素的菌属丰度与其他两种酵素有一定差别,总的来说,高丰度的细菌是中慢生根瘤菌属(Mesorhizobium)和盐单胞菌属(Halomonas)。由图6可知,在真菌门水平群落结构组分分布中共分析了11个真菌门,三种酵素的真菌门水平的群落构成相似,优势真菌均为子囊菌门(Ascomycota),其中蓝莓酵素的未分类菌门(unclassified)也占有一定比例;在真菌属水平群落结构组分分布中共分析了50个真菌属,其中火龙果酵素和桑葚酵素的优势真菌为奥默柯达酵母属(Kodamaea),蓝莓酵素的优势真菌为帚枝霉属(Sarocladium)和汉逊酵母属(Hanseniaspora)。

图5 不同酵素样本间细菌门水平(A)和属水平(B)的相对丰度

图6 不同酵素样本间真菌门水平(A)和属水平(B)的相对丰度
2.6 物种丰度的聚类分析
Heatmap的颜色变化可反映群落分布的丰度信息。将门、属水平上的分类信息进行组间丰度相似性聚类,通过颜色梯度及相似程度来反映样品在各分类水平上群落组成的相似性和差异性[18]。
由菌群组成的热图(图7、8)可知,红色代表丰度高,蓝色代表丰度低,在细菌群落构成中火龙果酵素和蓝莓酵素归属同一分支,桑葚酵素与其他两种酵素差距较大,如酸杆菌门(Acidobacteria)、梭杆菌门(Fusobacteria)、苯基杆菌属(Phenylobacterium)、弧菌属(Vibrio)在火龙果和蓝莓酵素中丰度较低,但在桑葚酵素中丰度较高。
火龙果酵素和桑葚酵素的真菌群落构成差异较小,归属同一分支,蓝莓酵素与另外两种酵素差异较大,如类原生动物门(Rozellomycota)、梅奇酵母属(Metschnikowia)、接合酵母属(Zygosaccharomyces)、毕赤酵母属(Pichia)在火龙果酵素和桑葚酵素中丰度较低,在蓝莓酵素中丰度较高。
2.7 酵素的抗氧化活性与部分微生物群落丰度之间的相关性分析
酵素的抗氧化活性与微生物群落丰度的相关性分析如图9和10所示,由图可知,酵素的pH值、总酚含量、羟自由基清除能力、DPPH自由基清除能力与其微生物群落构成有一定的相关性。与pH值呈正比的细菌有假单胞菌属(Pseudomonas)、魏斯氏菌属(Weissella)、紫杆菌属(Porphyrobacter)、中慢生根瘤菌属(Mesorhizobium);真菌有奥默柯达酵母属(Kodamaea)、汉逊酵母属(Hanseniaspora)、假丝酵母属(Candida)、酵母属(Saccharomyces)、短梗霉属(Aureobasidium)、棒孢酵母属(Clavispora)。与总酚含量呈正比的细菌有伯克氏菌属(Limnobacter)、梭状芽孢杆菌属(Clostridium)、链球菌属(Streptococcus)、盐单胞菌属(Halomonas)、短单胞菌属(Brevundimonas);真菌有帚枝霉属(Sarocladium)、梅奇酵母属(Metschnikowia)、镰刀菌属(Fusarium)、接合酵母属(Zygosaccharomyces)。与羟自由基清除能力呈正比的细菌有假单胞菌属(Pseudomonas)、魏斯氏菌属(Weissella)、短单胞菌属(Brevundimonas)、梭状芽孢杆菌属(Clostridium)、伯克氏菌属(Limnobacter)、链球菌属(Streptococcus);真菌有假丝酵母属(Candida)、酵母属(Saccharomyces)、短梗霉属(Aureobasidium)、梅奇酵母属(Metschnikowia)、棒孢酵母(Clavispora)、接合酵母属(Zygosaccharomyces)。与DPPH自由基的清除能力呈正比的细菌有中慢生根瘤菌属(Mesorhizobium)、短单胞菌属(Brevundimonas)、甲基杆菌属(Methylobacterium);真菌有奥默柯达酵母属(Kodamaea)、汉逊酵母属(Hanseniaspora)、未分类酵母属。
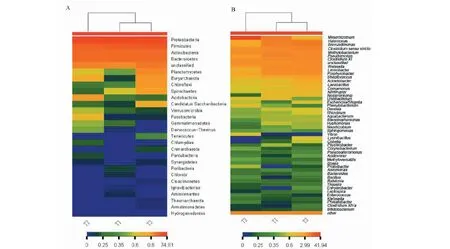
图7 不同酵素样本间具有丰度差异的细菌门(A)和属(B)水平热图
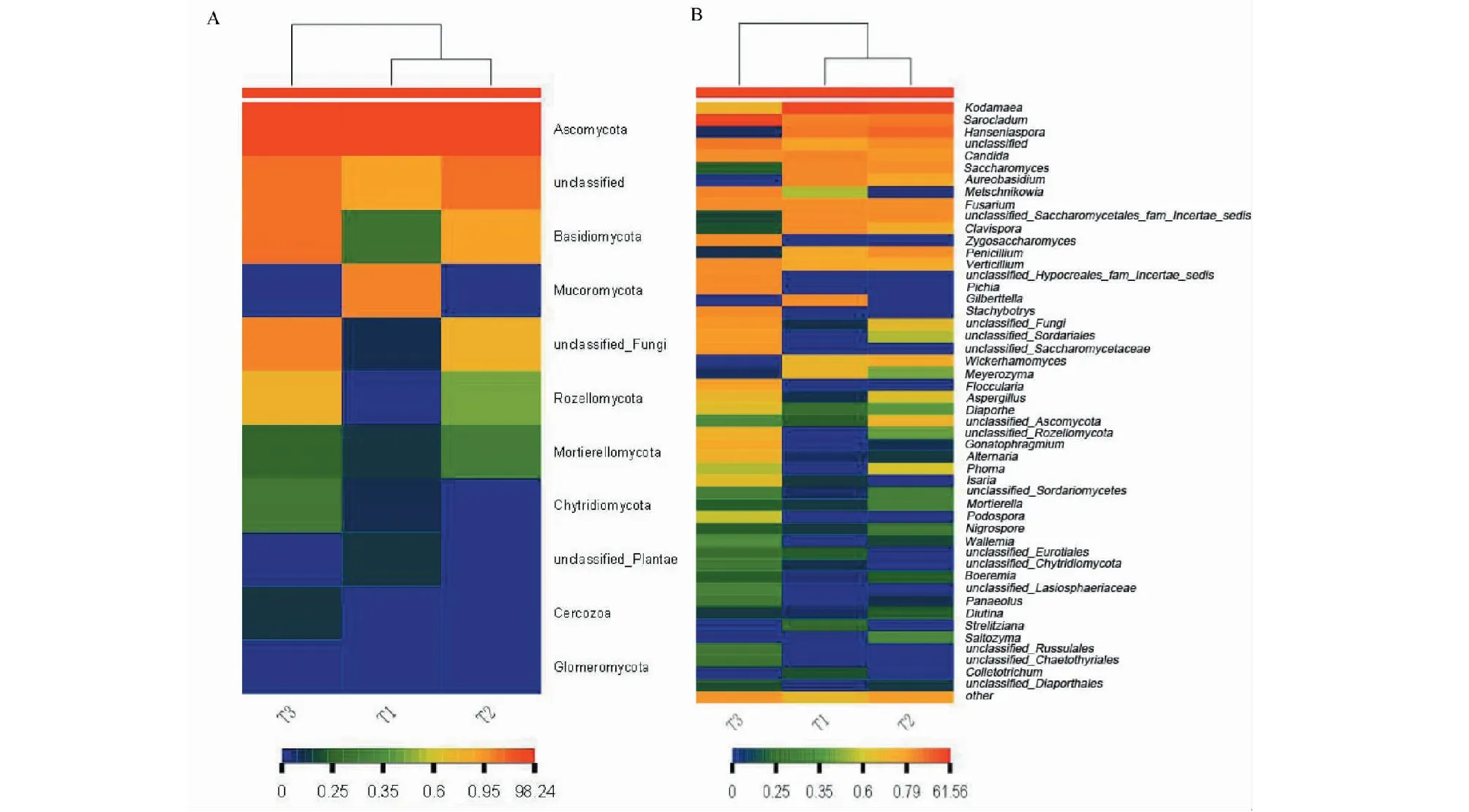
图8 不同酵素样本间具有丰度差异的真菌门(A)和属(B)水平热图

图9 酵素的细菌属水平群落与抗氧化活性的关系

图10 酵素的真菌属水平群落与抗氧化活性的关系
3 讨论
本文结合不同酵素的抗氧化活性与微生物群落组成的差别,探讨两者之间的相关性。酵素具有一定的抗氧化活性,但不同原料来源的酵素的抗氧化活性存在差异。羟自由基是一种活性氧,在体内可与金属离子作用,形成高氧化态,清除体内羟自由基可有效控制高氧化状态,而DPPH自由基相较于超氧自由基等更加稳定,能更好的评价抗氧化活性。本文结合不同酵素的总酚含量及DPPH、羟自由基清除率评价其抗氧化性。三种酵素中,蓝莓酵素的自由基清除能力最强,并与总酚含量成正相关,这与蒋增良等研究蓝莓酵素的抗氧化性与多酚含量呈正相关性的结果吻合[19]。酵素中自由基清除率的上升可能是由于多酚含量的增加和多糖的共同作用[20],还有研究表明,多酚分子中活性酚羟基具有较强的还原力,即具有较强的抗氧化活性[19]。
本文利用高通量测序技术探讨不同酵素的微生物多样性,从结果可以看出,不同酵素在门水平上差异不大,其中变形菌门和厚壁菌门是细菌的优势菌门,子囊菌门为真菌的优势菌门;不同酵素在属水平上差异较大,其中火龙果酵素和蓝莓酵素在细菌属水平上较为相近,火龙果酵素和桑葚酵素在真菌属水平上较为相近,例如中慢生根瘤菌属为优势细菌属,优势真菌为奥默柯达酵母属和汉逊酵母属。这表明果蔬的营养成分不同,最终使不同酵素在细菌和真菌的构成上存在差异。
虽然不同酵素的抗氧化活性研究已有较多报道,但对于不同酵素的微生物多样性与抗氧化活性之间的相关性分析未见报道。本研究表明,三种酵素的抗氧化活性与细菌的相关性较小,DPPH、羟自由基的清除率与两个细菌菌属(中慢生根瘤菌属、甲基杆菌属)等呈现正相关;与真菌的相关性较大,如奥默柯达酵母属、汉逊酵母属等多个真菌菌属与抗氧化指标呈现正相关。
4 结论
三种酵素中蓝莓酵素的总酚含量和抗氧化活性最高,pH值最低。三种酵素共获得2 122个细菌OTU和2 592个真菌OTU,α-多样性分析发现样品中的细菌群落多样性均高于真菌群落多样性,三种酵素的细菌群落丰富度高于真菌群落丰富度。三种酵素的优势菌门为变形菌门(Proteobacteria)和子囊菌门(Ascomycota),其中慢生根瘤菌属(Mesorhizobium)和汉逊酵母属(Hanseniaspora)等菌属的丰度较高且差异较大。微生物群落构成与pH值、总酚含量、羟自由基清除能力、DPPH自由基清除能力具有一定的相关性。不同微生物与抗氧化活性的相关性分析结果可为微生物酵素产品的研发优化提供有用参考。
