卵巢癌化疗相关的耐药标志物分析
2020-07-08谢美强巫源博湛江中心人民医院湛江524000
谢美强 张 丹 颜 劲 巫源博(湛江中心人民医院 湛江 524000)
卵巢癌是严重影响女性健康的生殖系统恶性肿瘤,研究表明发病率仅次于乳腺癌和宫颈癌[1]。子宫颈的解剖学位置在盆腔深部,早期不易发现,大多数确诊时已经处于癌症晚期,病死率较高。传统的癌症治疗方案主要是杀伤肿瘤细胞,同时也会严重影响正常细胞的活性。紫杉醇类联合铂类药物的化疗方案开始应用于肿瘤治疗,但是只能起到短期的治疗效果,5年生存率未明显提升[2,3]。患者长期进行化疗会产生化疗耐药性,严重影响治疗效果和预后。化疗耐药机制十分复杂,受到多组基因在不同时间和空间的调控。本研究通过检测肿瘤相关蛋白P53、凋亡抑制蛋白livin、谷胱甘肽S转移酶-π以及II型DNA拓扑异构酶等化疗耐药相关蛋白在卵巢癌上皮组织中的表达情况,分析上述蛋白对卵巢癌的治疗以及预后的影响。
1 对象和方法
1.1 研究对象:选取2012年1月—2014年1月在我院接受手术治疗以及病理学检查确诊的80例卵巢癌患者,取肿瘤组织上皮制成标本,取材后经甲醛浸泡,石蜡包埋,切片备用。纳入标准:经过病理学检测,确诊为卵巢癌;临床资料以及术后随访信息完整;术前没有接受放化疗以及免疫疗法。排除标准:出现其他肿瘤;依从性差。年龄25~75岁,平均年龄(56.21±6.54)岁。根据《2016年卵巢癌临床实践指南》[4]分为:I~II20 例,III~IV60 例。初次诊断症状为腹胀、食欲不振、阴道内出血。在我院进行肿瘤分期手术,术后进行铂类药物化疗。术后随访5年,其中50例停止化疗后半年复发或者随访期内一直未见复发作为化疗敏感组,30例停止化疗半年复发作为化疗耐药组。两组一般资料进行统计学分析无显著差异(P>0.05)。本研究经过我院伦理委员会审批,签署知情协议。
1.2 检测方法:采用免疫组化的方法[5]分析化疗耐药相关蛋白P53、livin、GST-π 以及 Topo II表达情况。
1.3 统计学方法:采用SPSS17.0软件进行数据分析,计量资料以均数±标准差(±s)表示,采用t检验;计数资料以频率和百分率表示,采用χ2和Fisher确切概率法检验。利用Cox回归模型进行多因素分析,P<0.05表示差异显著。
2 结果
2.1 耐药相关基因的表达:化疗敏感组P53、linvin、GST-π的阳性表达率和化疗耐药组相比显著降低,P<0.01,但是TopoII的阳性表达情况显著高于化疗耐药组,P<0.05。见表1。
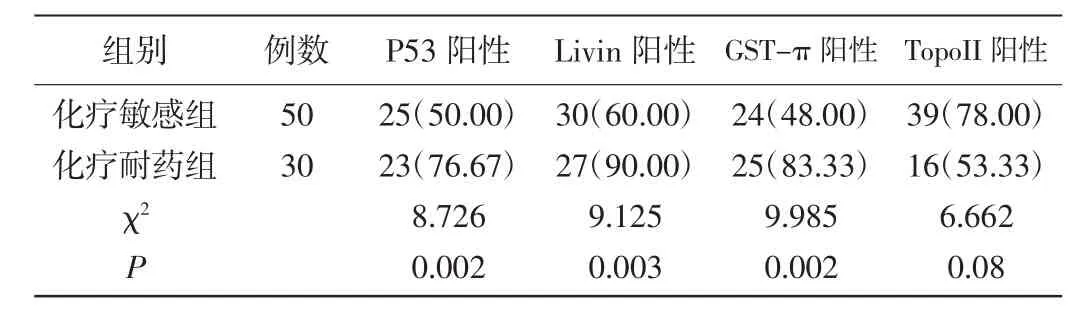
表1 两组表达率化疗耐药相关抗性蛋白的阳性统计比较[n(%)]
2.2 两组5年生存率分析:采用Log-rank检验方法比较两组5年生存率(56.3%)和化疗耐药组5年生存率(13.6%),具有显著差异,P<0.01。见图 1。
2.3 生存时间的影响因素:将年龄、临床分期、组织分化和化疗程度敏感性作为自变量纳入Cox回归模型分析,将是否死亡作为因变量,分析本研究的耐药因素对生存时间的影响,结果显示临床分期和化疗敏感度是生存时间的影响因素(P<0.05)。见表2。

表2 纳入生存时间影响因素分析
3 讨论
发生、发展和转移是肿瘤发展的基本过程,该过程是肿瘤和正常组织相互作用的结果,并且受到许多因素的调控。当前,卵巢癌的主要治疗方法是全面分期手术以及降低肿瘤细胞,然后辅助以标准化疗,合理的手术加上合理的治疗可以达到良好的短期治疗效果[6]。铂类药物能够在卵巢癌术后早期起到良好的抑制癌细胞增殖和迁移的作用,但是多数患者因为癌细胞的再次迁徙造成长期生存率较低[7]。化疗耐药性对长期生存率起到了重要作用,所以长期以来关于耐药靶点的筛选和机制研究成为关注的热点,该类研究对化疗效果的检测以及靶向治疗和制定个性化治疗方案具有重要的参考,从而增加长期生存率。
化疗药物对肿瘤细胞的杀伤作用机制主要是诱导凋亡,而且这一过程是受到多个基因共同调控,这些基因的异常表达会使患者产生化疗耐药性[8]。P53基因是一种细胞凋亡相关基因,还参与癌症的防控以及修复细胞基因缺陷,在多数的恶性肿瘤中P53会发生突变,进一步诱发癌症。Livin属于凋亡抑制蛋白家族,可以抑制细胞凋亡,参与调节细胞周期和细胞分裂[9]。本研究发现P53和livin阳性表达的患者化疗效果要比阴性表达的显著降低,5年生存率明显降低,主要原因可能是卵巢癌患者中表达的P53,多为突变型,其表达产物会干扰细胞周期的调控,化疗药物失去诱导肿瘤细胞凋亡的能力。Livin基因在晚期临床分期或者是终末期较为常见,研究表明该基因在卵巢癌细胞的增殖、分化以及迁移过程中起到了重要的调控作用。另外,GST-π和TopoII等长期刺激肿瘤细胞会使其产生耐药性。前者是一种药物代谢酶,可以参与细胞内有毒物质的降解。临床治疗中,设计的抗癌药物无法直接和癌细胞结合,GST-π可以催化药物和谷胱甘肽的结合杀灭癌细胞。TopoII存在于细胞核,功能是可以催化调整DNA结构,实现DNA不同拓扑异构体的转变,调控基因的重组、转录以及DNA修复[10],其活性的降低可以引起肿瘤细胞对TopoII抑制剂产生耐药性。本研究发现GST-π阳性表达患者的疗效较阴性显著降低,5年生存率较低。其原因可能是癌细胞中的GST-π高表达,抗癌药物无法和谷胱甘肽结合进入细胞,从而抑制了对肿瘤细胞的杀伤作用。总的来说,P53、livin、GST-π以及Topo II可以作为卵巢癌化疗效果以及预后效果评估的因子。
