低氧联合酸胁迫富集大麦芽中γ-氨基丁酸工艺优化
2020-07-07周新勇陆燕婷尹永祺王友根杨正飞方维明
周新勇 陆燕婷 尹永祺 王友根 杨正飞 方维明
(扬州大学食品科学与工程学院1,扬州 225127)
(江苏迈康尔麦业有限公司2,盐城 224200)
大麦在世界种植广泛,是全球第五大农作物,其营养含量丰富,富含膳食纤维,是良好的维生素和微量元素来源[1,2]。大麦经发芽处理后,其内源酶系被激活,生理代谢反应活跃,三羧酸循环及其各支路反应活跃,γ-氨基丁酸(GABA)含量显著提高,因此可用大麦芽开发富含GABA的功能食品[3,4]。
禾本科类植物中GABA主要通过GABA支路合成,即谷氨酸在谷氨酸脱羧酶(GAD,EC 4.1.1.15)的催化下得到GABA[5],其后GABA会在GABA转氨酶的催化作用下转氨,形成琥珀酸半醛,琥珀酸半醛脱氢则会生成琥珀酸,进入三羧酸循环[6-8]。
研究发现,高等植物受到外界刺激,植物体内会产生大量的GABA来应对外界逆环境的胁迫[9]。低氧胁迫是设施栽培环境中常见的一种非生物胁迫,是胁迫富集GABA最快速有效的方式之一,具有操作简单,成本低等优势。在低氧条件下,GABA是一种能够调节细胞质pH来抵抗氧化性损伤的信号分子[10]。植物籽粒的氧化磷酸化作用减弱,大量的琥珀酸半醛无法转化成琥珀酸而蓄积,抑制,GABA转化为琥珀酸半醛的反应。采用酸性刺激也能有效积累植物体内GABA含量并增强抗感染能力,低pH值环境能够提高GAD的活性,降低GABA转氨酶的活性,在提高GABA的产量的同时减少其消耗,从而提高GABA含量[11,12]。
本实验首先对浸麦阶段的低氧胁迫通氧量和浸麦时间进行优化,在明确浸麦工艺的前提下,研究低氧胁迫方式、低氧胁迫通氧量、发芽缓冲液pH值和发芽时间对GABA含量的影响,并通过响应面法对其发芽条件进行优化,以期获得大麦芽富集GABA的最佳工艺条件,为保健型大麦芽制品的开发提供技术支撑。
1 材料与方法
1.1 材料与试剂
澳洲大麦Scope1,封装于密闭容器中,4 ℃保存备用;对二甲氨基苯磺酰氯、GABA标准品、乙腈(色谱纯);其余试剂均为国产分析纯。
1.2 仪器与设备
PJX-250D光照发芽箱;HC-2066高速离心机;Agilent 1260液相色谱仪;DK-S12型电热恒温水浴锅;KQ-250DB数控超声波清洗器;K20干式恒温器;BX-802发芽机。
1.3 实验方法
1.3.1 浸麦条件优化
取150 g 大麦种子,用1%次氯酸钠溶液浸泡消毒10 min,消毒后用蒸馏水冲洗至pH中性。控制通氧量为3 L/min,6 L/min,6 L/min,分别取浸麦0、12、24、36 、48 h的样品2.0 g,测定其含水量、露点率和GABA含量。
1.3.2 发芽条件优化
低氧发芽方式:称量150 g种子,固定温度为20 ℃,全程避光处理,分别采取全程低氧发芽4 d、常规条件发芽1 d后低氧发芽3d、常规条件发芽2 d后低氧发芽2 d、低氧发芽2 d后常规条件发芽2 d。常规条件发芽即为大麦置于发芽机,低氧胁迫发芽时通氧量为6 L/min,培养液为柠檬酸缓冲液(pH5.5)。取2 d和4 d样品,测定GABA含量和芽长。
低氧发芽通氧量:称量150 g种子,固定温度为20 ℃,全程避光处理,正常发芽1 d后低氧浸泡发芽3 d,低氧胁迫发芽时通氧量分别为1、3、6、9 L/min,培养液为柠檬酸缓冲液(pH 5.5)。取2 d和4 d样品,测定GABA含量。
低氧发芽培养液pH:固定通氧量为3 L/min,培养液(柠檬酸缓冲液)pH分别为3.5、4.5、5.5、6.5。取2 d和4 d样品,测定GABA含量。
低氧发芽时间:固定通氧量为3 L/min,培养液为柠檬酸缓冲液(pH 5.5)取发芽72、84、96、108、120的样品,测定GABA含量。
响应面实验:在单因素实验基础上,根据响应面设计原理,考察通氧量、培养液pH和发芽时间对GABA含量影响,以GABA含量为响应值,采用响应曲面优化培养条件,用Design-expert 8.0.6对实验数据进行回归分析,得到二次线性回归方程,找出最佳工艺参数,实验因素水平见表1。
酶活性实验:在上述实验的基础上,按优化条件发芽培养,取样测定大麦芽相关指标。
1.4 测定指标与方法
含水量:另取100 g大麦,用同样的工艺同时进行浸麦处理。浸麦结束后,取出样品,拭去其表面水分,称重后用下式计算其含水量。
含水量=
露点率:随机选取100粒浸麦大麦样品,记录其露出白色根芽麦粒占总麦粒百分数;
芽长:随机选取30粒发芽大豆,用游标卡尺测定其芽长;
GABA含量:参照Syu等[13]的方法测定;
多胺氧化酶(PAO)、氨基醛脱氢酶(AMADH)和谷氨酸脱羧酶(GAD)活性:参照Yin等[14]的方法。
2 结果与分析
2.1 浸麦工艺优化
2.1.1 浸麦条件对含水量的影响
由图1可知,大麦含水量受到时间的显著影响(P<0.05),随着浸麦时间的增加,含水量呈上升趋势。浸麦36 h,含水量均达到37%以上。浸麦同一时间,不同通氧量间的含水量差异不显著(P>0.05)。
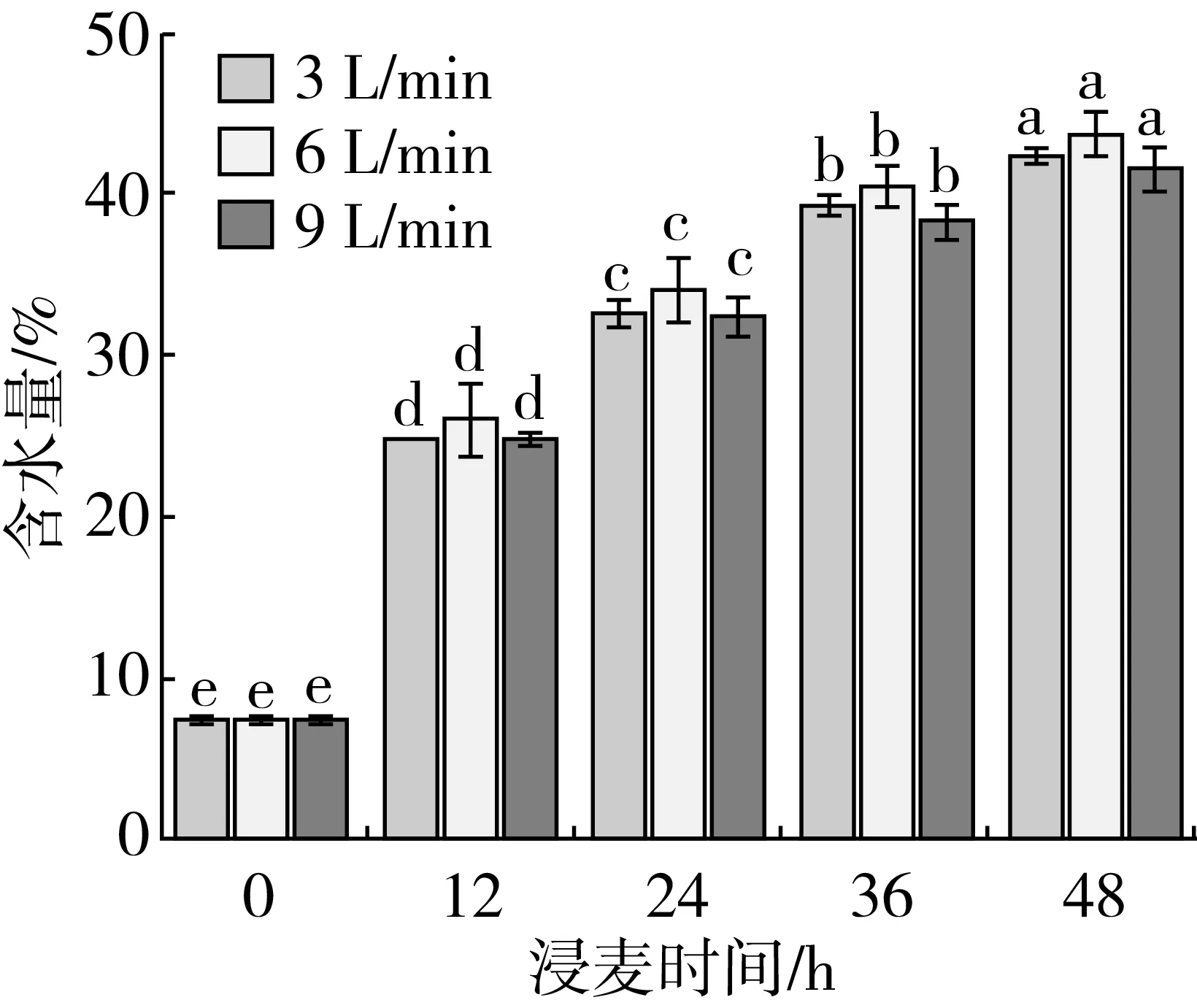
注:图中字母表示显著检验结果,不同小写字母表示处理间芽长差异达显著水平(P<0.05),余同。
图1浸麦时间和通氧量对含水量的影响
2.1.2 浸麦条件对露点率的影响
由图2可知,0~36 h大麦露点率随时间增加显著增加(P<0.05),36 h的露点率达到90%,48 h达到最大值。浸麦36 h和48 h通氧量越高露点率越高。

图2浸麦时间和通氧量对露点率的影响
2.1.3 浸麦条件对GABA含量的影响
由图3可知,GABA含量随时间增加而升高,48 h达到最大值。48 h时6 L/min含量最高,达到了0.132 mg/gDW。36 h时,3 L/min含量最高,达到了0.095 mg/gDW。
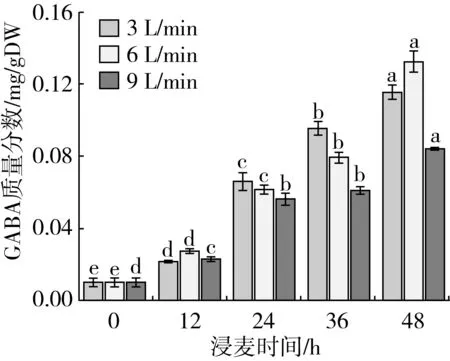
图3浸麦时间和通氧量对GABA含量的影响
选择36 h作为最佳浸麦时间。36 h时3 L/min的GABA含量最高,露点率超过90%,含水量满足发芽准备要求的39%[15],需要浸麦时间较短,因此控制浸麦通氧量为3 L/min,浸麦36 h。
2.2 发芽工艺优化
2.2.1 低氧胁迫方式对GABA含量及芽长的影响
由图4可知,发芽2 d后,低氧浸泡发芽的大麦生长受到抑制,生长状况差;发芽4 d后方式1的大麦生长状况劣于其他发芽方式,方式4的大麦芽长生长状态优于其他发芽方式,方式4的芽长显著高于其余胁迫方式(P<0.05),说明解除低氧胁迫状态后[16,17],大麦发芽状况恢复正常。低氧胁迫方式对芽长的影响显著,随着发芽时间的增加,芽长呈上升趋势。由图5可知,低氧胁迫方式对样品GABA含量影响显著(P<0.05),发芽4 d后方式2的GABA含量显著高于其余胁迫方式(P<0.05)。随着发芽时间的增加,GABA含量增加。
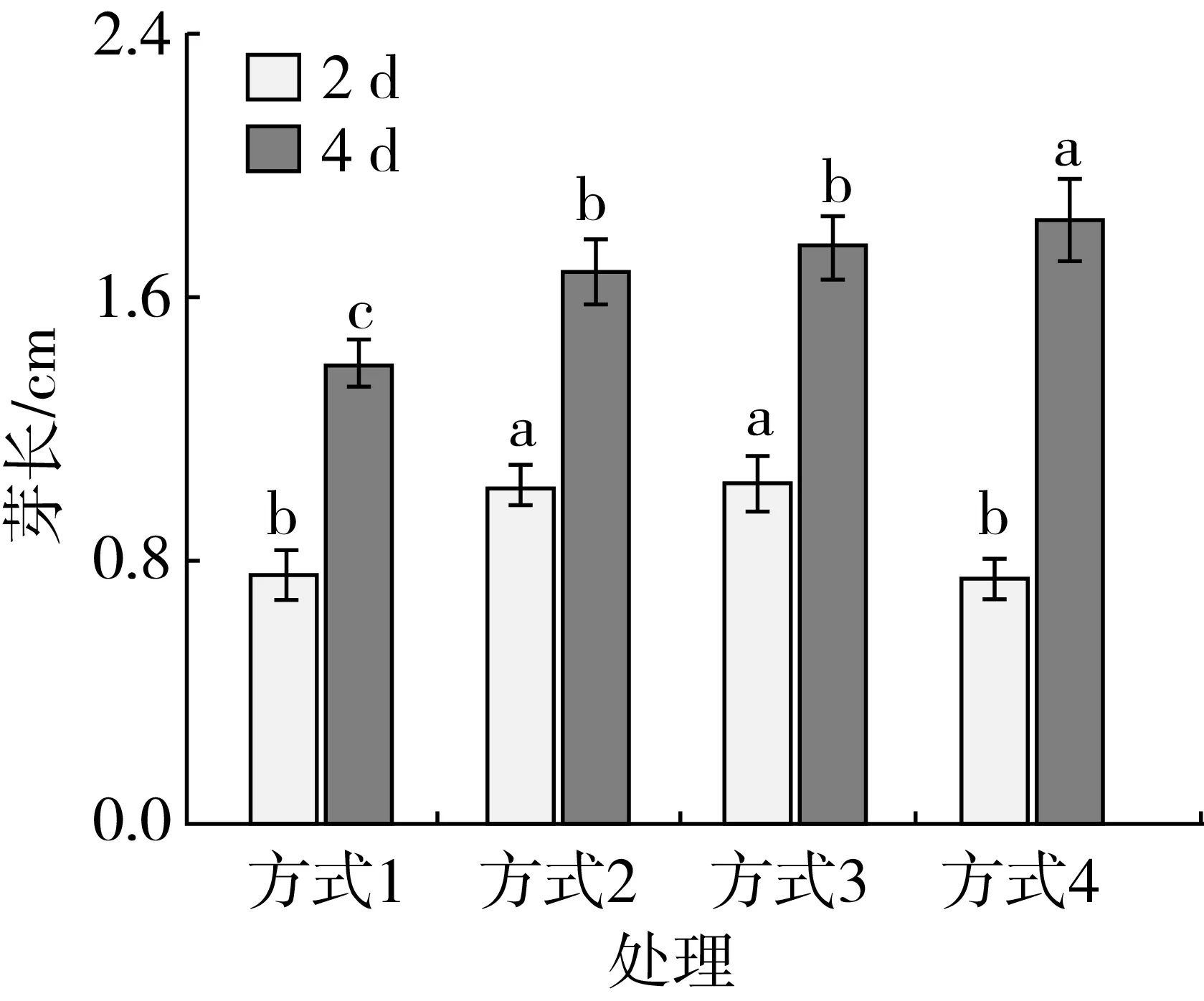
注:方式1:低氧发芽4 d;方式2:常规条件发芽1 d后低氧发芽3 d;方式3:常规条件发芽2 d后低氧发芽2 d;方式4:低氧发芽2 d后常规条件发芽2 d,余同。
图4低氧胁迫方式对大麦形态和芽长的影响
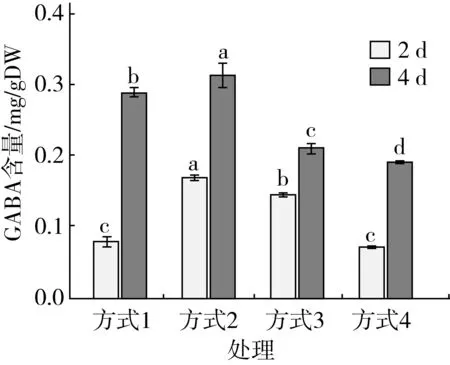
图5低氧胁迫方式对GABA含量的影响
2.2.2 通氧量对GABA含量的影响
由图6可知,除通氧量为1 L/min外,GABA含量随发芽时间的增加而增加,发芽4 d发芽通氧量对GABA含量影响显著(P<0.05),通氧量为3 L/min的GABA含量最高。
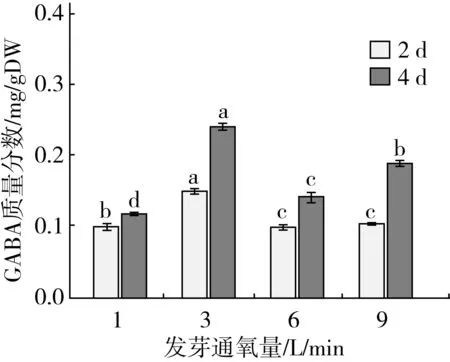
图6发芽通氧量对的GABA含量的影响
2.2.3 培养液pH对GABA含量的影响
由图7可知,样品中GABA含量随着发芽时间的增加而增加,培养液pH对GABA含量影响显著(P<0.05)。发芽4 d在缓冲液pH2.5~4.5和4.5~6.5范围内大麦芽中GABA含量分别随着pH的升高先增加后减少。缓冲液pH为3.5时,GABA含量最高,达到0.250 mg/g DW。
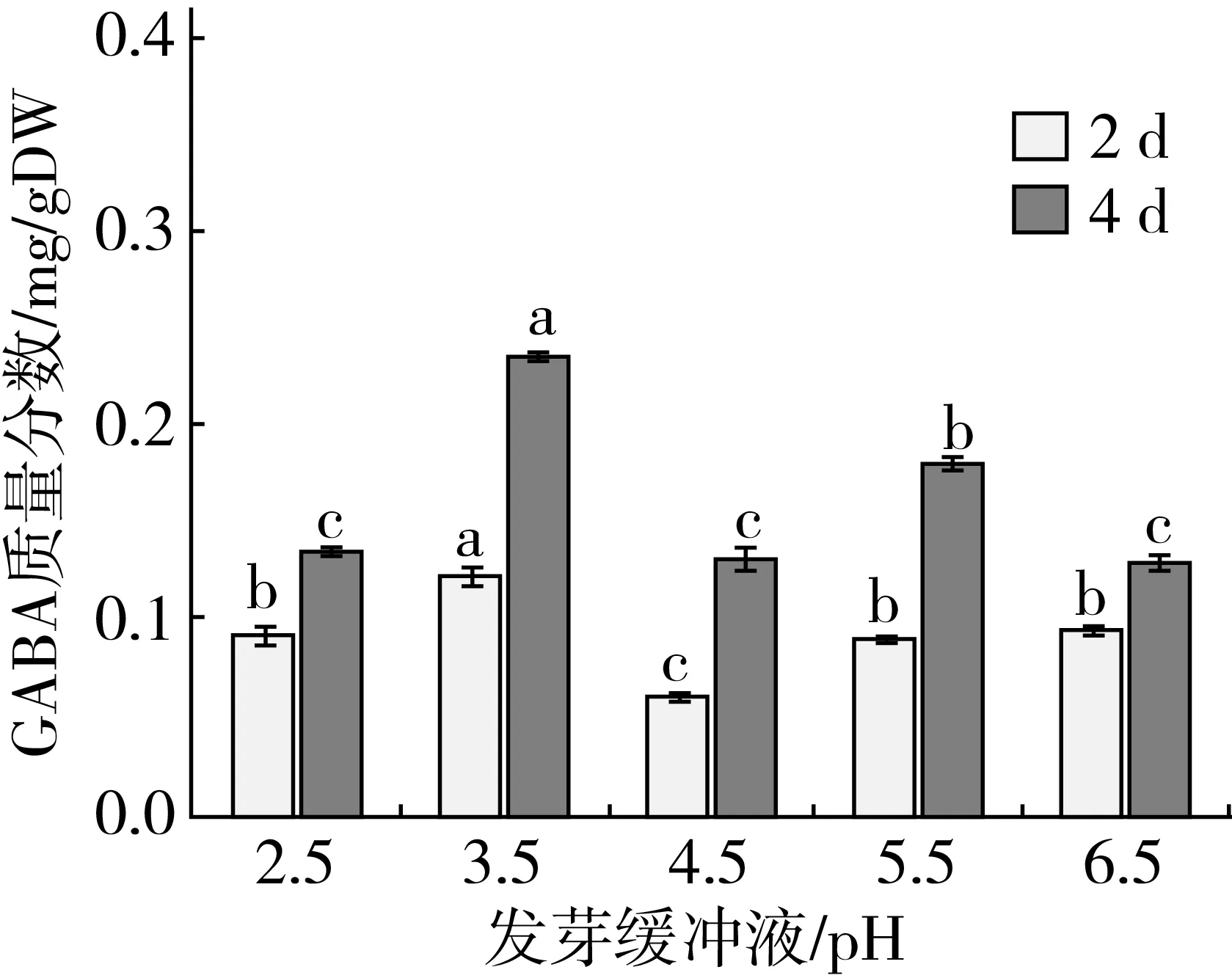
图7发芽缓冲液pH对GABA含量的影响
2.2.4 发芽时间对GABA含量的影响
由图8可知,发芽时间对GABA含量影响显著(P<0.05),随着发芽时间增加,GABA含量先增加后减少。发芽108 h时GABA含量最高,达到0.258mg/g DW。
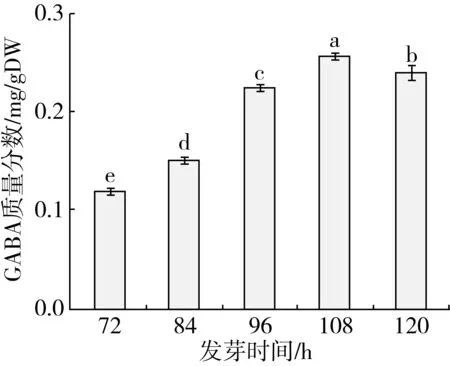
图8发芽时间对GABA含量的影响
2.2.5 响应面优化实验2.2.5.1 响应面模型的建立与方差分析
Box-behnken实验设计组合和数据见表2。采用Design Expert 8.0.6软件进行二次多元回归拟合,得GABA含量对因素A(培养液pH)、B(发芽通氧量)和C(发芽时间)的二次多项回归拟合方程:
GABA含量=-4.682 08+1.235 41A-0.069 767B+0.047 945C+0.044 385AB-1.5106 5×10-3AC+6.593 04×10-5BC-0.155 44A2-0.011 785B2-1.868 81×10-4C2
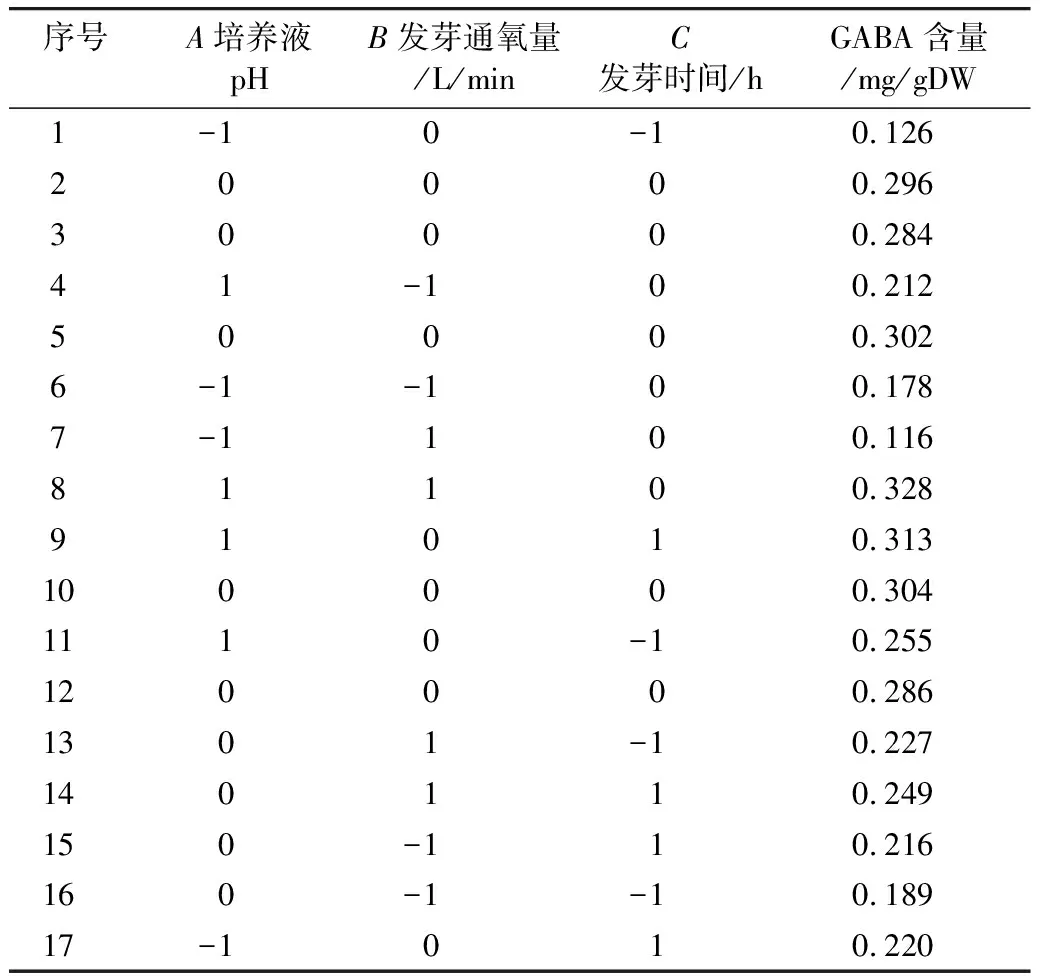
表2 Box-Behnken实验设计和数据表
由表3的统计分析表明,响应面模型P<0.001,说明此模型极显著;失拟项P=0.056 2>0.05,说明此模型拟合程度较好,该模型可用于进行数据分析及统计且97.31%的数据可以用该模型解释(R2=0.973 1);该模型的变异系数较小CV=6.57%,说明数据的变异程度小,置信度高。表3显示A、B、C、AB、A2、B2、C2具有显著性,而AC、BC对响应值没有显著影响。在上述的因素水平范围内,因素对响应值影响的大小顺序为:A(培养液pH)>C(发芽时间)>B(发芽通氧量)。
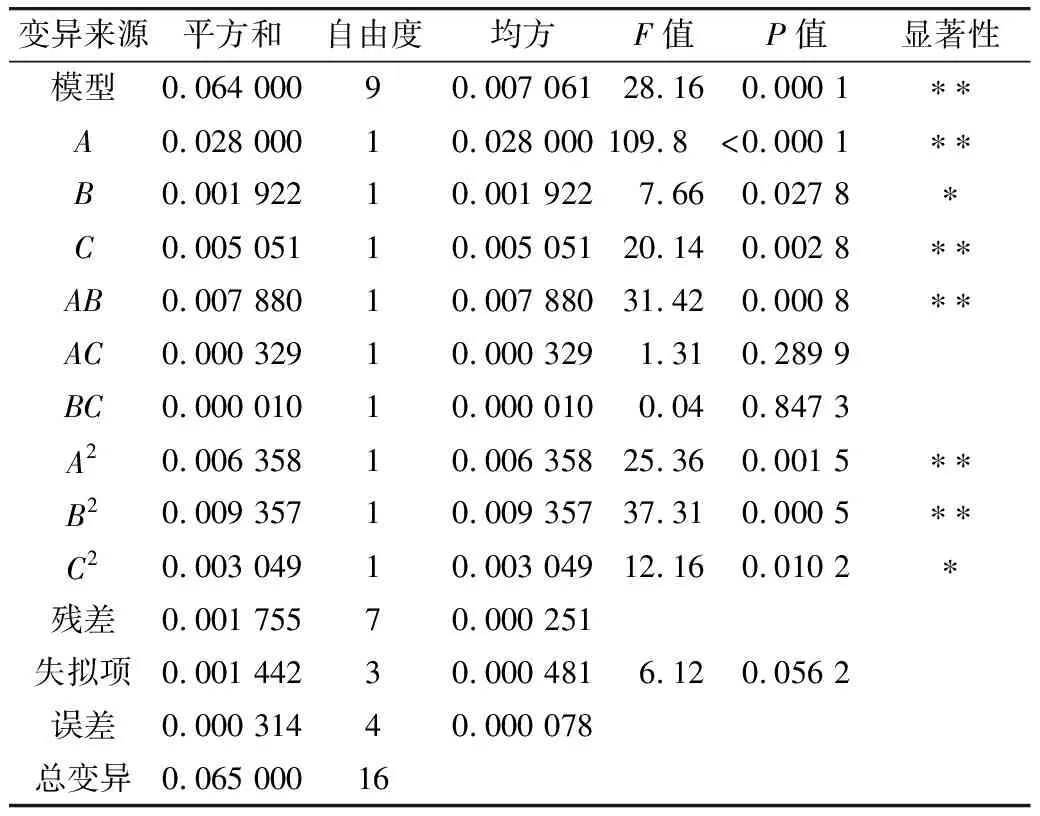
表3 回归模型方差分析
注:*表示在P<0.05水平上显著,**表示在P<0.01水平上显著。
2.2.5.2 响应曲面分析及优化
由图9a可知,当固定培养液pH时,GABA含量随通氧量的增加呈先增加后减少;当固定通氧量时,GABA含量随培养液pH的增加而先增加后减少,培养液pH和通氧量之间交互作用极显著(P<0.01)。由图9b可知,当固定培养液pH时,GABA含量随发芽时间的增加而先增加后减少;当固定发芽时间时,GABA含量随培养液pH的增加而先增加后减少。由图9c可看出,当固定通氧量时,GABA含量随发芽时间增加而先增加后减少;当固定发芽时间时,GABA含量随通氧量的增加而先增加后减少。
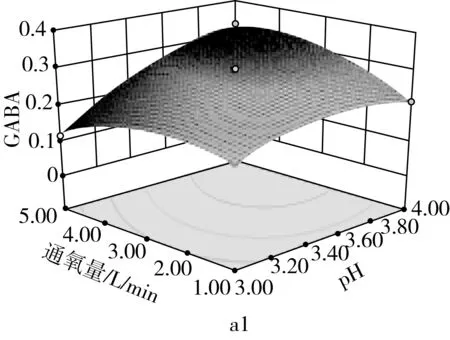
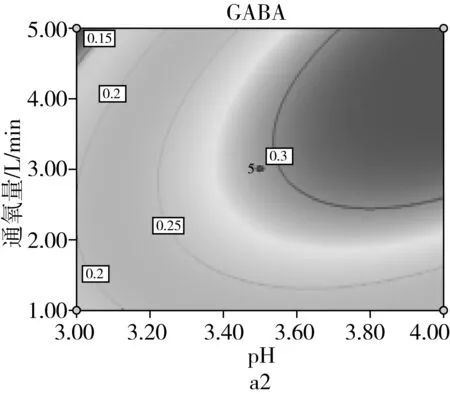
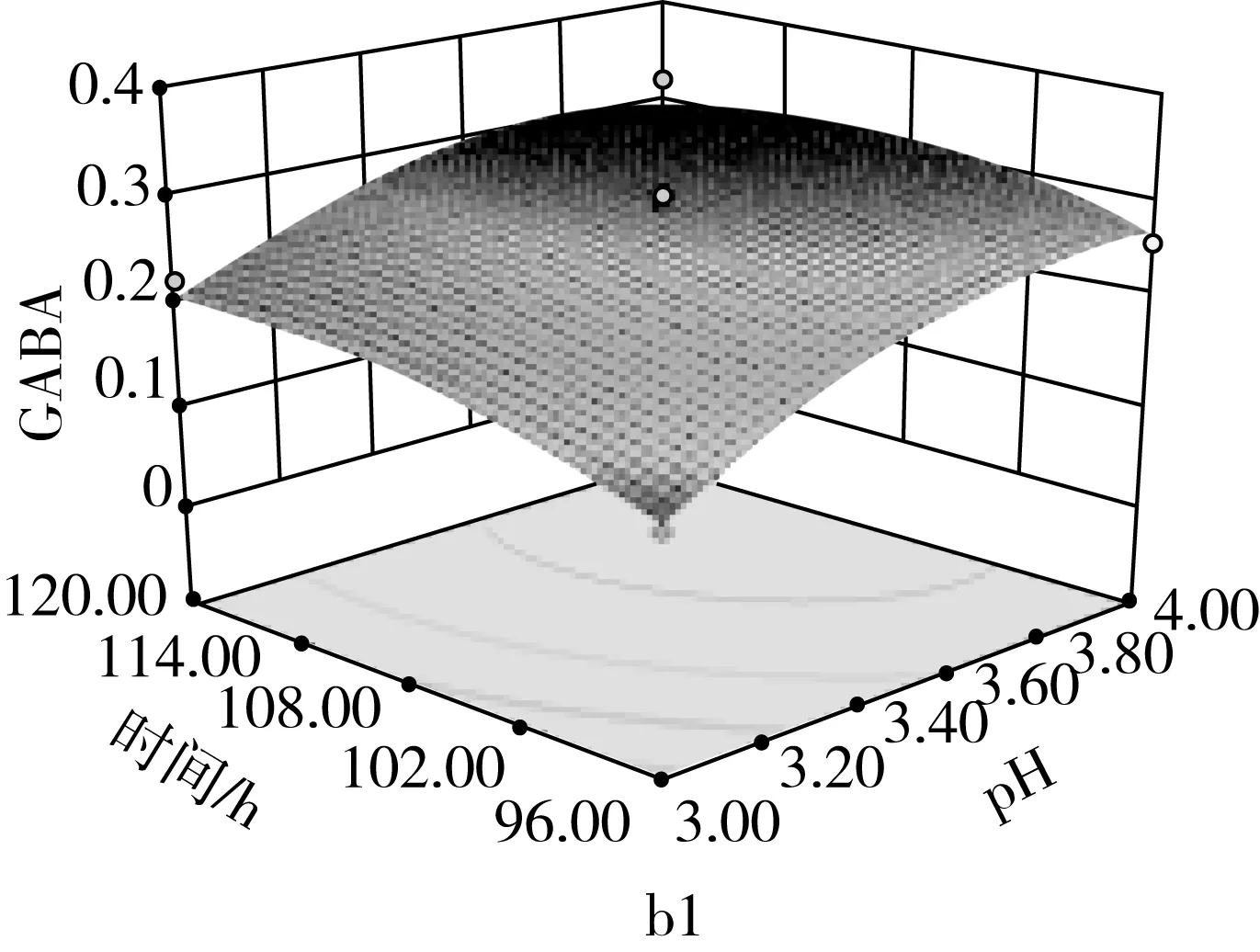
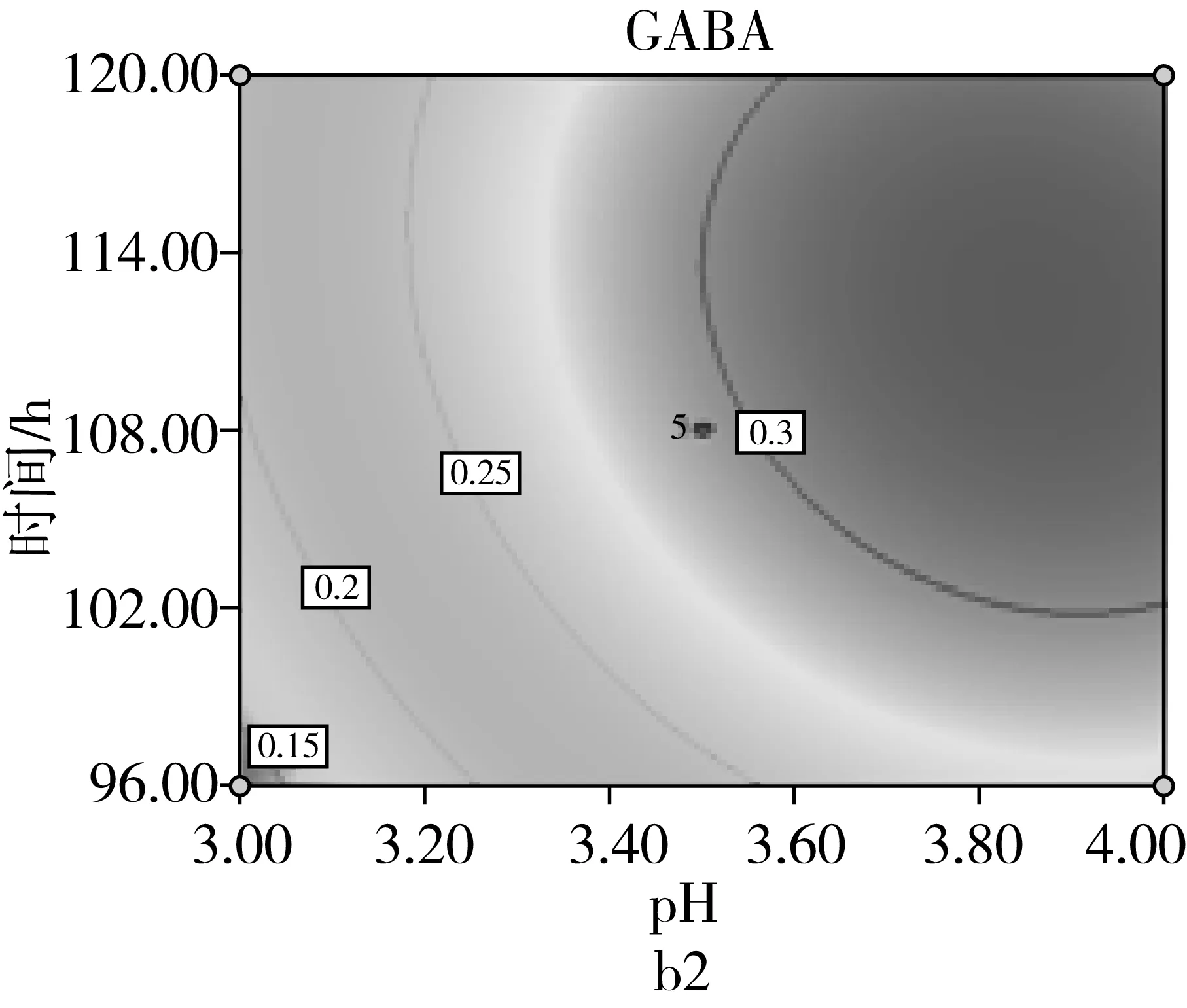
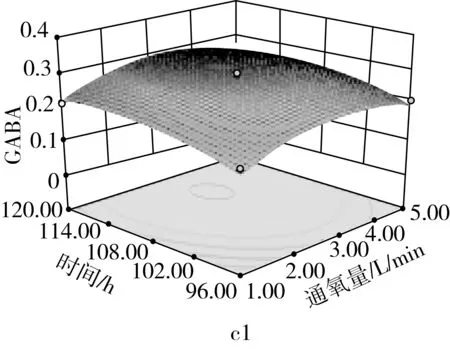

图9 各两因素对GABA含量的影响
2.2.6 富集工艺对GABA含量的影响
由图10可知,不同的工艺阶段对富集GABA的贡献存在差异,低氧胁迫发芽期间的贡献率最高,达到了71%,低氧浸麦的贡献为26%。
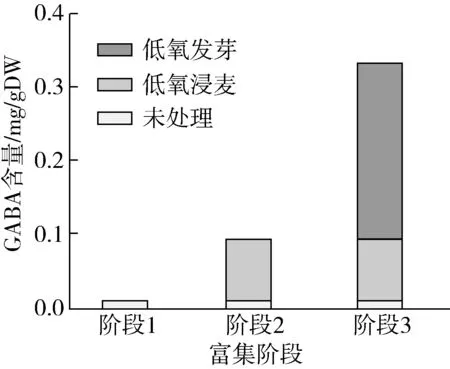
图10富集工艺对GABA含量的影响
2.2.7 酶活性实验
图11显示低氧胁迫96 h内,PAO活力无显著变化(P>0.05),而在111 h时,其活性显著降低,推测多胺降解途径对大麦在低氧胁迫发芽过程中富集GABA影响有限。低氧胁迫48~96 h内AMADH活性基本保持稳定,96 h后AMADH活力显著下降,推测本研究中AMADH活力下降原因可能与低氧环境下大麦主要依靠GABA支路合成GABA有关。GAD活性随着低氧胁迫发芽时间的延长而降低,48 h时为GAD活力为最高值,96~111 h内,GAD活力无显著性变化(P>0.05)。

图11低氧联合酸胁迫发芽期间大麦芽PAO、AMADH、GAD活力的变化
3 讨论
处于休眠期的大麦籽粒通过浸麦和发芽处理,能有效解除其休眠状态,恢复其正常的生理功能。而植物受到低氧[18]、高温[19]、低温[20]、盐[21]等逆环境胁迫时,会快速启动体内应激机制,植物体内会产生大量的GABA来应对外界逆环境的胁迫。低氧环境中,电子链中电子传递中断,糖类经糖酵解生成大量的丙酮酸,丙酮酸分解产生乳酸和乙醇,细胞质酸度升高,H+浓度升高,刺激GAD酶活力激活[22]。张强[23]、陈惠[24]等对糙米、蚕豆等进行低氧胁迫发芽处理,成功提高了原料中的GABA含量。本研究发现,控制通氧量为4.5 L/min,最适合大麦低氧发芽富集GABA,表明一定的通氧量有利于GABA富集;而过低的通氧量可能会严重影响麦芽发芽期间的呼吸作用,破坏三羧酸循环、糖酵解等[25]。蒋振晖等[26]研究发现,低酸性条件有利于GAD酶的激活,酶活力会显著提升,有利于植物体内GABA的富集。本实验在低氧浸泡发芽的基础上,考虑到培养液pH对结果的影响,结果证明低酸性培养液有利于低氧胁迫下发芽大麦GABA的富集。大麦是我国重要的作物,来源广泛,可利用大麦麦芽为原料开发营养型食品以推动大麦产业特色化发展,本实验优化所得工艺可以用于生产富含GABA的大麦麦芽,开发高GABA含量的大麦芽茶、大麦芽汁饮料、大麦面条等产品,以满足人体对GABA的日常需求。
4 结论
本研究所得最优浸麦条件为:全程低氧浸麦,通氧量为3 L/min,浸麦36 h;低氧胁迫方式为:正常发芽1 d后低氧浸泡发芽3 d。响应面实验显示,发芽pH、发芽时间和发芽通氧量对于富集GABA均有显著影响(P<0.05);最优工艺条件:发芽pH 4.0,发芽通氧量为4.5 L/min,发芽时间111 h, GABA含量最高可达到0.335 mg/gDW,与大麦籽粒GABA含量相比,GABA含量提高了33.6倍。
