黄草乌内生真菌接骨木镰孢菌B10.2次生代谢产物研究
2020-07-07丁中涛
罗 萍,舒 燕,朱 丽,丁中涛,蔡 乐
云南大学 云南省高校功能分子分析与生物转化重点实验室;教育部自然资源药物化学重点实验室;化学科学与工程学院,昆明 650091
镰孢菌属(Fusariumspp.)真菌是常见的植物病原菌,通常存在于植物有机体内或土壤中[1]。接骨木镰孢菌(Fusariumsambucinum)是镰孢菌属大家庭中的一员,可引起马铃薯干腐病。1984年,Mohr等[2]从接骨木镰孢菌的代谢产物中分离鉴定了2个C15-trichothecene单端孢霉烯族化合物和2个接骨木镰菌素sambucinol、sambucoin。1989年,Desjardins等[3]对接骨木镰孢菌的代谢产物进行了研究,报道了4个单端孢霉烯族类化合物和一个二乙氧基环烯醇。2002年,Sanson等[4]对接骨木镰孢菌的次生代谢产物进行了报道,发现了6个单端孢霉烯族化合物,5个双乙酸基草镰刀菌醇类化合物,1个bisaboline类化合物,1个新茄镰孢菌醇。2016年,本课题组研究了从黄草乌(AconitumvilmorinianumKom.)中分离获得的一株接骨木镰孢菌(F.sambucinumB10.2)的次生代谢产物,发现了一个含硫的四环三萜类化合物[5],且该化合物具有抑制大肠杆菌和金黄色葡萄球菌的活性。本文进一步对接骨木镰孢菌的次生代谢产物进行研究,并对分离得到的部分化合物进行抑菌活性和乙酰胆碱酯酶抑制活性研究。
1 材料与方法
1.1 仪器、试剂与材料
1.1.1 实验仪器
核磁共振波谱仪(Bruker AVANCE 400 MHz,Bruker DRX-500 MHz,Brucker AVANCE Ⅲ 600 MHz,德国Bruker公司);高分辨质谱仪(Agilent G3250AA LC/MSD TOF,美国Agilent公司);立式高压灭菌锅(YXQ-L31-400,上海涵今仪器仪表);紫外无菌操作台(SW-CJ-2FD,苏州净化设备有限公司);恒温培养箱(DHP-9272,上海一恒科技有限公司);恒温摇床(BS-4G,常州中捷实验仪器制造公司)。
1.1.2 实验试剂
Pyridine-d5、dimethyl sulfoxide-d6、CD3OD、CDCl3(Sigma-Aldrich公司);乙酰胆碱酯酶(Sigma-Aldrich公司);碘化硫代乙酰胆碱(Sigma-Aldrich公司);他克林(Sigma-Aldrich公司);制霉素(≥4,400 USP units/mg,阿拉丁试剂有限公司);硫酸卡那霉素(北京百灵威科技有限公司);甲醇(MeOH)、氯仿(CHCl3)、石油醚(PE)、丙酮(acetone)和乙酸乙酯(EA)均为分析纯。
1.1.3 实验材料
柱层析硅胶(200~300、300~400目,青岛海洋化工有限公司);葡聚糖凝胶(Sephadex LH-20,美国Amersham公司);C-18烷基键合硅胶填料(RP-18,德国默克);薄层层析硅胶板(G型,青岛海洋化工有限公司)。
1.1.4 菌株材料
接骨木镰孢菌(F.sambucinumB10.2)分离自黄草乌(A.vilmorinianumKom.),其ITS序列已提交至GenBank(accession number:KU987439)。黄草乌采于云南省昆明市双哨乡,由遵义医科大学珠海校区陈阳教授鉴定。
白色念珠菌(Candidaalbicans)、枯草芽孢杆菌(Bacillussubtilis)、大肠杆菌(Escherichiacoli)和金黄色葡萄球菌(Staphylococcusaureus)四种病原菌均由云南省微生物研究所提供。
1.2 实验方法
1.2.1 菌株培养
将接骨木镰孢菌在PDA培养基上进行活化和扩大,在28 ℃培养箱中培养7天后备用。称取去皮洗净切碎的土豆块3.6 kg,分别装入60个组培瓶,每瓶60 g土豆,于121 ℃下灭菌30 min后冷却备用。在紫外无菌操作台中,将活化后的接骨木镰孢菌菌丝接种到冷却的土豆块上,于28 ℃恒温培养箱中培养30天。
1.2.2 发酵物的提取分离
固体发酵完成后,往发酵物中加入适量甲醇,利用超声重复提取三次后蒸干,得到总浸膏54.2 g。将得到的粗提物利用硅胶柱色谱进行初步分离,洗脱剂为CHCl3-MeOH(100∶0→1∶1)。粗分得到Fr.1(CHCl3∶MeOH = 100∶0)、Fr.2(CHCl3∶MeOH = 100∶1)、Fr.3(CHCl3∶MeOH = 50∶1)、Fr.4(CHCl3∶MeOH = 10∶1)、Fr.5(CHCl3∶MeOH = 5∶1)、Fr.6(CHCl3∶MeOH = 1∶1)六部分。利用硅胶柱色谱(PE-EA)和凝胶柱色谱(MeOH)将Fr.2段进行分离和纯化后得到7(6.0 mg);Fr.3段经过反复硅胶柱色谱(PE-acetone)分离和凝胶柱色谱(MeOH)纯化得到5(3.2 mg)、6(4.0 mg)、1(6.0 mg);Fr.4段经过硅胶柱色谱(CHCl3-MeOH)得到Fr.4a、Fr.4b、Fr.4c和Fr.4d四段,Fr.4a经过反相柱色谱(MeOH-H2O)得到3(20.2 mg),Fr.4b经过反复硅胶柱色谱和凝胶柱色谱得到2(5.0 mg)和10(10.3 mg),Fr.4c经过反相柱色谱(MeOH-H2O)进行分离后,再通过凝胶柱色谱(MeOH)纯化得到8(3.4 mg);Fr.5经过硅胶柱色谱(CHCl3-MeOH)得到了Fr.5a、Fr.5b和Fr.5c三部分,Fr.5b经过硅胶柱色谱(CHCl3-MeOH)洗脱分离得到两部分,将这两部分分别通过凝胶柱色谱纯化得到4(40.5 mg)和9(4.2 mg)。分离实验中使用的显色剂为碘单质和10% H2SO4-EtOH溶液。
1.2.3 抑菌活性
本次抑菌活性实验所使用的真菌为白色念珠菌(C.albicans),三种细菌为枯草芽孢杆菌(B.subtilis)、大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)。该实验采用二倍稀释法[6]于96孔板上进行测试,真菌阳性对照为制霉素,细菌阳性对照为硫酸卡那霉素。
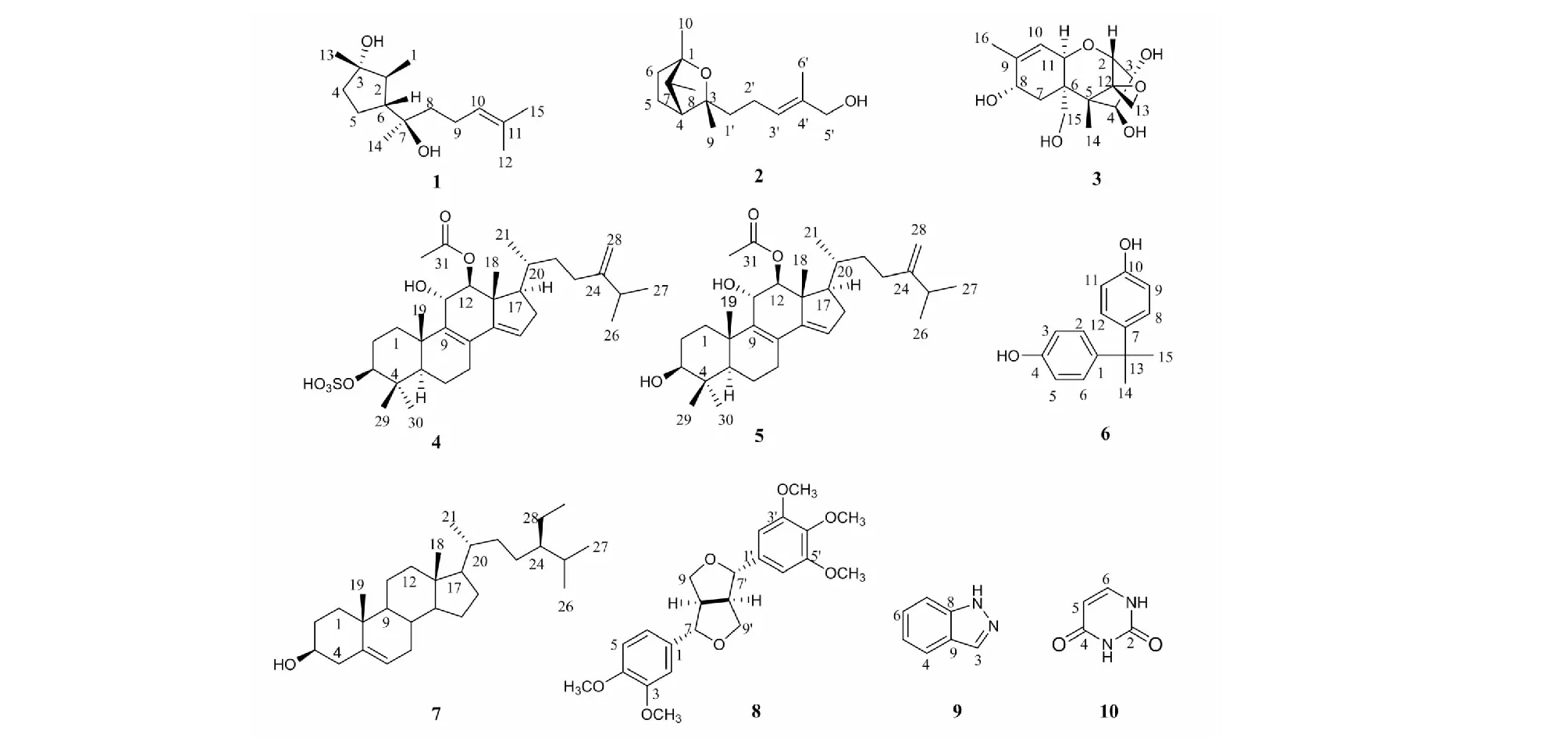
图1 化合物1~10的结构
1.2.4 乙酰胆碱酯酶抑制活性
乙酰胆碱酯酶抑制活性的测定方法采用文献[7]中的Ellman法,阳性对照为他克林。实验步骤如下。
1.2.4.1 溶液的配制
PB(0.1 M磷酸盐缓冲溶液,pH=8.0)的配制:100 mL磷酸缓冲溶液中含5.3 mL 0.1 M NaH2PO4溶液和94.7 mL 0.1 M Na2HPO4溶液,调节其pH值至8.0。待测化合物用DMSO溶解,配成10 mM的溶液,再用PB稀释成1 mM的溶液。他克林用PB配制成6.66 μM的溶液;DMSO用PB稀释成10%的溶液。ATCI和DTNB均用PB配成6.25 mM的工作液,乙酰胆碱酯酶用PB稀释成0.1 U/mL的溶液。
1.2.4.2 铺板
乙酰胆碱酯酶活性测定在96孔板上进行。样品组加入110 μL PB、10 μL待测化合物(1 mM)和40 μL乙酰胆碱酯酶溶液(0.1 U/mL);阳性对照组加入110 μL PB、10 μL他克林(6.66 μM)和40 μL乙酰胆碱酯酶溶液(0.1 U/mL);阴性对照组加入110 μL PB、10 μL10% DMSO和40 μL乙酰胆碱酯酶溶液(0.1 U/mL)。
1.2.4.3 酶标仪检测
将96孔板于37 ℃下放置20 min,然后用Tecan Inifinite M200 Pro 酶标仪在412 nm处读取三次背景值。读取背景值后取出96孔板,在每个孔中加入40 μL ATCI(6.25 mM)和DTNB(6.25 mM)的等体积混合液,应保证板中每个孔溶液终体积为200 μL,待测化合物终浓度为50 μM,他克林终浓度为0.333 μM。最后测定其在412 nm处的吸光值,每隔30 s采集一次数据,当阴性对照组吸光值超过1时,停止采集。
1.2.4.4 数据处理
选择阴性对照组吸光值最接近1的那一组数据来计算乙酰胆碱酯酶抑制率I。I=[(AE-AB)-(AS-AB)]/(AE-AB)×100%,其中AS为样品组吸光值,AE为阴性对照组吸光值,AB为背景值。
2 结果与讨论
2.1 化合物结构鉴定
化合物1白色晶体;1H NMR(500 MHz,CD3OD)δ:5.12(1H,m,H-10),2.05(2H,m,H-9),1.68(3H,s,CH3-15),1.62(3H,s,CH3-12),1.25(3H,s,CH3-13),1.16(3H,s,CH3-14),1.04(3H,d,J= 7.0 Hz,CH3-1);13C NMR(125 MHz,CD3OD)δ:14.5(q,C-1),44.2(d,C-2),81.3(s,C-3),40.4(t,C-4),24.3(t,C-5),54.3(d,C-6),74.9(s,C-7),40.4(t,C-8),22.7(t,C-9),124.5(d,C-10),131.7(s,C-11),25.7(q,C-12),26.1(q,C-13),25.1(q,C-14),17.7(q,C-15)。以上数据与文献[8]中报道的数据一致,故鉴定该化合物为cyclonerodiol。
化合物2无色油状;1H NMR(600 MHz,CD3OD)δ:5.40(1H,td,J= 7.1,1.1 Hz,H-3′),3.92(2H,s,H-5′),2.11(2H,m,H-2′),1.22(3H,s,CH3-10),1.14(3H,s,CH3-9),1.02(3H,d,J= 6.8 Hz,H-8);13C NMR(150 MHz,CD3OD)δ:82.0(s,C-1),75.5(s,C-3),55.5(d,C-4),25.2(t,C-5),41.4(t,C-6),45.5(d,C-7),15.4(q,C-8),25.2(q,C-9),26.1(q,C-10),41.7(t,C-1′),23.3(t,C-2′),127.1(d,C-3′),135.8(s,C-4′),69.0(t,C-5′),13.7(q,C-6′)。以上数据与文献[9]中报道的数据一致,故鉴定该化合物为trichoderiol A。
化合物3白色粉末;1H NMR(600 MHz,CD3OD)δ:5.54(1H,d,J= 5.0 Hz,H-10),4.13(1H,d,H-2,J= 3.4 Hz),4.10(1H,m,H-3),4.01(1H,d,J= 4.7 Hz,H-11),3.81(1H,d,J= 5.5 Hz,H-8),3.73(1H,d,J= 12.5 Hz,H-15b),3.41(1H,d,J= 2.9 Hz,H-15a),3.39(1H,d,J= 4.8 Hz,H-4),2.91(1H,d,J= 4.1 Hz,H-13a),2.77(1H,d,J= 4.1 Hz,H-13b),1.83(3H,s,H-16),0.84(3H,s,H-14);13C NMR(150 MHz,CD3OD)δ:82.2(d,C-2),80.7(d,C-3),80.4(d,C-4),50.3(s,C-5),49.8(s,C-6),29.8(t,C-7),69.9(d,C-8),140.9(s,C-9),122.6(d,C-10),66.8(d,C-11),65.8(s,C-12),47.2(t,C-13),7.3(q,C-14),63.0(t,C-15),20.8(q,C-16)。以上数据与文献[10]中报道的数据一致,故鉴定该化合物为T-2 tetraol。
化合物4白色粉末;1H NMR(400 MHz,Pyridine-d5)δ:5.68(1H,s,H-15),5.64(1H,s,H-12),4.82(2H,d,J= 10.4 Hz,H-28),4.71(1H,s,H-11),4.41(1H,m,H-3),2.12(3H,s,H-32),1.53(3H,s,H-19),1.44(3H,s,H-18),1.02(3H,s,H-30),1.01(3H,s,H-27),1.00(3H,s,H-26),0.98(3H,s,H-29),0.97(3H,s,H-21);13C NMR(100 MHz,Pyridine-d5)δ:34.6(t,C-1),25.0(t,C-2),84.8(d,C-3),38.9(s,C-4),50.7(d,C-5),18.2(t,C-6),27.2(t,C-7),125.0(s,C-8),140.3(s,C-9),37.5(s,C-10),68.6(d,C-11),79.2(d,C-12),47.3(s,C-13),148.0(s,C-14),120.4(d,C-15),35.5(t,C-16),49.5(d,C-17),17.1(q,C-18),22.4(q,C-19),33.6(d,C-20),18.2(q,C-21),34.8(t,C-22),31.1(t,C-23),156.3(s,C-24),33.8(d,C-25),21.9(q,C-26),21.8(q,C-27),106.5(t,C-28),16.7(q,C-29),28.3(q,C-30),170.4(s,C-31),21.1(q,C-32)。以上数据与文献[5]中报道的数据一致,故鉴定该化合物为sambacide。
化合物5分子式为C32H50O4,白色晶体;HR-ESI-MS:m/z521.359 9[M + Na]+(calcd for C32H50O4Na 521.360 7);1H NMR(500 MHz,CD3OD)δ:5.60(1H,s,H-15),5.07(1H,m,H-12),4.73(2H,d,J= 7.2 Hz,H-28),4.25(1H,s,H-11),3.20(1H,m,H-3),2.02(3H,s,H-32),1.28(3H,s,H-26),1.24(3H,s,H-27),1.10(3H,s,H-18),1.05(3H,m,H-19),1.02(3H,s,H-30),0.94(3H,d,J= 6.5 Hz,H-21),0.87(3H,s,H-29);13C NMR(125 MHz,CD3OD)δ:35.7(t,C-1),28.3(t,C-2),80.1(d,C-3),40.2(s,C-4),51.9(d,C-5),19.3(t,C-6),28.2(t,C-7),126.8(s,C-8),14.3(s,C-9),38.5(s,C-10),69.3(d,C-11),79.6(d,C-12),48.0(s,C-13),148.7(s,C-14),121.6(d,C-15),36.3(t,C-16),50.4(d,C-17),17.1(q,C-18),22.3(q,C-19),36.2(d,C-20),18.7(q,C-21),34.9(t,C-22),32.0(t,C-23),157.6(s,C-24),34.5(d,C-25),22.5(q,C-26),22.6(q,C-27),107.0(t,C-28),16.2(q,C-29),28.8(q,C-30),172.3(s,C-31),21.1(q,C-32)。以上数据与文献[11]中报道的数据一致,故鉴定该化合物为12β-acetoxy-4,4-dimethyl-24-methylene-5α-cholesta-8,14-diene-3β,11α-diol。
化合物6分子式为C15H16O2,无色油状;HR-ESI-MS:m/z227.108 0[M-H]-(calcd for C15H15O2227.107 2);1H NMR(600 MHz,CD3OD)δ:7.02(4H,dd,J= 2.0,6.5 Hz,H-2,6,8,12),6.66(4H,dd,J= 2.0,6.5 Hz,H-3,5,9,11),1.57(6H,s,H-14,15);13C NMR(150 MHz,CD3OD)δ:143.5(s,C-1),128.7(d,C-2,6,8,12),115.6(d,C-3,5,9,11),155.9(s,C-4,10),143.5(s,C-7),42.5(s,C-13),31.7(q,C-14,15)。以上数据与文献[12]中报道的数据一致,故鉴定该化合物为bisphenol A。
化合物7无色针晶;1H NMR(500 MHz,CDCl3)δ:5.35(1H,d,J= 5.1 Hz,H-6),3.52(1H,m,H-3),1.01(3H,s,H-19),0.97(3H,d,J= 7.0 Hz,H-21),0.95~0.80(9H,overlapped,H-26,27,29),0.68(3H,s,H-18);13C NMR(125 MHz,CDCl3)δ:37.5(t,C-1),31.9(t,C-2),72.0(d,C-3),42.5(t,C-4),140.9(s,C-5),121.9(d,C-6),32.1(t,C-7),31.9(d,C-8),50.4(d,C-9),36.3(s,C-10),21.3(t,C-11),28.4(t,C-12),40.0(s,C-13),57.0(d,C-14),24.5(t,C-15),40.0(t,C-16),56.2(d,C-17),12.2(q,C-18),19.6(q,C-19),36.7(d,C-20),19.6(q,C-21),34.2(t,C-22),26.3(t,C-23),46.1(d,C-24),28.8(d,C-25),19.0(q,C-26),20.0(q,C-27),23.3(t,C-28),12.0(q,C-29)。以上数据与文献[13]中报道的数据一致,故鉴定该化合物为β-谷甾醇。
化合物8分子式为C23H28O7,无色固体;HR-ESI-MS:m/z855.3583[2M+Na]+(calcd for C46H56O14Na 855.3568);1H NMR(600 MHz,CD3OD)δ:6.92~6.94(3H,m,H-2,5,6),6.68(2H,s,H-2′,6′),4.75(2H,m,H-7/H-7′),4.26,3.89(each 2H,m,H-9/H-9′),3.84(6H,s,OCH3-3′,5′),3.82(6H,s,OCH3-3,4),3.74(3H,s,OCH3-4′),3.14(2H,m,H-8/H-8′);13C NMR(150 MHz,CD3OD)δ:135.4(s,C-1′),104.4(d,C-2′,6′),154.7(s,C-3′,5′),138.8(s,C-4′),87.3(d,C-7′),55.4(d,C-8′),72.8(t,C-9′),135.4(s,C-1),111.4(d,C-2),148.7(s,C-3),150.2(s,C-4),111.4(d,C-5),119.8(d,C-6),87.2(d,C-7),55.4(d,C-8),72.7(d,C-9),56.5(OCH3-3,4),56.7(OCH3-3′,5′),61.1(OCH3-4′)。以上数据与文献[14]中报道的数据一致,故鉴定该化合物为木兰脂素。
化合物9白色无定型粉末;1H NMR(600 MHz,CD3OD)δ:8.07(1H,dd,J= 1.6,7.4 Hz,H-4),7.94(1H,s,H-3),7.44(1H,dd,J= 1.1,7.3 Hz,H-7),7.20(1H,m,H-6),7.18(1H,m,H-5);13C NMR(150 MHz,CD3OD)δ:133.4(d,C-3),122.4(d,C-4),122.0(d,C-5),127.6(d,C-6),112.9(d,C-7),138.2(s,C-8),123.6(s,C-9)。以上数据与文献[15]中报道的数据一致,故鉴定该化合物为吲唑。
化合物10白色粉末;1H NMR(600 MHz,DMSO-d6)δ:7.38(1H,d,J= 7.6 Hz,H-6),5.44(1H,d,J= 7.6 Hz,H-5);13C NMR(150 MHz,DMSO-d6)δ:151.6(s,C-2),164.4(s,C-4),100.2(d,C-5),142.3(d,C-6)。以上数据与文献[16]中报道的数据一致,故鉴定该化合物为尿嘧啶。
2.2 抑菌活性
对化合物1~7和9进行白色念珠菌(C.albicans)、枯草芽孢杆菌(B.subtilis)、大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)抑制活性的测定,实验结果见表1。
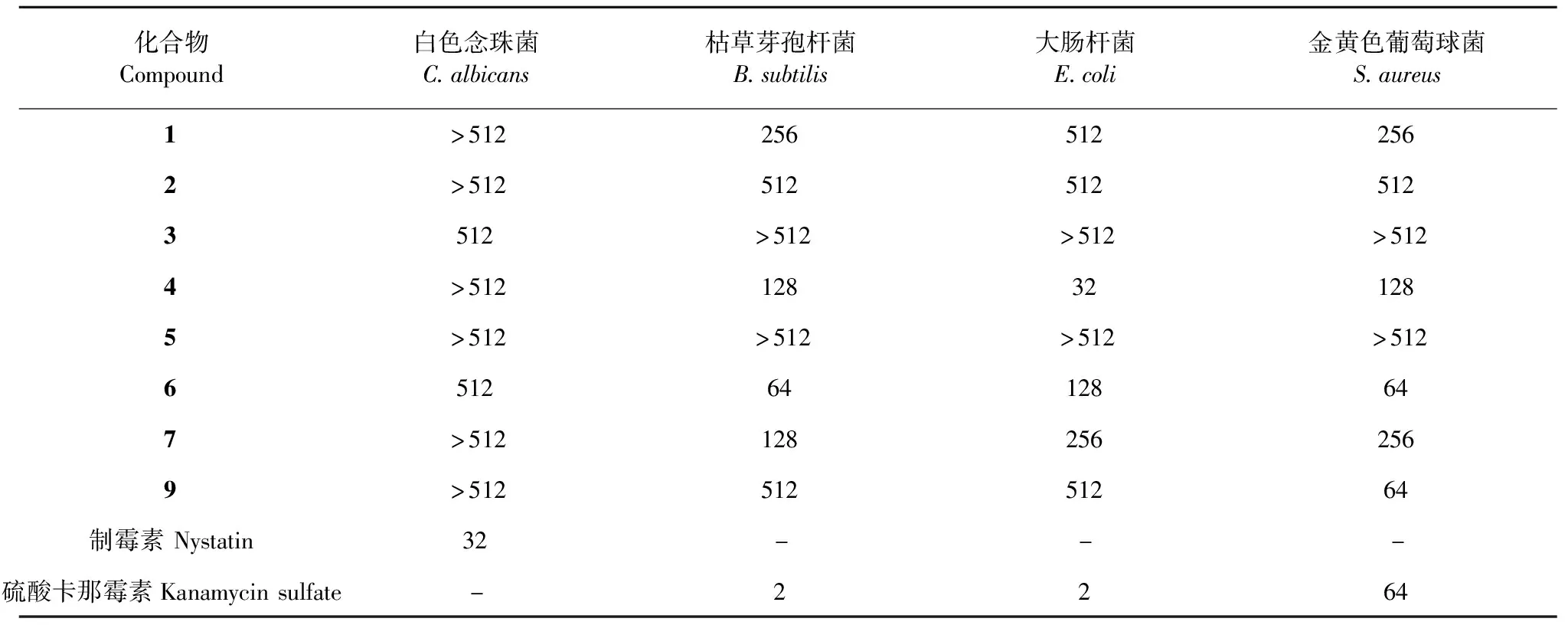
表1 部分化合物最小抑菌浓度
抑菌实验结果表明,所测化合物对白色念珠菌均没有明显的抑菌活性,3和6的最小抑菌浓度(MIC)为512 μg/mL,其余化合物的MIC值均大于512 μg/mL。于枯草芽孢杆菌而言,4、6与7对枯草芽孢杆菌具有一定的抑制活性,4和7的MIC值为128 μg/mL,6的MIC值为64 μg/mL。于大肠杆菌而言,发现4的MIC值为32 μg/mL,其具有一定的抑制活性,6的MIC值为128 μg/mL,其余化合物无明显的抑制活性。于金黄色葡萄球菌而言,6和9的MIC值与阳性对照所测相同,均为64 μg/mL,说明6和9具有较强的金黄色葡萄球菌抑制活性,4的MIC值128 μg/mL,1和7的MIC值256 μg/mL,其余化合物无明显的抑制活性。
2.3 乙酰胆碱酯酶抑制活性
对化合物(1~5和7)进行乙酰胆碱酯酶抑制活性测定,待测化合物终浓度为50 μM,他克林终浓度为0.333 μM。实验结果表明,1、5与7基本无抑制作用(抑制率<10%);2、3与4具有一定的抑制活性,其中4的抑制率为47.13%,2和3的抑制率分别为18.21%和29.83%;阳性对照他克林的抑制率为61.19%。
3 结论
本文对接骨木镰孢菌B10.2的次生代谢产物进行了研究,并对部分化合物进行了抑菌活性和乙酰胆碱酯酶抑制活性实验。从接骨木镰孢菌B10.2的次生代谢产物中共分离鉴定了10个已知化合物,其中6首次从天然产物中发现。化合物类型主要有萜类(5个)、甾体(1个)、取代苯丙素(1个)、木脂素(1个)、含氮化合物(2个)。化合物6和9对金黄色葡萄球菌具有较强的抑制活性,4对大肠杆菌具有一定的抑制活性,2、3和4具有中等强度的抑制乙酰胆碱酯酶的活性。本研究为接骨木镰孢菌次生代谢产物的利用提供了科学依据。
