白刺花花蕾化学成分及其抑制丁酰胆碱酯酶活性研究
2020-07-07邱天雯张东东施银仙龙美芝李建文王跃虎杨雪飞
邱天雯,张东东,施银仙,龙美芝,李建文,王跃虎,杨雪飞,3*,易 平
1中国科学院昆明植物研究所 资源植物与生物技术重点实验室,昆明 650201;2中国科学院大学,北京 100049;3中国科学院东南亚生物多样性研究中心,耶津 05282;4贵州医科大学 省部共建药用植物功效与利用国家重点实验室;5贵州省中国科学院天然产物化学重点实验室/贵州省天然药物工程研究中心,贵阳 550014;6百色学院,百色 533000
白刺花Sophoradavidii(Franch.)Skeels.(异名:SophoraviciifoliaHance.)为豆科(Leguminosae)蝶形花亚科槐属植物,又叫苦刺花、狼牙刺、马蹄针等。广布于陕西、甘肃、河南、江苏、浙江、湖北、湖南、广西、四川、贵州、云南、西藏等地,生长于海拔2 500 m以下的河谷沙丘和山坡路边的灌木丛中。其花蕾在民间广泛食用,根据民间知识及药典,其花可用于盗汗、中暑,可治疗咽喉肿痛、臃肿疮毒、尿血便血等,具有清热解毒、凉血消肿的功效[1-3]。前人曾报道白刺花具有抗肿瘤[4]、抗菌[5]、抗炎、抗过敏[6]、抗病毒[7]和抗氧化[8]等多种药理活性。目前国内外对白刺花的研究主要集中在根、种子的化学成分和花正丁醇萃取部位的化学成分,尚未开展对白刺花花部位的二氯甲烷萃取部位化学成分的系统研究。此外,有研究表明同属植物山豆根(S.tonkinensisGagnep.)的乙醇提取物具有较强的丁酰胆碱酯酶抑制活性,其中主要的化学成分为苦参碱型生物碱[9];同时有研究表明苦参碱可抑制乙酰胆碱酯酶/丁酰胆碱酯酶活性起神经保护作用,有潜力发展为治疗阿尔兹海默症的新型药物[10]。本研究对白刺花花蕾二氯甲烷萃取部位展开系统分析,以探明其生物碱成分及其抑制丁酰胆碱酯酶的生物活性。
1 仪器与材料
1.1 仪器与试剂
JASCO P-1020型全自动数字旋光仪测量比旋光度;Shimadzu UV-2401PC分光光度计测量UV光谱数据;JASCO J-815圆二色光谱仪测量CD光谱;Bruker Avance 500、600和800 NMR获得1H NMR和13C NMR数据,化学位移的单位为δ(ppm),偶合常数(J)的单位为Hz;Agilent 1290 UPLC/6540 Q-TOF测量ESI-MS和HR-ESI-MS数据。柱层析材料包括正相硅胶G(80~100目,300~400目,青岛海洋化工厂)、正向硅胶H(HG/T2354-2010,青岛海洋化工厂)、反相硅胶RP-C18(40~75 μm,日本Fuji Silysia化学公司)和葡聚糖凝胶SephadexTMLH-20(GE Healthcare Bio-Sciences AB)。Agilent 1200半制备液相色谱仪(美国安捷伦公司),配备色谱柱Agilent Zorbax SB-C18柱(5.0 μm,Φ9.4×250 mm,美国)、Agilent InfinityLab Poroshell 120 EC-C18柱(4 μm,Φ4.6×100 mm,美国)、YMC-Pack ODS-A柱(5.0 μm,Φ10×250 mm,AA12S05-2510WT)和XbridgeTMC18柱(5 μm,Φ4.6×150 mm,爱尔兰),用于化合物的半制备。
实验常用试剂如甲醇、二氯甲烷、石油醚、乙酸乙酯、正丁醇、丙酮、乙醇等均为工业级试剂,需重蒸处理。半制备液相和制备液相所用有机试剂为色谱纯甲醇和乙腈。核磁所用氘代试剂为美国CIL公司生产。丁酰胆碱酯酶抑制实验的仪器及试剂均由中国科学院昆明植物研究所天然药物活性筛选中心提供。
显色剂:碘粉、10%浓硫酸-乙醇溶液、碘化铋钾显色剂。
1.2 实验样品
研究材料为白刺花(S.davidii)花蕾,于2017年3月采自云南省昆明市富明县烂泥湾村。由中国科学院昆明植物研究所张宇工程师鉴定。凭证标本(No.EB012017001)保存于中国科学院昆明植物研究所资源植物与生物技术重点实验室。
2 实验方法
2.1 提取和分离
将白刺花花蕾(7.4 kg)干燥粉碎,在60 °C下用90%乙醇超声提取1小时,在45 °C下蒸干,得到1.7 kg粗提物浸膏。将其与水混合制成混悬液(2 L)并用石油醚萃取,然后用5% HCl将剩余的水层调节至pH2.0~3.0,用乙酸乙酯萃取后,将剩余的水层用10% NaOH碱化至pH9.0~10.0,并用二氯甲烷彻底萃取。将二氯甲烷萃取部位浸膏(64.0 g)用二氯甲烷-甲醇,100∶0,50∶1→0∶100梯度洗脱,最终得到6个部份(A~F)。将B(9.6 g)在反相硅胶柱上进行色谱分离,并用甲醇-水,10∶90→100∶0梯度洗脱,得到4个部分(B1~B6)。将B2(4.3 g)在硅胶柱上分离,用二氯甲烷-甲醇,100∶1洗脱,最终得到5个部分(B2-1~B2-5)。将B2-1(3.1 g),B2-2(0.6 g)和B2-4(0.5 g)在Sephadex LH-20柱(甲醇)上进行色谱分离,分别得到5、8和4个部分。B2-1-2(55.1 mg)通过半制备型HPLC柱(XBridge,C18,4.6×150 mm,MeOH-H2O = 43∶57,1 mL/min,波长210 nm)纯化得到12(27.9 mg,tR=5.627 min)和7(7.6 mg,tR=11.967 min),B2-1-4(89.4 mg)通过半制备型HPLC柱(Agilent,C18,9.4×250 mm,MeCN-H2O = 35∶65,2 mL/min,波长210 nm)得到2(7.8 mg,tR=17.204 min)和5(78.4 mg,tR=32.124 min),B2-4-2(409.6 mg)通过半制备型HPLC柱(YMC-ODS-A,10×250 mm,MeOH-H2O = 30∶70,2 mL/min,波长203 nm)得到3(3.8 mg,tR=22.686 min),4(3.7 mg,tR=25.296 min),8(68.7 mg,tR=31.963 min)和6(62.7 mg,tR=42.500 min)。将C(0.6 g)在反相硅胶柱上进行色谱分离,并用甲醇-水,10∶90→100∶0梯度洗脱,得到4个部分(C1~C4)。将C1(0.17 g)、C3(0.13 g)和C4(0.09 g)在Sephadex LH-20色谱柱(甲醇)上进行色谱分离,分别得到3、6和3个部分。C3-2(89.0 mg)通过半制备型HPLC柱(YMC-ODS-A,10×250 mm,MeOH-H2O=25∶75,2 mL/min,波长210 nm)得到1(7.1 mg,tR=35.936 min),14(2.0 mg,tR= 22.686 min)和15(3.1 mg,tR=54.401 min)。将D(21.8 g)在反相硅胶柱上进行色谱分离,并用甲醇-水,10∶90→100∶0梯度洗脱,得到4个部分(D1~D6)。D1-3-2(154.5 mg)通过半制备HPLC柱(YMC-ODS-A,10×250 mm,MeOH-H2O = 25∶75,2 mL/min,波长为203 nm)得到13(24.1 mg,tR=40.902 min)。将E(3.3 g)在反相硅胶柱上进行色谱分离,并用甲醇-水,10∶90→100∶0梯度洗脱,得到4个部分(E1~E4)。E2-3(256.7 mg)通过HPLC柱纯化(EC-C18,4.6×100 mm,MeOH-H2O = 27∶73,1 mL/min,波长203 nm)得到10(27.8 mg,tR=8.506 min),9(25.4 mg,tR=14.013 min)和11(10.5 mg,tR=19.521 min)。E3-1-2(46.8 mg)通过HPLC柱(EC-C18,4.6×100 mm,MeOH-H2O = 30∶70,1 mL/min,波长210 nm)得到16(7.6 mg,tR=26.193 min)。
2.2 体外丁酰胆碱酯酶抑制活性实验
用磷酸盐缓冲液(每100 mL磷酸盐缓冲液中含0.1 M Na2HPO4溶液 94.7 mL;0.1 M NaH2PO4溶液 5.3 mL,调pH至8.0)将丁酰胆碱酯酶稀释成0.04 U/mL;接着碘化硫代丁酰胆碱和DTNB用磷酸盐缓冲液配成6.25 mM的溶液(工作液);接着化合物用DMSO稀释成1 mM工作液,保证不同浓度的化合物溶液中DMSO浓度相同(均为2%),DMSO在最终反应体系中的终浓度为0.1%,化合物终浓度为50 μM。阳性对照为他克林,终浓度为0.333 μM;阴性对照组(NC组)为2% DMSO溶剂对照。反应在96孔板中进行,向96孔板中依次加入pH为8.0的磷酸缓冲液、2% DMSO、他克林溶液、样品溶液和丁酰胆碱酯酶(加入试剂的体积为一个反应的体积),每个样品做3个重复。加入显色剂和底物后1小时内,每30秒钟检测一次405 nm吸光值。选择NC组吸光值平均值约为1 h的样品吸光值,计算化合物吸光值平均值(化合物测定值-背景值),并按照(NC-化合物吸光值平均值)/NC×100%来计算化合物丁酰胆碱酯酶抑制率。
2.3 新化合物1的ECD计算方法
化合物经构象搜索后,最优构象用gaussian16的b3lyp/6-311+g(d,2p)基组进行构象优化,确定无虚频后,得到的构象用gaussian16的cam-b3lyp/tzvp基组进行ECD图谱计算[11]。
3 实验结果
3.1 化合物的结构鉴定
从白刺花花蕾二氯甲烷萃取部位分离得到16个化合物(图1),其中化合物1为一个新的生物碱。根据化合物1的13C NMR数据(表1),以及高分辨电喷雾电离质谱(HR-ESI-MS)显示出[M + Na]+峰m/z303.167 8[M + Na]+(calcd for C15H24N2NaO3,303.167 9),推测其分子式为C15H24N2O3。其NMR数据(表1)显示,该化合物存在一个羰基(δC171.8)、8个亚甲基和6个次甲基。对比化合物1和苦参碱(7)及其羟基取代物(8与9)NMR数据[12-14],推测化合物1是苦参碱的二羟基取代物。通过在该化合物COSY波谱中观察到的相关(图2),可以得到除C-15以外的所有碳原子的连接。通过HMBC相关(图2),如从H2-2到C-4和C-6,H2-10到C-6和C-8,H2-17到C-6、C-11和C-15,H2-12到C-14,以及H2-13到C-15的相关,再结合COSY片段,可以推断出化合物具有9,14-二羟基苦参碱的平面结构。其相对构型通过ROESY相关(图2)和氢原子之间的偶合常数来判断。假定H-14取向为α,从H-14/H-12α,H-12β/H-9,H-9/H-11,以及H-11/H-17β等的相关中,可以推断H-9和H-11为β取向,9-OH为α取向。因为H-9跟H-10α的偶合常数(J9,10α= 10.4 Hz)比较大,所以推测H-9和H-10α具有反式二直立键关系;同理,H-17β和H-5(J5,17β= 13.0 Hz)也具有反式二直立键关系,从而得出了H-10α和H-5均为α取向。在化合物1的ROESY谱中,H-10α跟H-6有相关,说明H-6为α取向;H-5和H-7有相关,说明H-7为α取向。这样,就建立起化合物1的相对构型,如图2所示。而该化合物实验的电子圆二色谱(electronic circular dichroism,ECD)跟理论计算的(5S,6S,7R,9S,11R,14S)-1的ECD图谱基本吻合(图3),因此确定了化合物1的绝对构型。化合物1的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。

图1 白刺花中化合物1~16的化学结构

化合物2白色针晶(CHCl3);ESI-MS:m/z267[M + Na]+;1H NMR(500 MHz,CDCl3)δ:7.28(1H,dd,J= 8.9,7.3 Hz,H-13),6.44(1H,dd,J= 9.0,1.1 Hz,H-14),6.22(1H,d,J= 7.2 Hz,H-12),4.18(1H,dd,J= 15.1,6.9 Hz,H-17),3.81(1H,dd,J= 15.0,12.4 Hz,H-17),2.89~1.44(15H,m);13C NMR(125 MHz,CDCl3)δ:164.1(C-15),148.1(C-11),138.4(C-13),116.5(C-14),103.3(C-12),60.5(C-6),56.8(C-2),56.6(C-10),43.6(C-17),38.5(C-7),32.1(C-5),28.1(C-8),27.0(C-4),21.2(C-9),20.4(C-3)。以上数据与文献[15,16]报道对照基本一致,故鉴定该化合物为槐胺碱。
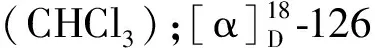

图2 化合物1关键的2D NMR相关
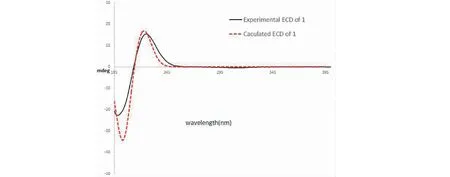
图3 化合物1实验和计算的ECD图谱

表1 化合物1的核磁共振氢谱和碳谱数据(600和150 MHz,δ in ppm,J in Hz)
化合物4无色晶体(CHCl3);ESI-MS:m/z283[M + Na]+;1H NMR(500 MHz,CDCl3)δ:7.32(1H,dd,J= 9.0,7.1 Hz,H-13),6.52(1H,dd,J= 9.0,1.1 Hz,H-12),6.45(1H,dd,J= 7.1,1.1 Hz,H-14),4.16(1H,dd,J= 15.2,7.2 Hz,H-17β),3.77(1H,dd,J= 15.2,12.3 Hz,H-17α);13C NMR(125 MHz,CDCl3)δ:163.7(C-15),148.1(C-11),138.5(C-13),118.9(C-14),103.2(C-12),69.6(C-7),66.3(C-6),56.5(C-2),56.1(C-10),43.7(C-17),37.3(C-8),26.5(C-4),25.8(C-5),22.3(C-9),20.1(C-3)。以上数据与文献[17]报道对照基本一致,故鉴定该化合物为7α-羟基槐胺碱。
化合物5无色菱形晶体(CHCl3);ESI-MS:m/z269[M + Na]+;1H NMR(500 MHz,CDCl3)δ:6.57~6.29(1H,m,H-13),5.86(1H,dt,J= 9.8,1.9 Hz,H-14),4.10(1H,dd,J= 13.0,4.7 Hz,H-17α),3.95(1H,dd,J= 16.9,9.7 Hz,H-11),3.14(1H,t,J= 12.8 Hz,H-17β),2.81(1H,d,J= 11.2 Hz,H-2β),2.76(1H,d,J= 11.2 Hz,H-10β),2.63~2.51(1H,m,H-6),2.23~2.12(1H,m),2.08(1H,s),1.36~1.93(12H,m);13C NMR(125 MHz,CDCl3)δ:165.7(C-15),137.5(C-13),124.6(C-14),63.5(C-6),57.3(C-10),57.2(C-2),51.4(C-11),42.0(C-17),41.5(C-7),34.6(C-5),27.7(C-4),27.4(C-12),26.6(C-8),21.1(C-3),20.7(C-9)。以上数据与文献[12]报道对照基本一致,故鉴定该化合物为槐果碱。



化合物9白色结晶(CHCl3);ESI-MS:m/z287[M + Na]+;1H NMR(500 MHz,CDCl3)δ:4.31(1H,dd,J= 12.8,4.3 Hz,H-17),4.18(1H,d,J= 3.6 Hz,H-13),4.01(1H,td,J= 9.8,5.7 Hz,H-11),3.06(1H,t,J= 12.7 Hz,H-17),2.80(1H,d,J= 11.2 Hz,H-2),2.75(1H,d,J= 11.4 Hz,H-10),2.55~2.41(1H,m,H-14),2.14(1H,td,J= 11.4,5.3 Hz,H-6),2.08(1H,s,H-12),2.00~1.81(3H,m,H-2,H-8,H-10),1.76~1.57(4H,m,H-3,H-4,H-5,H-9),1.57~1.24(6H,m,H-3,H-4,H-7,H-8,H-9,H-12);13C NMR(125 MHz,CDCl3)δ:167.9(C-15),63.6(C-6),62.3(C-13),57.2(C-2),57.1(C-10),49.6(C-11),43.0(C-7),41.3(C-17),40.5(C-14),35.3(C-5),33.4(C-12),27.7(C-4),26.5(C-8),21.1(C-9),20.6(C-3)。以上数据与文献[14]报道对照基本一致,并根据NMR一维和二维数据及质谱数据,故鉴定该化合物为13α-羟基苦参碱,即苦丁碱。
化合物10无色固体;ESI-MS:m/z285[M + Na]+;1H NMR(500 MHz,CDCl3)δ:4.26(1H,d,J= 11.3 Hz,H-17),3.73~3.59(1H,m,H-9),3.16~3.01(2H,m,H-10,H-17),2.86~2.77(1H,m,H-8),2.73(1H,d,J= 10.1 Hz,H-2),2.68~2.58(1H,m,H-12),2.50~2.37(1H,m,H-14),2.33~2.12(3H,m,H-6,H-10,H-12),2.11~1.97(1H,m,H-2),1.97~1.75(4H,m,H-4,H-5,H-8,H-13),1.78~1.64(3H,m,H-3,H-4,H-13),1.54~1.38(1H,m,H-3);13C NMR(125 MHz,CDCl3)δ:168.8(C-15),130.3(C-11),111.8(C-7),67.3(C-9),64.2(C-10),60.7(C-6),55.3(C-2),40.8(C-17),38.6(C-8),32.7(C-14),31.9(C-5),26.8(C-4),24.7(C-12),21.6(C-3),19.5(C-13)。以上数据与文献[19]报道对照基本一致,故鉴定该化合物为9α-羟基-7,11-脱氢苦参碱。
化合物11白色针晶(CHCl3);ESI-MS:m/z271[M + Na]+;1H NMR(500 MHz,CDCl3)δ:3.41(1H,dd,J= 13.4,5.5 Hz,H-17),3.33(1H,ddd,J= 10.3,7.5,5.4 Hz,H-11),3.29~3.20(1H,m,H-17),2.88~2.79(1H,m,H-2a),2.75(1H,ddd,J= 11.8,8.9,4.4 Hz,H-10a),2.45~2.24(3H,m,H-6,H2-14),2.23~2.07(2H,m,H-2b,H-10b),1.94~1.85(2H,m,H-3a,H-5),0.97~1.85(12H,m);13C NMR(125 MHz,CDCl3)δ:170.0(C-15),63.3(C-6),55.9(C-2),55.7(C-11),50.3(C-10),47.6(C-17),40.9(C-7),32.5(C-14),30.8(C-5),30.2(C-12),28.1(C-4),23.7(C-3),21.7(C-8),21.5(C-9),18.9(C-13)。以上数据与文献[16,20]报道对照基本一致,故鉴定该化合物为槐定碱。


化合物14白色粉末;ESI-MS:m/z353[M + Na]+;1H NMR(600 MHz,CDCl3)δ:6.91(2H,m,H-2,H-6),6.85(1H,d,J= 8.5 Hz,H-5),4.86(1H,d,J= 11.5 Hz,H-7a),4.57(1H,d,J= 11.5 Hz,H-7b),4.43(1H,d,J= 7.8 Hz,H-1′),3.95(1H,dd,J= 11.7,3.7 Hz,H-6′a),3.90(3H,s,OMe),3.89(3H,s,OMe),3.85(1H,dd,J= 11.8,4.8 Hz,H-6′b);13C NMR(150 MHz,CDCl3)δ:149.3(C-3),149.2(C-4),129.2(C-1),121.0(C-6),111.6(C-5),111.0(C-2),101.5(C-1′),76.3(C-3′),75.3(C-5′),73.8(C-2′),71.6(C-7),70.7(C-4′),62.6(C-6′),56.0(OMe),56.0(OMe)。以上数据与文献[23]报道对照基本一致,故鉴定该化合物为3,4-二甲氧基苯甲醇7-O-β-D-吡喃葡萄糖苷。
化合物15无色胶状体;ESI-MS:m/z307[M + Na]+;1H NMR(600 MHz,CDCl3)δ:7.30~7.24(5H,m,H-2,H-3,H-4,H-5,H-6),4.30(1H,d,J= 7.6 Hz,H-1′),4.12(2H,m,H-2"),3.95(1H,dd,J= 11.7,5.1 Hz,H-6′a);13C NMR(150 MHz,CDCl3)δ:138.3(C-1),128.9(C-3,C-5),128.5(C-2,C-6),126.5(C-4),102.8(C-1′),76.2(C-3′),75.4(C-5′),73.7(C-2′),70.9(C-2"),70.2(C-4′),62.1(C-6′),36.1(C-1")。以上数据与文献[24]报道对照基本一致,故鉴定该化合物为2-苯乙基-O-β-D-吡喃葡萄糖苷。
化合物16白色粉末;ESI-MS:m/z603[M + Na]+;1H NMR(800 MHz,CD3OD)δ:6.72(2H,s,H-2′,H-6′),6.65(2H,s,H-2,H-6),4.77(1H,d,J= 4.3 Hz,H-7′),4.72(1H,d,J= 4.5 Hz,H-7),4.34~4.24(2H,m,H-9a,H-9′a),3.96~3.88(2H,m,H-9b,H-9′b),3.86(6H,s,3-OMe,5-OMe),3.84(6H,s,3′-OMe,5′-OMe),3.77(1H,dd,J= 12.0,2.3 Hz,glc-6a),3.66(1H,dd,J= 12.0,5.2 Hz,glc-6b),3.60~3.53(1H,m,glc-2),3.53~3.44(1H,m,glc-5),3.44~3.36(1H,m,glc-4),3.26~3.08(3H,m,glc-3,H-8,H-8′);13C NMR(200 MHz,CD3OD)δ:154.4(C-3′,C-5′),149.4(C-3,C-5),139.6(C-1′),136.2(C-4),135.6(C-4′),133.1(C-1),105.3(glc-1),104.8(C-2,C-6),104.5(C-2′,C-6′),87.6(C-7′),87.2(C-7),78.4(glc-3),77.8(glc-5),75.7(glc-2),72.9(C-9′),72.9(C-9),71.3(glc-4),62.6(glc-6),57.1(3′-OMe,5′-OMe),56.8(3-OMe,5-OMe),55.7(C-8),55.5(C-8′)。以上数据与文献[25]报道对照基本一致,故鉴定该化合物为丁香脂素-4′-O-β-D-吡喃葡萄糖苷。
3.2 体外丁酰胆碱酯酶抑制实验结果
对白刺花花蕾二氯甲烷萃取部位和从该萃取部位分离得到的16个单体化合物进行了体外丁酰胆碱酯酶抑制活性测试,结果表明二氯甲烷萃取部位(浓度20 μg/mL)及苦参碱(浓度50 μM)具有一定的抑制丁酰胆碱酯酶活性,抑制率分别为31%和35%。其他化合物活性较低。

表2 白刺花二氯甲烷萃取部位及其化合物对丁酰胆碱酯酶的抑制活性
注:*阳性对照。
Note:*Positive control.
4 讨论与结论
本研究从白刺花花蕾二氯甲烷萃取部位分离鉴定了16个单体化合物,其中包括11个苦参碱型生物碱(1~11)、2个鹰爪豆碱型生物碱(12和13)、2个黄酮类化合物(14和15)及1个木脂素类化合物(16),包括1个新化合物1。其中,化合物1、3、4、10、13~16,共8个化合物首次从白刺花中获得。化合物8、9和12,共3个化合物首次从白刺花的花部位获得。
本研究共分离得到11个苦参碱型生物碱和2个鹰爪豆碱型生物碱,总碱成分及苦参碱(7)对丁酰胆碱酯酶具有一定的抑制活性,有潜力成为治疗阿尔兹海默症等神经退行性疾病的新型药物资源。研究丰富了白刺花花部位的化学成分,解析了民间食用喜好背后的物质基础,为其药物研发提供了科学依据。
