let-7a通过抑制MAP4K3/MKK4/JNK信号通路减少脑出血大鼠神经元调亡*
2020-07-06高绚照王守春
杨 慧,万 广,高绚照,柳 毅,王守春
(1新乡市中心医院神经内科,2新乡医学院第一附属医院骨科,河南新乡453100;3吉林大学第一医院,吉林长春130000)
脑出血(intracerebral hemorrhage,ICH)是脑实质内血管破裂引起的出血,可导致原发性和继发性损伤,是脑卒中最危险的亚型之一。在ICH发生发展过程中,神经元凋亡、星形胶质细胞增殖和少突胶质细胞死亡可引起离子稳态紊乱、水肿、出血、兴奋性毒性、氧化应激和内质网应激等自毁性病理变化,最终导致残疾,甚至死亡[1]。
微小RNA(microRNA,miRNA,miR)通过对靶基因的调控在细胞分化、增殖、凋亡等各种细胞过程中具有重要作用,其独特的表达谱在调节血管疾病中具有重要作用[2]。在细胞中,miRNA控制程序性死亡(凋亡和自噬);在大脑中,miRNA控制神经元分化和凋亡,如miR-125b、miR-132和miR-128参与调控神经元分化[3];miR-365和miR-146a、miR-196b等参与神经元凋亡通路调控。在哺乳动物中,miRNA let-7a参与细胞的分化和凋亡,具有抗增殖作用[4]。在神经干细胞中,let-7a在分化过程中高表达[5],失活可以阻止生长因子缺失的神经元细胞死亡。吴美华等[2]研究发现,在ICH引起的脑水肿中,let-7a下调了0.5倍。在此基础上,本研究将研究let-7a对ICH后神经元凋亡的作用及分子机制,旨在为ICH治疗寻找新的靶点和信号通路。
材料和方法
1 动物
48只健康Sprague-Dawley(SD)大鼠取自新乡市中心医院动物中心,许可证号为SYXK(川)2019-218,体重250~280 g。在温度(25±1)℃、湿度60%的SPF环境下饲养,自由摄食、饮水,昼夜节律12 h。
2 主要试剂和仪器
2.1 实验试剂 let-7a激动剂(agomir)、阴性对照(negative control,NC)agomir、let-7a拮 抗 剂(antagomir)、NC antagomir、let-7a模拟物(mimic)和 NC mimic由百奥迈科生物技术有限公司提供;Ⅶ型胶原酶、LipofectamineTM2000和PVDF膜购自Invitrogen;DMEM培养基(Yaji,PM150210);牛血清白蛋白(bovine serum albumin,BSA;PC0001)、20× TBS(T1080)和HE染色试剂盒(G1120)均购自Solarbio;甲醛(SSBT,SS24273);PBS(联迈生物,LM0221 A);microRNA荧光定量PCR试剂盒(KALANG,KL190);蛋白酶K溶液(源叶,R21066);二甲苯(古朵,GD-RY1215-12);TRIzol LS试剂(Invitrogen,10296010);2× SYBR Green qPCR Master Mix(Labio,LBS201);水合氯醛(经科,JKLN006718);TdT酶缓冲液(JR01891)和TdT酶反应液(JR01888)均购自上海君瑞;Dual-Luciferase Reporter Assay System(Promega,E1910);抗 phospho-SAPK/JNK(Thr183/Tyr185)抗体(9255)、抗丝裂原活化的蛋白激酶激酶激酶激酶3(mitogen-activated protein kinase kinase kinase kinase 3,MAP4K3)抗体(92427)、抗 phospho-SEK1/MKK4(Ser257)抗体(514)、抗胶质细胞原纤维酸性蛋白(Glial fibrillary acidic protein,GFAP)抗体(80788)、抗 cleaved PARP(Asp214)抗体(5625)和cleaved caspase-3(Asp175)抗体(9661)均购自Cell Signaling Technology)。HEK293T细胞(ATCC,CMH010)。
2.2 实验仪器 净化工作台(Boxun,SW-CJ-2FD);生物显微镜(OLYMPUS,BX43);恒温培养箱(DAIHAN,WIG-105);PCR扩增仪(ABI,7900型);倒置荧光显微镜(Nikon,Ti2系列)。
3 主要方法
3.1 ICH建模 随机选取40只SD大鼠注射10%水合氯醛麻醉,置于俯卧位,固定于立体定向架上。用牙钻(颅骨前0.2 mm、中线靠右3 mm)钻出一个1 mm的小孔,微量进样器缓慢垂直进针5.6mm,定位于近内囊的苍白球内。将2 μLⅦ型胶原酶(0.5 UⅦ型胶原酶用2 μL生理盐水稀释)以0.4 μL/min的速度注入,留针5min后缓慢拔出,ICH模型构建成功。剩余8只SD大鼠作为假手术(sham)组。
3.2 分组及处理 将造模后的ICH大鼠随机分为5组:model组、let-7a agomir组、NC agomir组、let-7a antagomir和NC antagomir组,每组8只。在侧脑室钻一个1 mm的毛刺孔(颅骨后0.8 mm,中线右侧1.5 mm,4.5 mm 深的位置),将 10 μmol/L的 let-7a agomir、NC agomir、let-7a antagomir和NC antagomir以0.5 μL/min的速度各注射5μL。造模7 d后,由3名不知情观察人员对所有大鼠的神经功能进行评分。评分标准由运动、感觉、反射和平衡测试组成,参照Zea-Longa的分级标准进行评分。计算平均值和标准差。实验过程中各组均无动物死亡。
3.3 细胞的培养和转染 将HEK293T细胞培养在含有10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM中,置于37℃、5%CO2的恒温培养箱中进行培养。根据LipofectamineTM2000说明书,转染前将细胞以每孔5×105细胞的密度接种于6孔板,孵育过夜。将let-7a mimic或NC mimic转染到HEK293T细胞,培养24 h后进行后续实验。
3.4 HE染色观察病理损伤 取大鼠血肿周围脑组织,制作为10 μm厚的切片,每个实验组选取5个切片,进行HE染色分析。根据HE染色试剂盒说明书进行染色。首先固定切片,冲洗,并用苏木精和伊红染色。切片在梯度乙醇下逐渐脱水,充分干燥,用中性树脂密封,最后在光学显微镜下观察。
3.5 RT-qPCR检测相关RNA相对表达水平 将脑组织在液氮中研磨成粉末,100 mg组织加入1 mL TRIzol LS提取总RNA。使用TRIzol LS试剂提取星形胶质细胞中的总RNA。用分光光度计测定RNA浓度和纯度。将逆转录反应产物与2×SYBR Green Master Mix(Labio)结合,使用ABI 7900型PCR扩增仪扩增,反应体系为10 μL。PCR条件为:95℃10 min;95℃ 15 s,60℃ 1 min,40个循环。循环阈值(cycle threshold,Ct)>38被定义为无法检测。使用2-ΔΔCt法计算试验组和对照组样品之间的相对倍数变化。每组重复3次。GFAP的上游引物序列为5'-CTCAATGCTGGCTTCAAGGAGA-3',下游引物序列为5'-GACGCAGCGTCTGTGAGGTC-3';let-7a的上游引物序列为5'-AGGATCCAAAGGTGGTGGTAAGAGGGTGAT-3',下游引物序列为5'-AGTCGACATAAGACAAGAAGCAAAAGGTTT-3';MAP4K3的上游引物序列为5'-GCAAAGCCATCCCAAGTT-3',下游引物序列为5'-GTGCCTCTATGTTCATTCTGTT-3';内参照U6的上游引物序列为5'-GCTTCGGCAGCACATATACTAAAAT-3',下游引物序列为5'-CGCTTCACGAATTTGCGTGTCAT-3'。
3.6 Western blot检测相关蛋白的水平 提取各组脑组织蛋白质,用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白,然后转移到聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上。在室温下用5%BSA在TBS中封膜1 h。用I抗[GFAP(1∶1 000)、MAP4K3(1∶1 000)、JNK(1∶2 000)、MKK4(1∶1 000)、cleaved caspase-3(1∶1 000)、cleaved PARP(1∶1 000)和 GAPDH(1∶1 200)]在 TBST(TBS中含 0.1%Tween-20)中与PVDF膜4℃培养过夜,然后在室温下与相应II抗孵育2 h。提取40 μg蛋白质用化学发光法进行检测。GAPDH为内参照。最后用蛋白图像处理软件和Quantity One软件分别扫描X胶片和条带灰度。本实验重复3次。
3.7 TUNEL染色检测神经元凋亡情况 断颈处死大鼠,取神经组织制作为10 μm厚的切片,每个实验组选取5个切片,进行TUNEL染色分析。将切片置于染色缸中,用二甲苯洗涤2次,每次5 min;无水乙醇洗涤2次,每次3 min;95%乙醇和75%乙醇3 min各洗1次;用PBS洗涤2次,每次5 min。加入蛋白酶K溶液(20 mg/L)水解20 min,去除蛋白。蒸馏水洗4次。色缸中加入含有2%过氧化氢的PBS,反应15 min;PBS洗涤2次,每次5 min。用滤纸吸去切片上多余液体,添加2滴TdT酶缓冲液放置3 min;用滤纸吸去多余液体,立即添加50~80 μL的TdT酶反应液,37℃孵育1 h;PBS洗涤3次,每次5 min。加入转化剂-POD孵育25 min;PBS洗涤4次,每次5 min。加入5%DBA底物溶液,显色5~10 min;蒸馏水洗涤4次,每次1 min。甲基绿复染10 min,蒸馏水洗涤3次,正丁醇洗涤3次,最后用二甲苯脱水3次,每次2 min。中性树胶封片,在光学显微镜下观察结果。采用ImageJ软件来统计每张图片上的细胞总数(包括凋亡和未凋亡的细胞)和呈现棕黄色的凋亡细胞数。细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。
3.8 let-7a与MAP4K3的靶向关系 使用生物信息学软件TargetScan对let-7a和MAP4K3的靶向关系进行预测和分析,并用Dual-Luciferase Reporter Assay System检测萤光素酶活性,进一步验证靶向关系。用PCR扩增含有let-7a结合位点的MAP4K3基因的3'UTR序列。将MAP4K3的3'UTR克隆到pMIR-REPORT萤光素酶载体中,成为pMIR-MAP4K3-WT。通过PCR扩增MAP4K3 3'UTR结合位点的突变,同样克隆到pMIR-REPORT载体中,成为pMIRMAP4K3-MUT。根据LipofectamineTM2000说明书将let-7a mimic/NC mimic和pMIR-MAP4K3-WT/pMIRMAP4K3-MUT共转染到HEK293T细胞中。转染48 h后,用PBS清洗细胞2次,在每孔细胞中加入100 μL裂解缓冲液(Passive Lysis Buffer,PLB),室温下震荡15 min,收集细胞裂解液。取20 μL PLB加入发光板中,用GloMax生物发光检测仪读取背景值;每个样本加入100 μL LAR II工作液,快速混匀、读值;每个样本再加入 100 μL Stop&Glo Reagent,快速混匀后,放入发光板中检测、读值。每个样本重复3次。
4 统计学处理
用SPSS 22.0进行统计学分析,实验数据用均数±标准差(mean±SD)表示。采用单因素方差分析后,再用SNK-q检验进行各组均数间的两两比较,以P<0.05为差异具有统计学意义。
结 果
1 let-7a过表达降低了神经功能评分
利用神经功能评分和HE染色观察病理损伤。结果显示,let-7a agomir组的神经功能评分较模型组和 NC agomir组显著降低(P<0.05),而 let-7a antagomir组的评分则明显高于模型组和NC antagomir组(P<0.05),见图1A。RT-qPCR检测大鼠血肿周围脑组织let-7a表达水平显示,let-7a agomir组中let-7a表达水平比模型组和NC agomir组增加了数倍(P<0.01),而let-7a antagomir组相比模型组和NC antagomir组let-7a表达水平明显降低(P<0.05),见图1B。从HE染色可以看出,与模型组和NC agomir组相比,let-7a agomir组的病理损伤最轻,而与模型组和NC antagomir组相比,let-7a antagomir组的病理损伤最严重。上述结果表明,let-7a过表达降低了神经功能评分,减轻了脑组织病理损伤。

Figure 1.Protective effect of let-7a over-expression on the rat brain tissues.A:the neurological function score;B:the expression of let-7a was detected by RT-qPCR;C:the brain injury observed by HE staining.Mean±SD.n=8.*P<0.05,**P<0.01 vs model group.图1 let-7a过表达对大鼠脑组织的保护作用
2 let-7a过表达降低了GFAP表达水平
由于星形胶质细胞活化是引起ICH的重要原因之一。因此,本研究利用RT-qPCR和Western blot检测星形胶质细胞活化标志物GFAP的表达水平,以判断ICH后的继发性损伤。结果显示,与模型组和NC agomir组相比,let-7a agomir组的GFAP表达水平显著降低(P<0.05),而let-7a antagomir组却明显高于模型组和NC antagomir组(P<0.05),见图2。这说明let-7a过表达降低了GFAP的表达水平。
3 let-7a过表达减少神经元凋亡
利用TUNEL染色检测各组神经元凋亡情况;RT-qPCR和Western blot检测let-7a表达水平对ICH后cleaved caspase-3和cleaved PARP蛋白水平的影响。结果显示,let-7a antagomir组TUNEL阳性细胞数明显增加(P<0.05);而let-7a agomir组正好相反,阳性细胞数明显减少(P<0.05),见图3A。let-7a antagomir组cleaved caspase-3和cleaved PARP的蛋白水平明显高于模型组和NC antagomir组(P<0.05),而let-7a agomir组cleaved caspase-3和cleaved PARP的蛋白水平明显低于模型组和NC agomir组(P<0.05),见图3B。这些结果表明,let-7a过表达可以减少神经元凋亡,使cleaved caspase-3和cleaved PARP的蛋白水平下调。
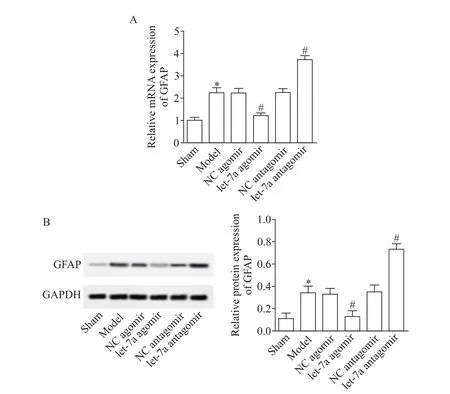
Figure 2.let-7a over-expression reduced GFAP expression.A:GFAP mRNA expression level was detected by RT-qPCR;B:GFAP protein expression level was detected by western blot.Mean±SD.n=8.*P<0.05 vs model group.图2 let-7a过表达降低了GFAP的表达水平
4 let-7a和MAP4K3的靶向关系
通过生物信息学软件TargetScan对let-7a和MAP4K3的靶向关系进行预测和分析,结果显示,MAP4K3 3’-UTR的1056~1068 bp区域存在has-let-7a-5p的潜在结合位点,说明MAP4K3是let-7a的靶基因之一,见图4A。将let-7a mimic和NC mimic转染到HEK293T细胞,RT-qPCR检测显示,let-7a组中let-7a的表达显著升高(P<0.01),MAP4K3的表达显著降低(P<0.05),说明let-7a过表达抑制了MAP4K3的表达,见图4B。利用双萤光素酶报告基因实验进一步验证let-7a和MAP4K3的靶向关系,结果显示,let-7a mimic组的MAP4K3野生型组萤光素酶活性显著低于突变型组(P<0.05),说明let-7a和MAP4K3之间的靶向关系为负向调控,见图4C。上述实验结果表明,MAP4K3是let-7a的靶基因之一,且两者为负调控。
5 let-7a靶向MAP4K3抑制MKK4/JNK通路的活化
提取脑组织蛋白,利用Western blot检测MAP4K3、MKK4和JNK的表达水平。结果显示,let-7a agomir组中 MAP4K3、p-MKK4/MKK4和 p-JNK/JNK的蛋白水平明显低于对照组和NC agomir组;let-7a antagomir组的相关蛋白水平显著高于对照组和NC antagomir组(P<0.05),见图5。这说明let-7a靶向MAP4K3能够抑制MKK4/JNK通路的活化。
讨 论
miRNA的失调与许多人类疾病有关[6],在大脑中,miRNA参与控制神经元凋亡、程序性细胞死亡过程。let-7a是一种肿瘤抑制miRNA,具有调节炎症小胶质细胞功能[7],表达模式在小鼠、大鼠和人类的神经分化中比较保守[8]。let-7a在蛛网膜下腔出血后的早期脑损伤中具有保护作用[9],可以抑制ICH小鼠促炎细胞因子的表达,减轻脑水肿,改善神经功能[10]。本研究用大鼠ICH模型检测了let-7a的表达水平对大鼠神经功能的影响,结果显示let-7a高表达时,神经功能评分降低,脑组织病理损伤减轻。但let-7a表达水平的调控在ICH发病机制中的作用尚不清楚。

Figure 3.let-7a over-expression reduced neuronal apoptosis and decreased apoptosis-related protein levels.A:the neuronal apoptosis was detected by TUNEL staining;B:the apoptosis-related protein levels were detected by Western blot.Mean±SD.n=8.*P<0.05 vs model group.图3 let-7a过表达减少神经元凋亡并降低凋亡相关蛋白的水平
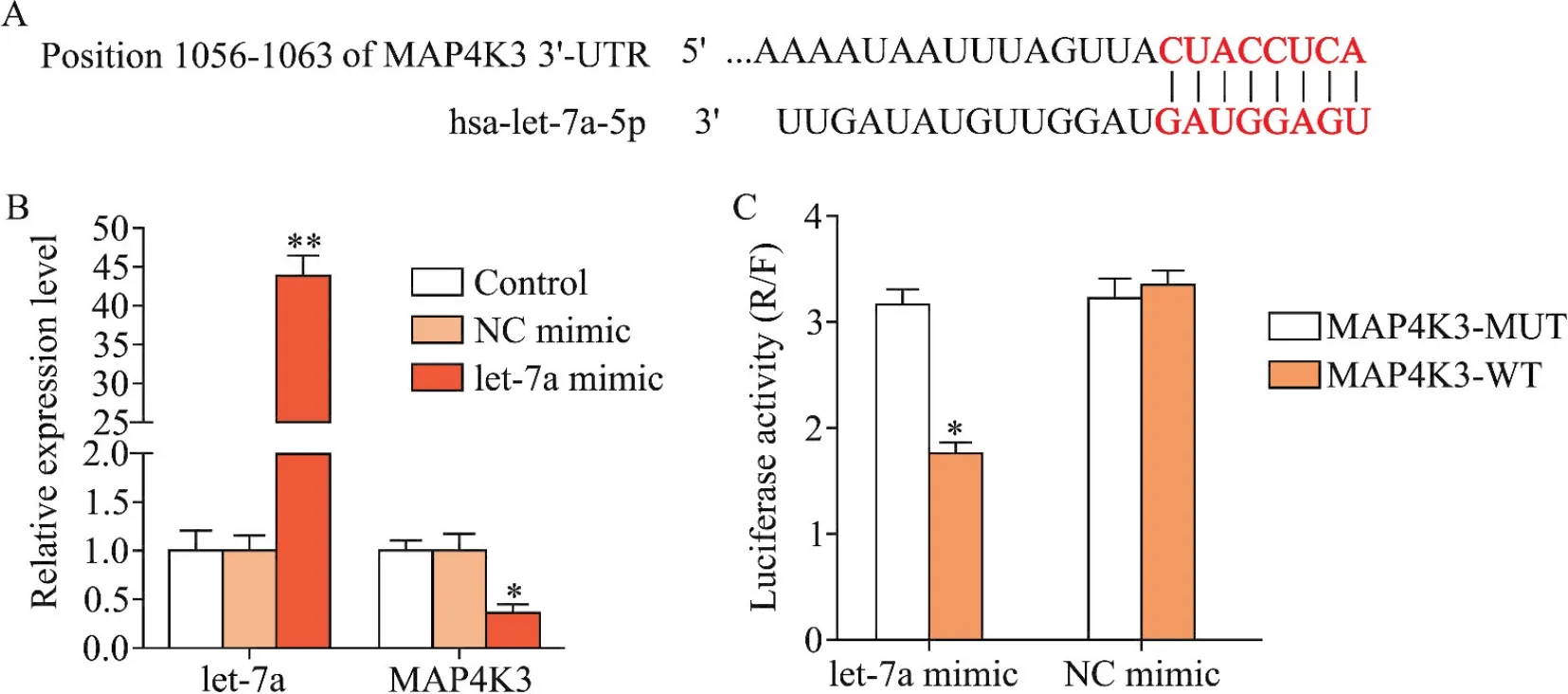
Figure 4.Targeting relationship between let-7a and MAP4K3.A:the target gene of let-7a was predicted by TargetScan;B:the expression levels of let-7a and MAP4K3 were detected by RT-qPCR;C:targeting relationship was detected by dual-luciferase reporter assay.Mean±SD.n=8.*P<0.05,**P<0.01 vs NC mimic group.图4 let-7a和MAP4K3的靶向关系
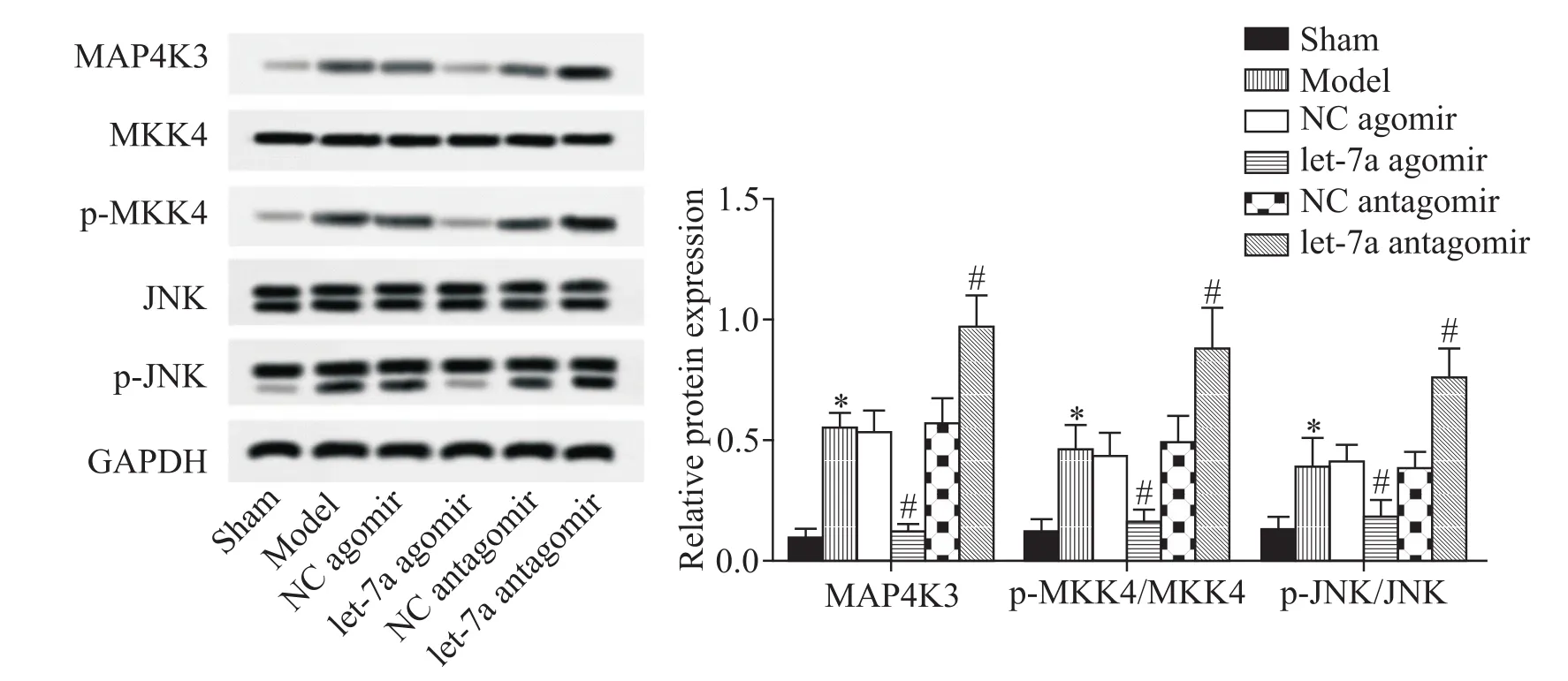
Figure 5.let-7a targeted MAP4K3 to inhibit MKK4/JNK pathway activation.The protein expression levels were detected by Western blot.Mean±SD.n=8.*P<0.05 vs sham group;#P<0.05 vs model group.图5 let-7a靶向MAP4K3抑制MKK4/JNK通路的活化
GFAP是一种Ⅲ型中间丝状蛋白,以单体形式存在,是星形胶质细胞活化的标志物。GFAP在大脑发育、细胞凋亡和疾病中有着重要的作用[11],抑制成熟脑的神经元增殖和神经元突起扩展,形成隔离受损组织的物理屏障,促进血脑屏障[12]。GFAP、cleaved caspase-3和cleaved PARP被认为是脑中不良组织反应的分子标志物和早期指标[13-14],提示凋亡和神经炎症参与延迟血脑屏障和微血管损伤的机制,导致蛋白质改变[15]。因此,本研究利用RT-qPCR和Western blot检测了let-7a表达水平对ICH后GFAP、cleaved caspase-3和cleaved PARP的影响,并用TUNEL染色检测了神经元凋亡情况。结果显示,let-7a过表达降低了GFAP、cleaved caspase-3和cleaved PARP的蛋白水平,TUNEL阳性细胞数也明显减少,这与之前的研究相似[13-15],说明let-7a过表达抑制GFAP、cleaved caspase-3和cleaved PARP的水平,减少神经元凋亡。
MAP4K3属于哺乳动物Ste20样丝氨酸/苏氨酸激酶家族,家族成员有MAP4K1/HPK1、MAP4K2/GCK、MAP4K3/GLK、MAP4K4/HGK、MAP4K5/KHS、MAP4K6/MINK 等[16]。MAP4K3在肝癌中参与肿瘤细胞的存活、凋亡和自噬[17-18];促进胰腺癌[19]、鳞癌[20]和乳腺癌[21]细胞的凋亡,具有抑癌作用。研究发现,MAP4K3在多系统脑萎缩(multiple system atrophy,MSA)中过表达;在黑色素瘤中let-7a通过下调MAP4K3抑制黑色素瘤细胞的生长和侵袭性[22]。但在ICH中没有被提及和研究。因此,本研究利用生物信息学软件对let-7a与MAP4K3的靶向关系进行了预测,进一步用双萤光素酶报告基因实验验证了靶向关系,并将let-7a mimic或NC mimic转染到HEK293T细胞,RT-qPCR检测了MAP4K3和let-7a的表达水平。结果显示,MAP4K3是let-7a的靶基因之一,且两者之间为负调控关系。这与在黑色素瘤中的研究相似[23],说明let-7a通过下调MAP4K3来抑制ICH后神经元的凋亡。
JNK参与哺乳动物细胞的多种生物学功能,包括凋亡和应激反应[26]。MKK4控制细胞生长和衰老[25]。研究发现,MEKK1通过JNK通路抑制ICH后神经元的凋亡[24]。JNK信号通路在甲状腺乳头状癌中被研究[27],但在ICH相关疾病中未被提及或研究。为了解MKK4/JNK信号通路在ICH中的分子机制,本研究利用Western blot检测了脑组织MAP4K3、MKK4和JNK的表达情况。结果显示,let-7a过表达降低了MAP4K3、MKK4和JNK的表达。
综上所述,let-7a通过抑制MAP4K3/MKK4/JNK信号通路减轻ICH大鼠的神经元凋亡。这一结果预示let-7a有望成为新的ICH治疗靶点,但其更为详细的分子机制还有待进一步研究。
