miR-141-3p 表达对人异位子宫内膜细胞增殖与凋亡影响及其机制
2020-07-04刘文博封全灵
刘文博 封全灵
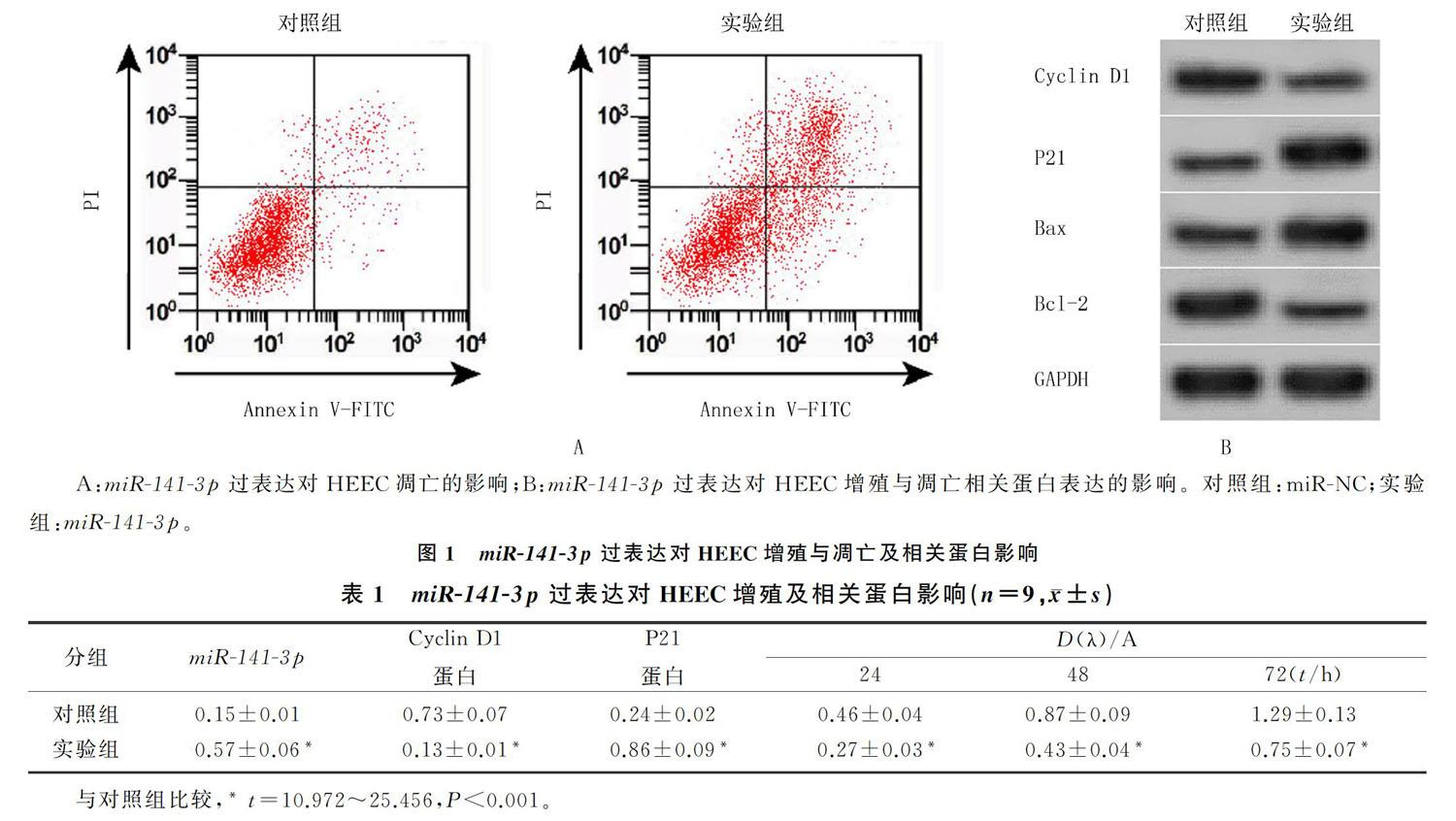
[摘要] 目的 探讨微小RNA-141-3p(miR-141-3p)对人异位子宫内膜细胞(HEEC)增殖和凋亡的影响及其机制。
方法 采用实时荧光定量聚合酶链反应(qRT-PCR)检测异位子宫内膜组织及正常子宫内膜组织中miR-141-3p的表达。体外原代培养HEEC,miR-141-3p mimics转染至HEEC后,采用MTT法检测细胞活力,流式细胞术检测细胞凋亡率。采用双荧光素酶报告实验验证miR-141-3p与高迁移率族蛋白B1(HMGB1)的靶向调控作用。
结果 异位子宫内膜组织中miR-141-3p的表达水平明显低于正常子宫内膜组织(t=56.880,P<0.001);miR-141-3p过表达能显著降低HEEC增殖活力(t=10.972,P<0.001),升高细胞凋亡率(t=18.233,P<0.001);miR-141-3p可靶向结合HMGB1。
结论 miR-141-3p过表达可通过靶向调控HMGB1而抑制HEEC增殖,诱导其凋亡。
[关键词] 子宫内膜异位症;微RNAs;靶基因修复;高迁移率族蛋白质类;细胞增殖;细胞凋亡
[中图分类号] R711.71;R394.3
[文献标志码] A
[文章编号] 2096-5532(2020)03-0342-05
doi:10.11712/jms.2096-5532.2020.56.108
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20200610.1435.007.html;2020-06-11 11:19
EFFECT OF MIR-141-3P EXPRESSION ON THE PROLIFERATION AND APOPTOSIS OF HUMAN ECTOPIC ENDOMETRIAL CELLS AND RELATED MECHANISM
LIU Wenbo, FENG Quanling
(Department of Obstetrics and Gynecology, The Third Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China)
[ABSTRACT]ObjectiveTo investigate the effect of miR-141-3p on the proliferation and apoptosis of human ectopic endometrial cells (HEECs) and related mechanism.
MethodsQuantitative real-time PCR was used to measure the expression of miR-141-3p in ectopic endometrial tissue and normal endometrial tissue. Primary HEECs were cultured in vitro, and after miR-141-3p mimics were transfected into HEECs, MTT assay was used to measure cell viability and flow cytometry was used to mea-
sure apoptosis rate. The dual-luciferase reporter experiment was used to verify the targeted regulatory effect of miR-141-3p and high-mobility group box 1 (HMGB1).
ResultsThe expression level of miR-141-3p in ectopic endometrial tissue was significantly lower than that in normal endometrial tissue (t=56.880,P<0.001). Overexpression of miR-141-3p can significantly reduce the proliferative activity of HEECs (t=10.972,P<0.001) and increase cell apoptosis rate (t=18.233,P<0.001). miR-141-3p could target HMGB1.
ConclusionmiR-141-3p overexpression may inhibit the proliferation of HEECs and induce apoptosis through targeted regulation of HMGB1.
[KEY WORDS]endometriosis; microRNAs; targeted gene repair; high mobility group proteins; cell proliferation; apoptosis
目前關于子宫内膜异位症发病机制尚未完全阐明[1-2]。既往研究已表明,体腔化生、血管转移等均可能引发子宫内膜异位症,而人异位子宫内膜细胞(HEEC)恶性增殖及凋亡能力降低是子宫内膜异位症的主要病理机制[3-4]。因此,深入探究HEEC增殖及凋亡的分子机制有助于提高子宫内膜异位症治疗效果。研究已表明,微小RNA-141(microRNA-141,miR-141)在子宫内膜异位症病人中表达下调,但关于其具体作用机制尚未明确[5-6]。miR-141是微小RNA-141-3p(microRNA-141-3p,miR-141-3p)的前体,关于miR-141-3p对HEEC生物行为的影响及其机制研究相对较少。已有研究表明,子宫内膜异位症病人中高迁移率族蛋白 B1(HMGB1)的表达水平升高,其可能通过调节新生血管生成而参与子宫内膜异位症发生过程[7]。Target Scan网站预测显示,HMGB1可能是miR-141-3p的靶基因,但miR-141-3p是否可通过靶向调控HMGB1而影响HEEC的增殖及凋亡尚未明确。为此,本研究探讨miR-141-3p表达对HEEC增殖及凋亡的影响,分析其与HMGB1的靶向调控关系及其可能作用机制。现将结果报告如下。
1 资料与方法
1.1 一般资料
2016年2月—2018年10月,选取本院收治的45例子宫内膜异位症病人为研究对象,年龄35~60岁,平均(45.52±5.62)岁。临床分期[8]:Ⅱ期10例,Ⅲ期20例,Ⅳ期15例。所有病人均经手术病理证实为子宫内膜异位症,术前3个月内未服用性激素类药物,于术中切取异位内膜组织。同时,选取同期因妇科良性病变进行子宫切除术的43例病人为对照组,年龄为42~60岁,平均(56.72±7.13)岁。所有病人均经手术病理证实,术中切取正常子宫内膜组织。排除合并其他生殖系统肿瘤者。两组病人年龄、月经周期等相比较差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会批准,病人均知情并签署同意书。
1.2 实验材料
DMEM培养基购自美国Hyclone公司;胰蛋白酶和胎牛血清均购自美国Gibco公司;Ⅰ型胶原酶购自上海百赛生物技术股份有限公司;miR-141-3p mimics、miR-141-3p抑制剂(anti-miR-141-3p)及其各自阴性对照试剂均购自广州锐博生物科技有限公司;Lipofectamine2000购自美国Invitrogen公司;Trizol试剂购自北京全式金生物技术有限公司;反转录试剂盒与实时荧光定量聚合酶链反应(qRT-PCR)检测试剂盒均购自美国Thermo Fisher公司;MTT细胞增殖检测试剂盒购自上海生物工程股份有限公司;Annexin V-FITC/PI检测试剂盒购自武汉艾美捷科技有限公司;双荧光素酶活性检测试剂盒购自北京索莱宝科技有限公司;RIPA裂解液购自美国Sigma公司;兔抗人Cyclin D1、Bcl-2、P21、Bax抗体购自美国Abcam公司;HRP标记的IgG二抗购自武汉博士德生物工程有限公司;兔抗人HMGB1抗体购自武汉菲恩生物科技有限公司。
1.3 實验方法
1.3.1 体外原代培养HEEC 应用差速梯度离心与细胞贴壁时间差等方法分离异位内膜腺上皮细胞及间质细胞。剪碎膜组织,Ⅰ型胶原酶(2 g/L)消化60 min,用100目滤网过滤,将含有PBS的DMEM培养液加入滤液内,4 ℃条件下,以700 r/min离心7 min,弃上清,接种至培养皿(间质细胞),加入含有体积分数0.10胎牛血清的培养液,放入37 ℃、体积分数0.05 CO2培养箱内培养[9]。
1.3.2 实验分组 待HEEC传代至第3代时,收集生长状态良好的HEEC,随机分为miR-NC组(细胞中转染miR-NC)、miR-141-3p组(转染miR-141-3p mimics的细胞)。严格按照Lipofectamine2000转染试剂说明书的步骤进行操作,转染6 h后更换含有体积分数0.10胎牛血清的DMEM完全培养基,继续培养48 h,收集对数生长期的细胞完成功能验证实验。
1.3.3 qRT-PCR检测miR-141-3p表达水平 采用Trizol法分别提取正常子宫内膜组织、异位子宫内膜组织、HEEC的总RNA,依次分别加入200 μL 氯仿与500 μL异丙醇,4 ℃下、12 000 r/min离心15 min,弃上清,RNA沉于管底。以体积分数0.75乙醇洗涤RNA沉淀,晾干后加入适量无RNA酶水,充分溶解RNA,置于-80 ℃超低温冰箱保存。应用反转录试剂盒将RNA反转录为cDNA,qRT-PCR法检测miR-141-3p相对表达量。反应条件:95 ℃、5 min,95 ℃、30 s,60 ℃、30 s,72 ℃、30 s,共循环40次。miR-141-3p以U6为内参,采用 2-ΔΔCt法计算miR-141-3p的表达水平。
1.3.4 MTT检测细胞增殖 收集转染后各组的HEEC,胰蛋白酶消化,制备细胞悬浮液,以每孔3×105个细胞的密度接种于96孔板。分别于培养24、48、72 h时每孔入MTT溶液20 μL,室温孵育4 h,弃上清,每孔加入二甲基亚砜(DMSO)溶液150 μL,低速振荡10 min。利用酶标仪检测各孔在490 nm波长处的吸光度(A)。每组实验均重复3次。
1.3.5 流式细胞术检测细胞凋亡 收集各组对数生长期HEEC,PBS洗涤,胰蛋白酶消化,4 ℃下、10 000 r/min离心5 min。PBS洗涤细胞,分别加入200 μL结合缓冲液,依次加入5 μL 的Annexin V-FITC与5 μL 的PI,室温避孵育20 min。置于流式细胞仪检测细胞凋亡率。 每组实验均重复3次。
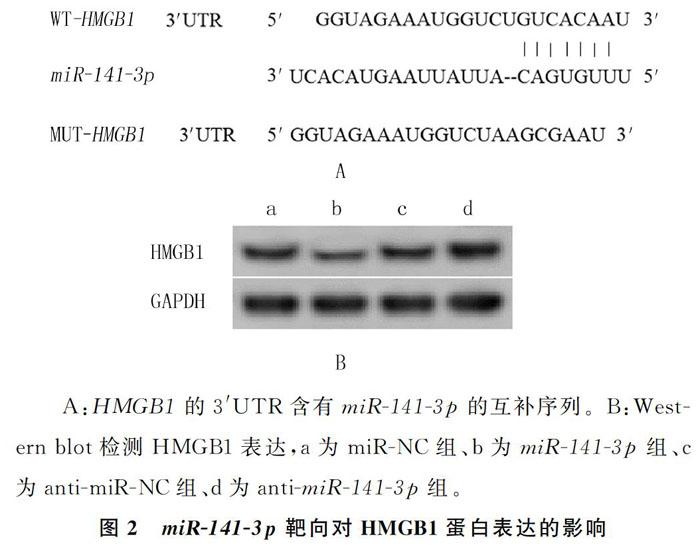
1.3.6 荧光素酶报告基因检测 靶基因预测网站预测miR-141-3p的靶基因,预测显示miR-141-3p与HMGB1的3′UTR存在结合位点,将含有miR-141-3p结合位点及其突变位点的HMGB1-3′UTR片段插入PGL3荧光素酶报告基因载体,构建野生型(WT-HMGB1)与突变型(MUT-HMGB1)的荧光素酶报告载体。实验分为4组:WT-HMGB1+miR-NC共转染组、WT-HMGB1+miR-141-3p mimics共转染组、MUT-HMGB1+miR-NC共转
染组、MUT-HMGB1+miR-141-3p mimics共转染组。转染24 h后收集细胞,采用双荧光素酶活性检测试剂盒检测各组相对荧光素酶活性。每组实验均重复3次。
1.3.7 蛋白免疫印迹(Western blot)检测HMGB1、Cyclin D1、Bcl-2、P21、Bax蛋白表达 分别取各组HEEC,加入细胞裂解液裂解细胞,4 ℃条件下、12 000 r/min离心15 min。收集上清,BCA法测定蛋白浓度。蛋白煮沸变性,取30 μg蛋白上样进行100 g/L的SDS-PAGE凝胶电泳,将分离的蛋白凝胶转移至PVDF膜。50 g/L脱脂奶粉封闭1 h,加入一抗(稀释比1∶1 000),4 ℃孵育24 h,TBST清洗;加入二抗(稀释比1∶2 000),室温孵育30 min,TBST洗膜。应用ECL试剂盒进行化学发光反应,置于凝胶成像系统并应用Quantity One软件定量分析蛋白条带灰度值。每组实验均重复3次。
1.4 统计学处理
应用SPSS 19.0软件进行统计学处理,计量资料数据以±s表示,两组均数间比较采用t检验,多组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 正常和异位子宫内膜组织miR-141-3p表达
本文qRT-PCR检测结果表明,正常与异位子宫内膜组织中miR-141-3p表达水平分别为0.87±0.08和0.17±0.02,异位子宫内膜组织中miR-141-3p表达水平较正常子宫内膜显著降低,差异有显著意义(t=56.880,P<0.001)。
2.2 miR-141-3p过表达对HEEC增殖与凋亡及相关蛋白影响
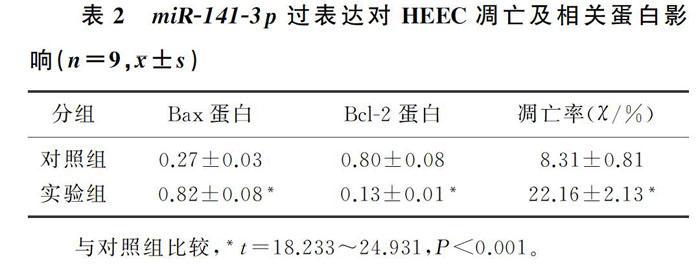
HEEC中转染miR-141-3p mimics后,与miR-NC组(对照组)相比,miR-141-3p组(实验组)细胞活力显著降低(t=10.972~13.403,P<0.001),细胞凋亡率显著升高(t=18.233,P<0.001),Cyclin D与Bcl-2蛋白的水平降低(t=24.931、25.456,P<0.001),P21与Bax蛋白的水平则升高,差异均有统计学意义(t=19.312、20.175,P<0.001)。见图1与表1、2。
2.3 miR-141-3p靶向对HMGB1蛋白表达的影响
Target Scan预测显示,HMGB1的3′UTR含有miR-141-3p的互补序列。见图2A。双荧光素酶报告实验结果显示,WT-HMGB1+miR-NC共转染组、WT-HMGB1+miR-141-3p mimics共转染组、MUT-HMGB1+miR-NC共转染组和MUTHMGB1+miR-141-3p mimics共转染组HMGB1的相对荧光素酶活性分别为1.05±0.10、0.27±0.03、1.07±0.10和1.02±0.09,HEEC细胞中转染miR-141-3p mimics可显著降低含有miR-141-3p结合位点荧光报告载体的相对荧光素酶活性(n=9,t=22.413,P<0.001);后两组比较差异无统计学意义(t=1.115,P>0.05)。Western blot的检测结果显示,miR-NC组、miR-141-3p组、anti-miR-NC组和anti-miR-141-3p组HMGB1蛋白表达分别为0.63±0.06、0.21±0.02、0.64±0.06和0.99±0.10,各组比较差异有显著性(n=9,F=208.278,P<0.001)。miR-141-3p过表达后,细胞中HMGB1蛋白的水平为0.21±0.02,与miR-NC组的0.63±0.06相比较显著降低(t=19.922,P<0.05);抑制miR-141-3p表达后,细胞中HMGB1蛋白水平为0.99±0.10,与anti-miR-NC组的0.64±0.06相比较显著升高(t=9.004,P<0.05)。见图2B。表明HMGB1是miR-141-3p的靶基因,miR-141-3p可负性调控HMGB1的表达。
3 讨论
子宫内膜异位症主要指子宫腔被覆内膜外存在子宫内膜组织生长及浸润。研究表明,miRNA可通过调控下游靶基因表达而参与子宫内膜异位症发生过程[10-12]。但仍有部分miRNA在子宫内膜异位症中的机制尚未完全阐明,因此本研究探寻新型miR-141-3p在子宫内膜异位症发生过程中的可能作用机制。miR-141-3p在肿瘤细胞中呈低表达,miR-141-3p过表达后可显著抑制细胞增殖及其侵袭能力,诱导细胞凋亡[13-20]。但是,miR-141-3p在子宫内膜异位症中的表达及其作用机制尚不明确。本研究结果显示,miR-141-3p在异位子宫内膜组织中呈低表达,说明miR-141-3p表达降低可能参与子宫内膜异位症发生过程。本文进一步研究显示,miR-141-3p过表达后,HEEC的增殖能力显著降低,细胞凋亡率顯著升高,Cyclin D1、Bcl-2蛋白表达下调,P21、Bax蛋白表达上调。已有报道指出,Cyclin D1可正向调控细胞周期进程,促进细胞增殖;P21可以通过抑制Cyclin D1与CDK4结合而阻滞细胞周期进程,抑制细胞增殖[21-26]。Bcl-2、Bax蛋白是HEEC凋亡过程中的重要作用因子,Bcl-2蛋白表达升高可抑制HEEC凋亡,而Bax蛋白表达升高可促进HEEC凋亡[27]。说明miR-141-3p过表达可通过干扰细胞增殖及凋亡相关蛋白而调节HEEC的增殖及凋亡行为。即miR-141-3p过表达可抑制HEEC的增殖,促进其凋亡。
HMGB1在子宫内膜异位症病人血清中的表达水平升高,并可作为子宫内膜异位症诊断的重要指标[28]。HMGB1属于DNA结合蛋白。研究表明,HMGB1可促进炎症反应及血管生成,还可通过调节多种信号转导通路而参与多种疾病发生及发展过程[29。相关研究报道指出,HMGB1还可通过促进Treg细胞分泌及增强其介导的免疫抑制作用而参与子宫内膜异位症发生过程[30]。本研究结果表明,miR-141-3p可靶向调控HMGB1表达。提示miR-141-3p过表达可能通过靶向调控HMGB1而抑制HEEC增殖,诱导其凋亡。
综上所述,子宫内膜异位症病人中miR-141-3p的表达明显降低,miR-141-3p过表达可能通过调控HMGB1的表达而抑制HEEC的增殖及促进其凋亡。本研究结果为揭示子宫内膜异位症的发病机制奠定理论基础,为子宫内膜异位症治疗提供了新的思路。但关于miR-141-3p在子宫内膜异位症发生及发展过程中,具体通过调控哪种信号通路而发挥作用尚需进一步探究。
[参考文献]
[1]刘敏娟,黄郁馨,冯婉琴,等. miR-96靶向血管生成素-1基因对子宫内膜异位症子宫内膜干细胞增殖的影响[J]. 广东医学, 2018,39(23):3448-3453.
[2]BRILHANTE A V, AUGUSTO K L, PORTELA M C, et al. Endometriosis and ovarian cancer: an integrative review (endometriosis and ovarian cancer)[J]. Asian Pacific Journal of Cancer Prevention: APJCP, 2017,18(1):11-16.
[3]WILBUR M, SHIH I, SEGARS J, et al. Cancer implications
for patients with endometriosis[J]. Seminars in ReproductiveMedicine, 2017,35(1):110-116.
[4]BARANOV V S, IVASCHENKO T E, LIEHR T, et al. Systems genetics view of endometriosis: a common complex disorder[J]. European Journal of Obstetrics, Gynecology, and Reproductive Biology, 2015,185(1):59-65.
[5]陳观盛,赵雅男,洪顺家,等. 血清微小RNA在子宫内膜异位症中的表达谱及其诊断潜能[J]. 岭南急诊医学杂志, 2015,20(1):44-47.
[6]张海燕. 非编码小核酸miR-141与COX-2在子宫内膜异位症的在位内膜中的表达及相关性研究[D]. 上海:复旦大学, 2013:1-38.
[7]吴锦杰,梁炎春,姚书忠. HMGB1对子宫内膜异位症新生血管生成的潜在作用[J]. 国际妇产科学杂志, 2016,43(2):194-198.
[8]俞梅珍,贾兰珍. 血清癌抗原125水平与子宫内膜异位症分期的关系研究[J]. 中国妇幼保健, 2015,30(14):2175-2176.
[9]王丹,夏良斌,张婷,等. 内皮抑素对异位子宫内膜细胞的作用及机制[J]. 中国妇幼保健, 2016,31(4):832-835.
[10]黄玲,王玎. miRNA在子宫内膜异位症中的研究进展[J]. 长江大学学报(自科版), 2016,13(36):81-84.
[11]YU H, ZHONG Q, XIA Y, et al. MicroRNA-2861 targets STAT3 and MMP2 to regulate the proliferation and apoptosis of ectopic endometrial cells in endometriosis[J]. Pharmazie, 2019,74(4):243-249.
[12]宋文妍,王雪改,孙莹璞,等. 三种促排卵方案对不同年龄子宫内膜异位症患者 IVF-ET妊娠及出生结局的影响[J]. 郑州大学学报(医学版), 2016,51(2):227-233.
[13]王寓,邱明星,熊国兵. miR-141-3p靶向TGF-β2对人前列腺癌C4-2B细胞恶性生物学行为的影响[J]. 中国肿瘤生物治疗杂志, 2018,25(12):1237-1243.
[14]HUANG S, WA Q, PAN J, et al. Downregulation of miR-141-3p promotes bone metastasis via activating NF-κB signaling in prostate cancer[J]. J Exp Clin Cancer Res, 2017,36(1):173-183.
[15]LIANG Z, LI X, LIU S, et al. MiR-141-3p inhibits cell pro-
liferation, migration and invasion by targeting TRAF5 in colorectal cancer[J]. Biochem Biophys Res Commun, 2019,514(3):699-705.
[16]LU G, ZHANG Y. Long non-coding RNA ATB promotes human non-small cell lung cancer proliferation and metastasis by suppressing miR-141-3p[J]. PLoS One, 2020,15(2): e0229118-e0229128.
[17]LIU X, WANG M, CUI Y. LncRNA TP73-AS1 interacted with miR-141-3p to promote the proliferation of non-small cell lung cancer[J]. Arch Med Sci, 2019,15(6):1547-1554.
[18]XING Y, JING H, ZHANG Y, et al. MicroRNA-141-3p affected proliferation, chemosensitivity, migration and invasion of colorectal cancer cells by targeting EGFR[J]. Int J Biochem Cell Biol, 2020,118(1):105643-105653.
[19]SUN J, ZHANG Y. LncRNA XIST enhanced TGF-β2 expression by targeting miR-141-3p to promote pancreatic cancer cells invasion[J]. Biosci Rep, 2019,39(7):332-342.
[20]LI W, CUI Y, WANG D, et al. MiR-141-3p functions as a tumor suppressor through directly targeting ZFR in non-small cell lung cancer[J]. Biochem Biophys Res Commun, 2019,509(3):647-656.
[21]李金姑,石淑卿,林元. C-myc和cyclin D1在子宮内膜异位症中免疫反应性增强[J]. 中国组织化学与细胞化学杂志, 2017,26(2):152-159.
[22]侴琳,王慧,赵晓丽. p53、p21、MDM2蛋白在卵巢子宫内膜异位症病人血清、异位及在位内膜组织中的表达及相关性[J]. 安徽医药, 2019,23(5):955-958.
[23]ZHOU J, DU G, FU H. miR-296-3p promotes the proliferation of glioblastoma cells by targeting ICAT[J]. Mol Med Rep, 2020,21(5):2151-2161.
[24]WANG Q Y, YANG X, ZHOU X, et al. MiR-3174 promotes proliferation and inhibits apoptosis by targeting FOXO1 in hepatocellular carcinoma[J/OL]. Biochem Biophys Res Commun, 2020,S0006-291X(20)30649-5.
[25]WAN J, LONG F, ZHANG C, et al. miR-181b-p53 negative feedback axis regulates osteosarcoma cell proliferation and invasion[J]. Int J Mol Med, 2020,45(6):1803-1813.
[26]YANG L, LIU L, ZHANG X, et al. miR-96 enhances the proliferation of cervical cancer cells by targeting FOXO1[J]. Pathol Res Pract, 2020,216(4):152854-152864.
[27]肖新春,彭光霞. 宫瘤消胶囊对子宫内膜异位症大鼠异位内膜中Bcl-2、Bax蛋白表达的影响[J]. 上海中医药大学学报, 2016,30(5):74-78.
[28]王婉. 血清HMGB1与RBP4联合检测在诊断子宫内膜异位症中的应用[J]. 宁夏医科大学学报, 2015,37(3):309-311.
[29]VAN BEIJNUM J R, NOWAK-SLIWINSKA P, VAN DEN BOEZEM E, et al. Tumor angiogenesis is enforced by autocrine regulation of high-mobility group box 1[J]. Oncogene, 2013,32(3):363-374.
[30]谢鸿玉,梁炎春,姚书忠. HMGB1调节Treg细胞参与子宫内膜异位症发病的免疫机制[J]. 国际生殖健康计划生育杂志, 2016,35(2):160-164.
(本文编辑 于国艺)
[收稿日期]2019-10-27; [修订日期]2020-05-13
[基金项目]河南省医学科技攻关计划项目(20180214253)
[第一作者]刘文博(1983-),女,硕士,主治医师。E-mail:liuwenbo201907@163.com。
