?高效液相色谱法测定蓝莓果中花色苷含量?
2020-07-04何金格王政邓洁红
何金格 王政 邓洁红

摘 要:采用高效液相色谱法建立了蓝莓果中花色苷的定量分析方法。蓝莓样品经酸化乙醇超声提取,色谱柱为C18色谱柱,流动相为酸性较强的2%甲酸水溶液(A)和2%甲酸乙腈溶液(B),检测波长为520 nm,花色苷含量以飞燕草素-3-O-葡萄糖苷的含量表示。结果表明:飞燕草素-3-O-葡萄糖苷在1.0~100 μg/mL浓度范围内,线性关系良好(R2=0.999 8);蓝莓果中飞燕草素-3-O-葡萄糖苷回收率为92.61%,RSD为0.75%,且样品中花色苷物质分离度、精密度均良好;检测限和定量限分别为0.1和0.5 μg/mL。经测定,灿烂、圆蓝、巴尔德温这3个蓝莓品种中圆蓝品种花色苷含量最高。
关键词:高效液相色谱法;蓝莓果;花色苷;测定方法
中图分类号:O657.7文献标识码:A文章编号:1006-060X(2020)05-0068-04
Determination of Anthocyanin in Blueberry by High Performance Liquid Chromatography
HE Jing-ge1,WANG Zheng1,2,DENG Jie-hong1,2
(1. College of Food Science and Technology, Hunan Agricultural University, Changsha 410128,PRC; 2. Hunan Provincial Research
Center of Engineering and Technology for Fermented Food, Changsha 410128, PRC)
Abstract: The quantitative analysis method of anthocyanins in blueberry fruit was established by high performance liquid chromatography (HPLC). Blueberry samples were extracted by acidification ethanol ultrasonic method. The chromatographic column was C18, the mobile phase was 2% formic acid aqueous solution (A) and 2% formic acid acetonitrile solution (B). The detection wavelength was 520 nm. The content of anthocyanin was expressed by the content of delphinidin-3-O-glucoside. The results showed that the linear relationship of delphinidin-3-O-glucoside was good in the concentration range of 1.0-100 μg/mL (R2 = 0.999 8). The recovery of delphinidin-3-O-glucoside in blueberry fruit was 92.61%, RSD was 0.75%, and the separation and precision of anthocyanins were good. The detection limit and quantitative limit were 0.1 and 0.5μg/mL, respectively. Among the three blueberry varieties Canlan, Yuanlan and Baldwin, the content of anthocyanin in Yuanlan is the highest.
Key words: high performance liquid chromatography; blueberry fruit; anthocyanin; determination method
蓝莓(Blueberry)又称越橘、蓝浆果,杜鹃花科(Ericaceae)越橘属(Vaccinium spp.)多年生落叶或常绿灌木,果实为浆果,近圆形,呈蓝色,酸甜适度,果肉细腻,皮薄籽小[1-2]。藍莓的花色苷(Anthocyanins)含量居于水果和蔬菜之首,被联合国粮农组织誉为“黄金浆果”[3]。花色苷是黄酮类化合物,广泛存在于植物的根茎叶花果实等器官的细胞液中,使其呈现出红色蓝色或紫色等颜色,是自然界重要的水溶性的色素之一,分布于27个科,72个属的植物中[4]。花色苷不仅赋予植物鲜艳的颜色以利于授粉和种子传播、抵抗植物虫害[4]以及预防植物的紫外线照射损伤[5],而且具有重要的生物活性功能,如抗氧化活性、抗癌活性、抗动脉硬化活性[6]、降低血脂[7]、减少肝损伤[8]和降血糖活性[9]等。
花色苷属于天然的食用色素,且生理活性对人体具有重要的保健功能,得到国内外学者的广泛关注和研究,并且在食品、药品、保健品和化妆品等方面的应用十分广泛。目前花色苷含量测定方面的研究比较多,主要是采用pH示差法测定总花色苷含量,而高效液相色谱法具有能够准确测量单一组分和将花色苷物质良好分离的优点。林丽等[10]利用大孔树脂分离纯化,运用高效液相色谱法,快速准确地测定黑果枸杞提取物中的花色苷主要成分物质矮牵牛素-5-O-葡萄糖苷含量。赵珊等[11]采用盐酸甲醇溶液超声提取有色稻米花色苷,以超高效液相色谱-紫外检测器对有色稻米中主要花色苷矢车菊素-3-O-葡萄糖苷和芍药素-3-O-葡萄糖苷进行定量检测。笔者在前人研究[12-15]的基础,以张家界引种的蓝莓品种为研究对象,重点研究高效液相色谱法测定蓝莓果中花色苷(以飞燕草素-3-O-葡萄糖苷计)的相对含量,以期对果实品质的评价和深加工等方面的研究提供数据参考,也为蓝莓果中花色苷单体的分离和制备提供一定的参考依据。
1 材料与方法
1.1 试验材料
供试蓝莓样品为灿烂、圆蓝、巴尔德温这3种,均来源于张家界蓝莓生产基地,2017年7月购回后于-40℃冻藏备用。
主要试剂有飞燕草素-3-O-葡萄糖苷标准品(上海源叶生物科技有限公司,纯度≥95%)、乙醇(分析纯)、甲酸(分析纯)、盐酸(分析纯)、乙腈(色谱纯,EMD Millipore Corporation)、甲醇(色谱纯,EMD Millipore Corporation)和分析纯化水。
主要仪器设备有LC-20AT型高效液相色谱仪(日本岛津公司)、梅特勒电子天平(感量0.1 mg)、9960A型超声波清洗器(天津科贝尔有限公司)、移液枪(eppendorf,规格10~100 μL和0.5~5 mL)。
1.2 试验方法
1.2.1 标准溶液制备 标准贮备液的配制:准确称取飞燕草素-3-O-葡萄糖苷标准品5.0 mg(精确到0.1 mg),用甲醇溶解并定容至25 mL容量瓶中,即为200 μg/mL的标准溶液,于-20℃下,贮存于密封的棕色玻璃瓶中。标准曲线溶液的配制:分别准确吸取上述标准溶液0.05、0.1、0.25、0.5、1.25、2.5和5.0 mL于10 mL容量瓶中,用0.1%甲酸水稀释至刻度,摇匀即得系列浓度分别为1.0、2.0、5.0、10.0、25.0、50.0和100.0 μg/mL的花色苷标准曲线工作液。
1.2.2 花色苷提取液的制备 准确称取蓝莓果5 g记录其质量,(精确至0.1 mg),研磨,加入50 mL 70%的乙醇溶液(添加0.1%盐酸),于50℃下超声50 min,冷却后,将蓝莓果花色苷粗提液经抽滤后,置于50℃的旋转蒸发仪中减压浓缩,用0.1%甲酸水定容至50 mL,摇匀经0.45 μm微孔滤膜过滤,上机,进样体积为50 μL。
1.2.3 色谱条件优化 采用紫外-可见光全波段(250~800 nm)扫描,以确定最佳检测波长。研究表明,花色苷在低pH值条件下分离较好,因此流动相选择酸性较强的2%甲酸水溶液(A)和2%甲酸乙腈溶液(B)。色谱柱为稳定性好的C18色谱柱(CAPCELL PAK,4.6 μm×250 mm,5 μm)。采用二元梯度洗脱,洗脱程序如下:0~15 min,5%~15%B;15~20 min,15%B;20~27 min,15%~40%B;27~28 min,40%~100%B;28~33 min,100%B;33~48 min,100%~5%B。柱温40℃,流速0.6 mL/min,时间50 min。
1.2.4 标准曲线绘制 将浓度分别为1.0、2.0、5.0、10.0、25.0、50.0和100.0 μg/mL的花色苷标准工作液,经0.45 μm微孔滤膜过滤,依次进高效液相色谱仪检测,记录色谱图,以浓度为横坐标、峰面积为纵坐标绘制标准曲线。进样体积为50 μL。
1.2.5 方法验证 (1)精密度。取浓度为25.0 μg/mL的标准品溶液进行6次平行测定,进样体积为50 μL,计算飞燕草素-3-O-葡萄糖苷的保留时间和峰面积的相对标准偏差(RSD)。(2)回收率。称取3份5 g(精确至0.1 mg)蓝莓果(圆蓝品种),研磨后置50 mL容量瓶中,在样品中加入飞燕草素-3-O-葡萄糖苷标准品稀释液1.0和5.0mL(200 μg/mL),每个浓度做3个平行测定。(3)检出限和定量限。精密量取50.0 μg/mL标准品溶液0.1、0.2、0.3、0.4和0.5 mL分别置于50 mL容量瓶中,记录相应保留时间标准物质的峰高,与基线噪音峰高之比,以信噪比为3∶1来确定最低检出限,10∶1来确定定量限。
1.2.6 不同蓝莓品种中花色苷含量的测定 以1.2.3的方法对张家界地区的灿烂、圆蓝、巴尔德温这3个品种的蓝莓果进行花色苷测定,花色苷总量以飞燕草素-3-O-葡萄糖苷的含量表示。
2 结果与分析
2.1 检测波长的确定
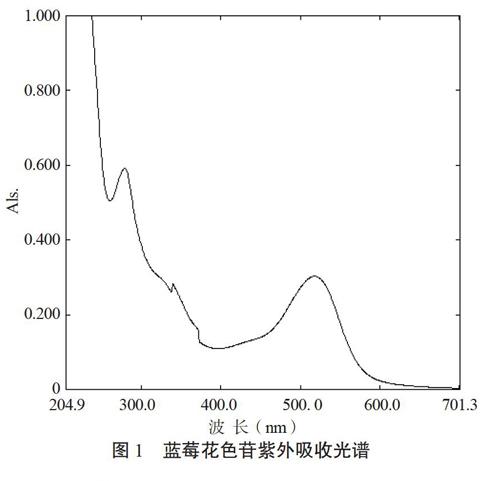
如图1所示,发现蓝莓花色苷在280 nm及520 nm左右,均有最大吸收峰,为排除280 nm处其他黄酮类物质的干扰,试验确定最佳检测波长为520 nm。
2.2 液相条件的确定
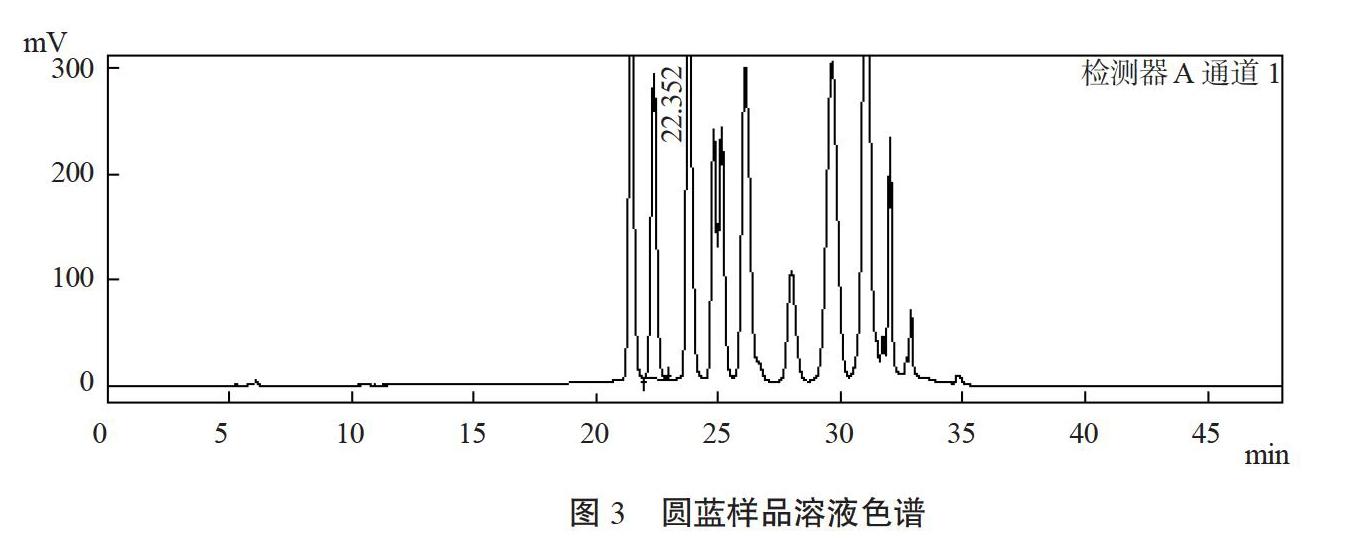
通过色谱条件优化,飞燕草素-3-O-葡萄糖苷标准品在22.298 min处有最大值(图2),峰形完整。由图3可知,蓝莓果样品在C18色谱柱分离下一共有13个峰,各峰保留时间主要集中在20~35 min之间,且分离度良好。
2.3 方法线性
标准曲线如图4所示,飞燕草素-3-O-葡萄糖苷的线性回歸方程为y=60 017 x-2 164.3,R2=0.999 8,表明在1.0~100.0 μg/mL浓度范围内,浓度与峰面积呈良好线性关系。
2.4 方法验证
2.4.1 精密度 如表1所示,飞燕草素-3-O-葡萄糖苷的保留时间的RSD为0.11%,峰面积的RSD为1.21%,均小于3%,表明仪器精密度良好。
2.4.2 回收率 由表2可知,飞燕草素-3-O-葡萄糖
2.4.3 检出限和定量限 经检测,采用该方法,飞燕草素-3-O-葡萄糖苷的检出限为0.1 μg/mL,定量限为0.5 μg/mL。当称样量为5.0 g,飞燕草素-3-O-葡萄糖苷的检出限1.0 mg/kg,定量限为5.0 mg/kg。
2.5 样品测定结果
经测定,灿烂、圆蓝、巴尔德温这3个蓝莓品种的飞燕草素-3-O-葡萄糖苷含量分别为25、740和40 mg/kg,表明圆蓝品种中花色苷含量最高。
3 结 论
研究采用酸纯化乙醇超声提取蓝莓果中花色苷,以蓝莓果主要成分物质飞燕草素-3-O-葡萄糖苷为目标,建立高效液相色谱法测定蓝莓果中花色苷的相对含量。蓝莓果中飞燕草素-3-O-葡萄糖苷浓度在1.0~100 μg/mL范围内,线性关系良好,R>0.999 8,且回收率为92.61%,RSD为0.75%,且具有有良好精密度,蓝莓果花色苷物质分离度良好,检出限低,适用于蓝莓果花色苷含量测定,并且该方法对于蓝莓果花色苷的成分鉴定和花色苷单体的制备和分离提供了一定的参考价值。经测定,3个蓝莓品种中圆蓝品种花色苷含量最高。
参考文献:
[1] 史海芝,刘惠民. 国内外蓝莓研究现状[J]. 江苏林业科技,2009,36(4):48-51.
[2] 陈 卫. 蓝莓及其营养保健功能[J]. 中外食品:酒尚,2003,7:34-35.
[3] 刘静波,陈晶晶,王二雷,等. 蓝莓果实中花色苷单体的色谱分离纯化[J]. 食品科学,2017,38(2):206-213.
[4] Harborne J B. Introduction to Ecological Biochemistry(3rd ed)[M]. London:Academic Press,1988.
[5] Mazza G,Miniati E. Anthocyanins in fruits,vegetables and grains[M]. London:CRC Press,1993.
[6] 孙建霞,张 燕,胡小松,等. 花色苷的结构稳定性与降解机制研究进展[J]. 中国农业科学,2009,42(3):996-1008.
[7] 焦 岩,王振宇. 蓝靛果花色苷超声波辅助提取优化及其降血脂作用[J]. 中国食品学报,2010,10(2):52-59.
[8] Zhaohua H,Peiyou Q,Guixing R. Effect of anthocyanin-rich extract from black rice(Oryza sativa L. Japonica)on chronically alcohol-induced liver damage in rats [J]. Journal of Agricultural and Food Chemistry,2010,58(5):3191-3196.
[9] Mary H G,David M R,Peter K. Hypoglycemic activity of a novel anthocyanin-rich formulation from lowbush blueberry,Vaccinium angustifolium Aiton[J]. Phytomedicine,2009,16(5):406-415.
[10] 林 丽,李 进,丁成丽. 高效液相色谱法测定黑果枸杞果实中花色苷的含量[J]. 食品科学,2013,34(6):164-166.
[11] 赵 珊,席清清,李 曦,等. 超高效液相色谱法测定有色稻米中花色苷的含量[J]. 食品与发酵工业,2018,44(11):301-306.
[12] 潘美山,何科佳,易 春,等. 湖南省蓝莓新兴产业发展的技术战略分析[J]. 湖南农业科学,2012(20):37-39.
[13] Lee J,Rennaker C,Wrolstad R E. Correlation of two anthocyanin quantification methods:HPLC and spectrophotometric methods [J]. Food Chemistry,2008,110(3):782-786.
[14] 汪正范. 色谱定性与定量[M]. 北京:化学工业出版社,2000:130-153.
[15] 马 凯,杨鸿波,唐年琴. 蓝莓花色苷含量分析及定量方法的比较——以贵州麻江引种蓝莓为例[J]. 贵州科学,2015,33(2):20-24.
(责任编辑:肖彦资)
收稿日期:2020-03-19
基金項目:湖南省自然科学基金(2018JJ2168)
作者简介:何金格(1990—),女,湖南衡阳市人,硕士研究生,专业:食品加工与安全。
通信作者:邓洁红
