?朱顶红的组培快繁技术研究?
2020-07-04黄敏梁春辉许雯岳海林许洁珊董斌
?黄敏 梁春辉 许雯 岳海林 许洁珊 董斌?
摘 要:以朱顶红鳞茎为材料,研究了朱顶红离体培养中各环节的关键技术,包括外植体具体部位的选取、外植体的消毒方式、增殖培养基及生根培养基的优化等,初步建立了朱顶红的组培快繁体系。结果表明:宜以朱顶红下部鳞茎为外植体;最佳消毒方式为先使用75%酒精消毒30 s,再使用2% NaClO消毒18 min,无菌水冲洗后接入诱导培养基中;从诱导出的丛芽上切取含1~2 个芽的部分接入到增殖培养基中,最佳增殖培养基为MS+6-BA 2.0 mg/L+NAA 1.0 mg/L+活性炭0.2 g/L+蔗糖25 g/L+琼脂7 g/L,增殖率能达到4.82;最佳生根培养基为1/2 MS+1.0 mg/L NAA+蔗糖30 g/L+琼脂7 g/L,生根率为92.5%。
关键词:朱顶红;鳞茎;组织培养;快繁
中图分类号:S682.25 文献标识码:A 文章编号:1006-060X(2020)05-0001-03
Study on Tissue Culture and Rapid Propagation Techniques for Amaryllis vittata
HUANG Min,LIANG Chun-hui,XU Wen,YUE Hai-lin,XU Jie-shan,DONG Bin
(Guangdong Agriculture Industry Business Polytechnic, Guangzhou 510507, PRC)
Abstract: The in vitro culture of Amaryllis vittata was conducted using its bulb as explant material to determine the sterilization time of explants, specific parts cut for explants, optimal proliferation medium and rooting medium, then a rapid propagation system for Amaryllis vittata tissue culture was established. The optimal protocol for Amaryllis vittata tissue culture was that the pieces from the lower part of a bulb were used as the explants, disinfected with 75% alcohol for 30 s, with 2% NaClO for 18 min, then washed with sterile water, finally inserted into the induction medium; the part containing 1 or 2 buds was cut from the induced cluster buds and inserted into the proliferation medium; the optimal proliferation medium was MS + 6-BA 2.0 mg/L + NAA 1.0 mg/L + AC 0.2g/L + sucrose 25 g/L + agar 7.0 g/L, with a proliferation rate of 4.82; the optimal rooting medium was 1 /2 MS + NAA 1.0 mg/L + sucrose 30 g/L + agar 7.0 g/L, with a rooting rate of 92.5%.
Key words: Amaryllis vittata; bulb; tissue culture; rapid propagation
朱顶红(Amaryllis vittata)又名朱顶兰、孤挺花、百枝莲,是石蒜科朱顶红属多年生草本植物,球形鳞茎,叶略带肉质,花大而挺立,具有较高的观赏价值[1-3]。朱顶红在中国的商品化栽培起步较晚,繁殖技术相对落后,目前中国生产所用的优质种球绝大部分依赖进口,从而导致其生产成本居高不下[4-5]。朱顶红自花不实,一般通过分球繁殖,但这种方法繁殖系数较低,无法满足市场需求,且长期的无性繁殖也容易积累和传播病毒[6]。植物组织培养快速繁殖技术则是改善和提高朱顶红繁殖质量和数量的理想途径[7]。因此,笔者以朱顶红鳞茎为材料进行组培快繁技术优化研究,以期建立朱顶红组培快繁体系。
1 材料与方法
1.1 试验材料
供试材料为直径6~8 cm大小的朱顶红鳞茎,取自广东农工商职业技术学院温室,品种为冰雪皇后,鳞茎健壮饱满无病。
1.2 试验方法
将种球在阴凉通风环境下存放2~3 d,然后剥去外层干枯鳞片,切除种球根部,用自来水冲洗干净后置于超净工作台上备用。
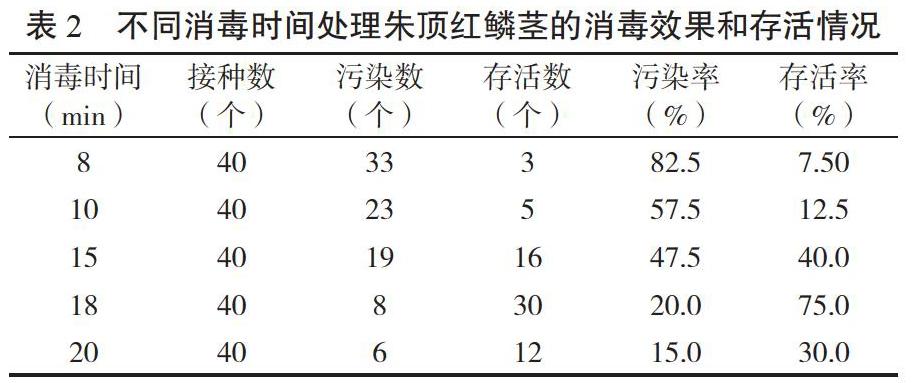
1.2.1 最适消毒时间的选择 将冲洗干净的鳞茎种球首先用75%酒精浸泡30 s,用无菌水冲洗3~4次,接着用2% NaClO溶液分别浸泡8、10、15、18、20 min,然后无菌水冲洗3~4次,冲洗过程中反复摇动,消毒完毕后用无菌纸吸干外植体表面的水分,将鳞片切成带有鳞茎下盤基部的长条形,在无菌条件下将外植体接入MS基本培养基中,每个处理接种20瓶,重复2次,随后将材料置于25±2℃、光照强度1 500~2 000 lx的环境条件下培养,统计污染率、死亡率及存活率。
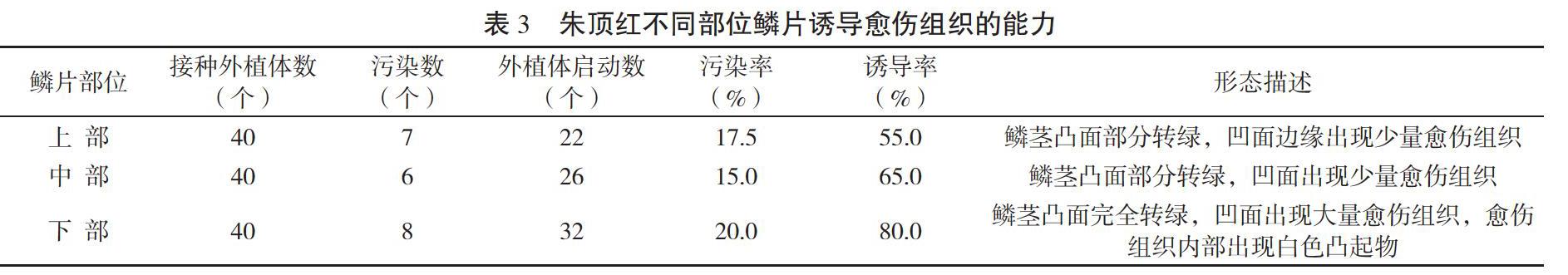
1.2.2 最佳外植体的选择 在无菌条件下,将已消毒的鳞茎横切分成上、中、下3个部分,分别接入配方为MS+6-BA 2.0 mg/L+NAA 1.0 mg/L的诱导培养基中[8],每个处理接种20瓶,重复2次,随后将材料置于25±2℃、光照强度1 500~2 000 lx的环境条件下培养,统计污染率和生长情况。
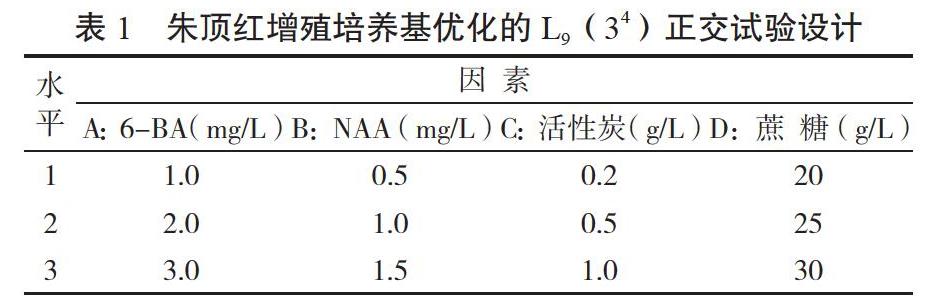
1.2.3 最佳增殖培养基的筛选 从诱导的鳞茎丛芽上切取含1~2 个芽的部分转接至不同的增殖培养基中,通过4因素3水平的正交设计L9(34)(表1)优化培养基配方,共9个处理,增殖培养基以MS为基本培养基,添加不同浓度的6-BA(1.0、2.0、3.0 mg/L)、NAA(0.5、1.0、1.5 mg/L)、活性炭(0.2、0.5、1.0 g/L)、蔗糖(20、25、30 g/L),每个处理接种20瓶,重复2次,接种后将材料置于25±2℃、光照强度1 500~2 000 lx的环境条件下培养,接种后每隔5 d观察一次,统计污染率和增殖情况。
2 结果与分析
2.1 不同消毒时间对朱顶红鳞茎消毒效果的影响
由表2可知,在同样使用2% NaClO溶液对朱顶红鳞茎进行消毒处理的情况下,不同消毒时长对外植体的消毒效果存在影响。从消毒效果来看,随着消毒时间的延长,污染数减少,污染率逐渐降低,当消毒时间达到20 min时,污染率最低,仅为15 %。从存活率来看,当消毒时间高于18 min时,外植体的存活率明显降低,当消毒时长达到20 min时,存活率仅为30%。因此,综合考虑污染率和存活率,使用2% NaClO溶液消毒18 min是朱顶红鳞茎组织培养的最优消毒方案。
2.2 不同部位鳞片对朱顶红外植体诱导的影响
从表3可以看出,以鳞片不同部位作为外植体,朱顶红外植体的诱导情况不同,不同取材部位诱导能力由强到弱依次为下部>中部>上部,下部的诱导率达到80.0%,鳞茎凸面完全转绿,凹面出现大量愈伤组织,愈伤组织内部出现白色凸起物。而从污染率来看,下部鳞片的污染率却最高,达到20.0%。但总体看来,下部鳞片仍是最优的选择。
2.3 不同培养基配方对朱顶红不定芽增殖的影响
从表4可以看出,培养基的不同成分对朱顶红诱导增殖的影响不同,在所选择的4个因子中,随着6-BA、NAA和蔗糖浓度的上升,增殖系数呈先上升后下降的趋势,且3个水平差异明显;随着活性炭浓度的上升,增殖系数呈先下降后上升的趋势。从表4还可以得出,不同试验因子对朱顶红鳞茎增殖系数的极差(R)顺序为:NAA>6-BA>活性炭>蔗糖;因此,在4个因子中,NAA对朱顶红鳞茎增殖效果的影响最大,而蔗糖的影响最小。由K值可知,朱顶红鳞茎增殖的最适培养基配方为A2B2C1D2,即:MS+6-BA 2.0 mg/L+NAA 1.0 mg/L+活性炭0.2 g/L+蔗糖25 g/L+琼脂7 g/L。
2.4 培养基中NAA浓度对朱顶红生根的影响
朱頂红生根过程选用1/2 MS为基本培养基,从表5可以看出,随着NAA浓度的提高,生根率、生根数及生长势均呈先升高后降低的趋势,当NAA浓度为1.0 mg/L时,其生根率及平均生根数在几个处理中均为最高,且生长状态好。综合考虑生根数量和质量,认为1/2MS+1.0 mg/L NAA为最佳生根培养基。
3 结论与讨论
试验以朱顶红鳞茎为外植体,研究朱顶红离体培养各环节的关键技术,包括外植体的消毒、外植体最佳部位的选取、增殖培养基及生根培养基的优化等。
在植物组织培养过程中,选择合适的外植体是关键。目前在朱顶红的组培上多数以鳞茎为外植体,多项研究中用朱顶红鳞茎诱导不定芽都取得了较好的效果[9-11];刘铎等[8]研究表明在朱顶红鳞茎的诱导中,最适部位为鳞茎下部。笔者的试验结果与其一致,下部鳞茎的诱导率最高。
培养基是组培苗最主要的营养来源,培养基的成分很大程度上决定了组培苗的生长及繁殖水平,该研究主要优化了朱顶红增殖和生根的培养基,在增殖培养基的优化中采用的是正交试验设计,该方法能大幅度减少了试验次数,节省成本[12],试验结果显示在6-BA、NAA、活性炭和蔗糖这4个组分中,NAA对朱顶红鳞茎增殖效果的影响最大,而蔗糖的影响最小,最佳不定芽增殖培养基为:MS+6-BA 2.0 mg/L+NAA 1.0 mg/L+活性炭0.2 g/L+蔗糖25 g/L+琼脂7 g/L。根据前人对朱顶红增殖培养基的研究,发现在朱顶红不定芽增殖试验中应用最多的激素组合是也是NAA和6-BA[13-14]。
该研究初步建立了朱顶红的组培繁殖体系,以朱顶红下部鳞茎为外植体,先使用75%酒精消毒30 s,再使用2% NaClO消毒18 min,无菌水冲洗后接入诱导培养基中;从诱导出的丛芽上切取含1~2 个芽的部分接入到增殖培养基中,最佳增殖培养基为MS+6-BA 2.0 mg/L+NAA 1.0 mg/L+活性炭0.2 g/L+蔗糖25 g/L+琼脂7 g/L,增殖率能达到4.82,最佳生根培养基为:1/2 MS+1.0 mg/L NAA+蔗糖30 g/L+琼脂7 g/L,生根率为92.5%。
20世纪80年代就有朱顶红组织培养的相关报
道[15]。目前,朱顶红的组培快繁技术主要是采用小鳞茎为外植体[3],虽然取得了一定的成果,但到目前为止还没有形成规模化的生产。因此,对于朱顶红组培快繁过程中的关键技术还需要进一步的研究和验证。
参考文献:
[1] 王纪方,贾春兰,金 波. 朱顶红组培株生长习性的观察[J]. 中国农业科学,1989,22(1):53-56.
[2] 韦三立. 花卉组织培养[M]. 北京:中国林业出版社,2001.
[3] 汪华清,高欢欢,朱秀鹏,等. 朱顶红在华南地区的栽培技术与园林应用[J]. 安徽农学通报,2019,25(17):41-43,96.
[4] 鲁娇娇,严 瑞,何香杉,等. 朱顶红‘Red Lion胚性愈伤组织诱导及体细胞胚发生[J]. 园艺学报,2016,43(12):2451-2460.
[5] 希吉日,田 欣,金牧兰,等. 基于朱顶红愈伤组织途径诱导形成原球茎的研究[J]. 安徽农业科学,2015,43(13):51-54.
[6] 王 晖. 东方百合切花华东地区生产栽培技术[J]. 中国花卉园艺,2005(14):12-14.
[7] 陈汉鑫,余松金,万学锋,等. 朱顶红的组培快繁技术[J]. 福建林业科技,2016,43(3):170-173,186.
[8] 刘 铎,梁树乐. 朱顶红快繁无菌体系建立的研究[J]. 现代园艺,2018(3):23-25.
[9] 孙红梅,宋利娜. 大花朱顶红鳞茎不定芽的诱导[J]. 中国农学通报,2010,26(14):247-250.
[10] 朱旭东,田松青. 朱顶红的组织培养[J]. 江苏农业科学,2002,30(6):56-57.
[11] 张亚玲,原雅玲,赵锦利. 朱顶红组织培养最佳繁殖途径的研究[A]. 中国园艺学会第七届青年学术讨论会论文集[C]. 泰安:中国园艺学会,山东省园艺学会,山东农业大学,2006. 628-636.
[12] 刘瑞江,张业旺,闻崇炜,等. 正交试验设计和分析方法研究[J]. 实验技术与管理,2010,27(9):52-55.
[13] 张 松,达克东,曹辰兴,等. 朱顶红离体培养快速繁殖体系及胚状体发生[J]. 园艺学报,2002,29(3):285-287.
[14] 田松青,朱旭东,成海钟,等. 朱顶红不同繁殖方法比较研究[J]. 江苏农业科学,2008,36(5):153-156.
[15] 沈苗苗,于晓南. 朱顶红组织培养研究进展[J]. 黑龙江农业科学,2011(10):135-138.
(责任编辑:成 平)
收稿日期:2020-03-10
基金项目:2018年度广东省普通高校青年創新人才类项目(2018GK
QNCX059);2019年“攀登计划”广东省大学生科技创新培育专项资金项目(pdjh2019b0797);2019年度广东农工商职业技术学院热带作物应用技术协同创新中心项目(XJZX1902)
作者简介:黄 敏(1987—),女,湖南长沙市人,实验师,主要从事植物组织培养研究。
通信作者:董 斌
