基于植物代谢组学的新疆一枝蒿产地标志物多维度研究
2020-07-04谢冰周帜章宸陈路路霍美玲努尔波拉提·阿依达尔汗刘戈宇阿吉艾克拜尔·艾萨王中华再帕尔·阿不力孜
谢冰 周帜 章宸 陈路路 霍美玲 努尔波拉提·阿依达尔汗 刘戈宇 阿吉艾克拜尔·艾萨 王中华 再帕尔·阿不力孜

摘 要 采用基于液相色谱-串联质谱(LC-MS/MS)联用技术的植物代谢组学分析方法,以采集自阿勒泰富蕴、哈密两个地区的新疆一枝蒿植物为研究对象,开展多维度代谢组分析,从人工栽培和野生品种两种角度,花、茎、枝葉3个层面,考察产地对于内源性代谢物的影响。同时,靶向分析了25种已知代表性代谢物在不同组别中的水平;结合非靶向与靶向分析,阐明不同产地该植物的代谢特征。结果表明,无论是人工栽培品种还是野生品种,不同产地样本的代谢组之间具有显著差异,在野生品种中表现更为突出。最终,从人工栽培品种筛选出29种已知结构类别的差异代谢物,包括10种黄酮类化合物、12种绿原酸类似物、7种一枝蒿酮酸衍生物;从野生品种筛选出45种已知结构类别的差异代谢物,包括17种黄酮类化合物、14种绿原酸类似物、14种一枝蒿酮酸衍生物。25种已知代表性代谢物中,8种在人工栽培品种中、11种在野生品种中表现出了产地差异性。本研究为药用植物新疆一枝蒿的产地鉴别、质量评价体系建立提供了新的研究策略和研究基础。
关键词 新疆一枝蒿;植物代谢组学;液相色谱-串联质谱联用;产地标志物
1 引 言
新疆一枝蒿为菊科蒿属多年生草本植物岩蒿的全草,是常用的传统维吾尔医药用植物,主要分布于我国新疆维吾尔族自治区的天山山脉和阿勒泰山脉附近,一般生长在海拔1600~3000 m 的亚高山草原、针叶林开阔地[1]。新疆一枝蒿具有抗炎、抗菌、抗过敏、抗病毒、保肝等药理活性,药用价值很高[2]。以一枝蒿为主要成分制成的“复方一枝蒿冲剂”、“一枝蒿口服液”等复方制剂已经广泛应用于临床治疗荨麻疹、风热感冒及感冒引起的相关症状[3]。由于新疆一枝蒿独特的生态特性,其药材资源大多依靠野生采挖,但该植物自然繁殖极为困难。 近年来,由于被大量开发利用,加上矿山开采、过度放牧等原因,药材资源已经匮乏,因而,人工栽培品种受到重视与关注,逐渐被临床所采用。
前期研究表明,新疆一枝蒿全草中主要含有黄酮类[4]、倍半萜类[5,6]、生物碱类以及多糖和挥发油等[7,8]化合物。目前,已经提取分离并鉴定出一百余种化合物的结构。其中,一枝蒿酮酸的特征性成分是愈创木烷型倍半萜类化合物,对流感具有确切疗效[9]。在此基础上,针对一枝蒿酮酸单体进行结构修饰,获得其衍生物,有助于开发具有更高抗病毒活性与安全性的新药[10]。总体而言,关于新疆一枝蒿的研究,包括采用传统天然产物化学方法开展的针对某几种或某一类化学成分分离与鉴定[6]、提取工艺[11,12]和药效[13,14]等方面。然而,作为复杂的生物体,不同的生态因素或生长条件会对其包含初级代谢物和次级代谢物的整体成分产生扰动,进而影响其药理活性。迄今为止,对新疆一枝蒿物质基础进行全面性、系统性分析的研究仍然较少。
代谢组学是研究生物体系受外部刺激或扰动后所产生的内源性代谢物的整体及其变化规律的科学[15]。在植物学领域,代谢组学已经应用于探究高温、干旱等条件胁迫下生物体内代谢组的变化[16,17]。由于环境对于植物的生长发育具有十分重要的作用,因此,就药用植物而言,阐明生态因素对代谢组产生的影响,对于其药理活性和质量评价具有重要意义。此外,与传统天然产物化学分析方法相比,植物代谢组学不再以单一化合物或某类化合物的提取、分离、鉴定为研究目的,而是系统地研究植物中所有小分子化合物,具有高通量、高灵敏度等[18,19]优势。本研究组前期开展了新疆一枝蒿植物的代谢组学分析方法研究,建立了适用于该植物的前处理方法及其超高效液相色谱-串联质谱(Liquid chromatography tandem mass spectrometry,LC-MS/MS)分析方法,并且发现此植物不同组织器官的代谢组存在显著差异[20]。
本研究针对不同产地新疆一枝蒿物质基础一致性的问题,采用基于LC-MS/MS技术的代谢组学研究策略,对采集自阿勒泰富蕴和哈密两个地区的新疆一枝蒿植物,从人工栽培品种和野生品种两个角度,花、茎、枝叶样本3种层面,进行多维度代谢组分析,考察了特征活性成分在不同产地组中的含量水平,系统地探讨产地因素对此植物内源性代谢组产生的影响,筛选与产地相关的生物标志物,为新疆一枝蒿植物的产地鉴别、质量评价体系的建立提供了参考。
2 实验部分
2.1 仪器与试剂
Ultimate 3000 UHPLC型液相色谱仪、Q-OT-qIT杂合型质谱仪(美国Thermo公司);GAMMA 2-16 LSC冷冻干燥机、RVC 2-25 CDplus真空离心浓缩仪(德国Christ公司);5430 R离心机、ThermoMiser C混匀仪(德国Eppendorf公司);KQ3200E超声波清洗器(昆山市超声仪器有限公司);T10 standard高速分散机(德国IKA公司);0.22 μm滤膜(美国Agilent公司)。
化学对照品25种,分别为:蔓荆子黄素(Vitexicarpin,批号20150413)、芦丁(Rutinum,批号20151025)、一枝蒿酮酸(Rupestonic acid,批号20160329)、木犀草素(Luteolin,批号20151024)、异槲皮素(Isoquercitin,批号20160522)和洋艾素(Artemitin,批号20160813)均购于宝鸡辰光生物公司;金腰乙素(Chrysosplenetin,批号150920)购于成都克洛玛生物公司;蒙花苷(Linarin,批号111528-201509)、石吊兰素(Lysionotin,批号111555-200602)、香草酸(Vanicllic acid,批号110776-201503)、木犀草素-7-O-葡萄糖醛酸苷(Luteolin-7-O-glucuronide,批号111968-201301)和绿原酸(Chlorogenic acid,批号110753-201415)均购于中国食品药品检定研究院;栎草亭-7-O-葡萄糖苷(6-Hydroxyquercetin-7-O-β-D-glucopyranoside,批号17101215)、花旗松素(Taxifolin,批号17011204)、山奈酚(Kaempferol,批号17060213)、生松素(Pinocembrin,批号17120507)、芹黄素(Apigenin,批号17080101)、异鼠李素(Isohamnetin,批号17082910)、黄杞苷(Engeletin,批号17042803)、黄芩苷(Baicalin,批号17061323)、咖啡酸(Caffeic acid,批号17032701)、丁香酸(Syringic acid,批号17031705)、金丝桃苷(Hyperoside,批号16110215)、金合欢素(Acacetin,批号17040811)和山奈素(Kaempferide,批号17052403)均购于成都康邦生物公司。
乙腈和甲醇(HPLC级,德国Merck公司);甲酸(HPLC级,美国ROE公司);实验用水为纯净水(杭州娃哈哈有限公司)。
2.2 实验方法
2.2.1 樣品采集与制备 采用同年采集的新疆维吾尔族自治区阿勒泰富蕴县盛花期的人工栽培品种(以下简称F地区的人工品种,或FA)和野生品种(以下简称F地区的野生品种,或FW)新疆一枝蒿,哈密市盛花期的人工栽培品种(以下简称H地区人工品种,或HA)和野生品种(以下简称H地区野生品种,或HW)新疆一枝蒿。采集后立即置于干冰中暂存,并尽快转移至-80℃冰箱保存。取FA组、FW组、HA组和HW组的花、茎、枝叶样本各14份,在液氮中使用研钵研磨成粉末,并置于冷冻干燥机脱水48 h。称取50 mg 冻干粉末于匀浆管中,冰浴条件下,使用1 mL甲醇-水(80∶20,V/V)在高速分散器中提取3 min(25000 r/min,1 min;3000 r/min,1 min;25000 r/min,1 min)。超声10 min后,在4℃,以13500 r/min离心10 min,上清液置于真空离心浓缩仪中浓缩3 h。将浓缩物复溶于1 mL乙腈-水(50∶50,V/V),超声混匀后离心10 min,上清液过0.22 μm滤膜液,待测[21]。
质量控制(Quality control,QC)样品为各部位实际样品的等量混合样品,即来源于花、茎、枝叶的样品分别混合制成花-QC、茎-QC、枝叶-QC,用于监测分析系统的稳定性。
2.2.2 液相色谱和质谱条件 Acquity UPLC HSS T3色谱柱(100 mm × 2.1 mm,1.8 μm,Waters公司);水(含0.1%甲酸,A)和乙腈(含0.1%甲酸,B)为流动相;流速为0.3 mL/min,进样量为5 μL,柱温为40℃;洗脱梯度: 0~20 min,5%~50% B;20~27 min,50%~98% B;27~30 min,98% B。每次进样前,色谱柱用初始流动相平衡8 min。
离子源为电喷雾(Electrospray ionization,ESI)源;采用负离子检测模式;扫描模式为全扫描;扫描范围: m/z 100~1000;分辨率: 60000;喷雾电压:3 kV;鞘气: 35 psi(1 psi = 6.895 kPa);辅助气: 15 psi;离子源温度: 380℃。
2.2.3 分析顺序和数据处理 分析样品前测试空白溶剂样品,保证色谱柱及系统中无残留污染物干扰。连续进样10 次QC 样品,待仪器检测稳定后,开始实际样品检测。实际样品随机排列,并且每进样12种实际样品插入1种QC样品。
获得原始数据后,采用MM File conversion软件将数据格式由.RAW转换为.XML,并载入R语言xcms程序包进行峰识别、峰对齐、峰填充及峰过滤,获得包括质荷比(m/z)、保留时间及峰面积的二维数据阵。然后,将二维数据阵导入SIMCA-P(Version 14.0,Umetrics AB,Ume,Sweden)进行多变量统计分析,利用主成分分析(Principal component analysis,PCA)和正交偏最小二乘判别分析(Orthogonal partial least square discriminant analysis,OPLS-DA)构建模型。进一步选择VIP(Variable importance in projection)值大于1,即对分组贡献较大的变量;去除组内变异较大、组间交差严重的变量;再对两组独立样本进行t检验,选择p<0.05的变量;运用Pearson相关性分析进一步筛除加合离子、同位素离子及碎片离子,最终获得差异变量。根据差异代谢物的高分辨MS及MS/MS谱,结合已知特征成分的质谱裂解规律和代谢物数据库Metlin(http://metlin.scripps.edu)检索,确定差异代谢物的结构或结构类别。
3 结果与讨论
3.1 数据质量控制
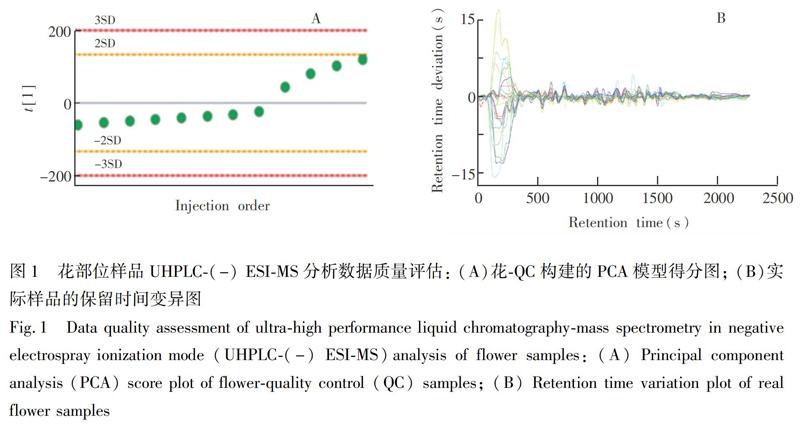
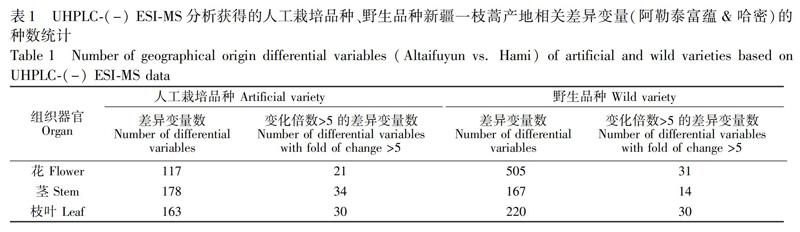
为了获得真实可靠的数据,本研究从以下两方面进行数据质量控制: (1)在ESI负离子模式下的UHPLC-MS(UHPLC-(-) ESI-MS)分析时,采用不同组间穿插进样、组内随机进样的方式进行检测;(2)通过绘制QC样品的PCA得分图和所有实际样品的保留时间变异图,考察检测系统的稳定性。以图1中花-QC样本构建的PCA得分图和花部位实际样品的保留时间变异图为例,所有花-QC样品的峰面积偏差在-2SD~2SD之间,并且实际样品的保留时间变异均在20~20 s内。茎、枝叶部位样品也满足同样的数据质量标准。结果表明,色谱系统的分离性能和稳定性良好,分析方法稳定、可靠,保证了后续数据处理得到的组间差异来自于不同产地新疆一枝蒿代谢组差异,而非人为失误或仪器系统的误差。
3.2 不同产地新疆一枝蒿代谢轮廓分析
图2为不同来源的新疆一枝蒿花、茎和枝叶样本的代表性总离子流色谱图。从整体轮廓上看,FW组和HW组样本的茎和枝叶部位体现出了显著差异。例如,从图2的FW和HW组的茎和叶局部放大图可见,保留时间8.0~16.0 min,F地区样本有色谱峰检出,而H地区几乎没有;相反地,保留时间24.0~28.0 min,H地区样本色谱峰强度显著高于F地区样本。茎的主要作用是将根吸收的水分和无机盐运输至其它器官,或将叶合成的有机养料自上而下运输至植株其它部位,而FW组和HW组样本植株生长的海拔不同,因此茎和枝叶代谢轮廓出现显著差异是合理的。在其它组别的样本中,以花为例,无论是人工品种,还是野生品种,不同产地样品的整体轮廓基本一致,但仍然存在明显的局部差异,如保留时间10.0~14.0 min区域。总之,不同产地新疆一枝蒿代谢轮廓存在差异,尤其体现在野生品种的茎和枝叶样本。
采用二维数据阵构建多变量统计模型,进一步对样本的产地差异进行分析。首先,构建无监督的PCA模型(见电子版文后支持信息图S1),在未知组别的情况下,不同产地的样本已经呈现出明显的分组分布,充分说明产地或生态条件对于新疆一枝蒿的代谢组具有影响。从组间区分的程度可知,FW组和HW组的花、茎、枝叶样本的组间距离比于FA组和HA组更大,与上述代谢轮廓表现出一致特征。推测可能是由于两种地区的野生品种生长地生态条件相差较远,而人工栽培时,因为人为因素的参与,植物的生长条件较为接近。为了获取引起组间分离的差异变量,构建了有监督的OPLS-DA模型。以FA和HA组的花部位样本为例,OPLS-DA模型经1种预测主成分和1种正交成分拟合后,49.4%(R2X)的变量可用于解释HA和H野生品种之间99.3%(R2Y)的差异,并经过交叉有效验证后的平均预测能力为93.8%(Q2Y)。进一步进行了相同主成分数的PLS-DA置换验证分析,经200次置换验证后,R2Y截距小于0.4,Q2Y截距小于0.05,表明所构建的OPLS-DA模型具有显著的统计学差异。其它各组样本之间构建的OPLS-DA模型均经过了交叉有效性验证和置换验证,保证了模型有效、可靠。
3.3 产地差异代谢物的筛选
根据已构建的OPLS-DA模型和课题组前期建立的差异变量筛选流程,最终获得的差异变量数以及差异倍数(Fold of change,FC)大于5的差异变量种数如表1所示。与上述结果基本一致,FW组和HW组样本之间的产地差异变量数整体上大于FA组和HA组之间的差异变量数。然后,对差异变量进行MS/MS分析及结构鉴定。以黄酮类化合物为例,从结构上看,此类化合物包含黄酮、异黄酮、黄酮醇、异黄酮醇、黄烷酮等多种苷元及其糖苷类化合物,具有明显的质谱裂解规律。在负离子模式下,如果黄酮的A环是5,7-OH取代,且B环上也有OH取代,A环可能发生断裂,生成[M-H-C3O2];C环发生开裂,会丢失C2H2O碎片(67.9893),产生[M-H-C2H2O];此外,当A环上含有5,7-OH取代时,C环可能发生RDA裂解,产生m/z 151.0013的特征子离子。异黄酮类化合物和黄酮类类似,A环可能发生断裂生成[M-H-C3O2],同时,A环若为5,7-OH取代或7-OH取代,容易失去CHO·(29.0022);若有OCH3取代,容易失去·CH3(15.0229)[21]。黃酮苷类化合物在其MS/MS谱中会出现苷元离子Y0-和自由基苷元离子[Y0-H],并可根据两者的相对强度判断糖基的取代位置[22]。此外,新疆一枝蒿中倍半萜化合物结构类型主要为愈创木烷型,以一枝蒿酮酸为代表,其结构上多有羧基取代[8],故在负离子模式下能够较好地电离并被检识,一枝蒿酮酸在TIC中的响应强度可达到109。MS/MS分析中,一枝蒿酮酸主要发生脱羧反应,产生m/z 203.1437([M-H-CO2])的特征子离子[7]。其二聚体主要发生RDA裂解,产生2个倍半萜单元碎片离子[23,24]。总结与归纳黄酮类化合物、一枝蒿酮酸、绿原酸的质谱裂解规律,对组间FC>5的代谢物进行结构类别的判断。
如图3A所示,在FA组和HA组比较分析中,花的产地差异代谢物共判别出13种化合物(4种黄酮类化合物、4种绿原酸类似物、5种一枝蒿酮酸衍生物),茎的产地差异代谢物共判别出8种化合物(2种黄酮类化合物、5种绿原酸类似物、1种一枝蒿酮酸衍生物),枝叶的产地差异代谢物共判别出8种化合物(4种黄酮类化合物、3种绿原酸类似物、1种一枝蒿酮酸衍生物)。如图3B所示,FW组和HW组比较分析中,花的产地差异代谢物共判别出23种(6种黄酮类化合物、12种绿原酸类似物、5种一枝蒿酮酸衍生物),茎的产地差异代谢物共判别出6种(3种黄酮类化合物2种绿原酸类似物1种一枝蒿酮酸衍生物),枝叶的产地差异代谢物共判别出16种化合物(8种黄酮类化合物、8种一枝蒿酮酸衍生物)。从上述已知结构类别的产地差异代谢物的聚类热图(图3)可知,人工品种中,差异代谢物多在H地区样本中具有更高含量,并且一枝蒿酮酸衍生物也较F地区更为丰富。类似地,大部分野生品种的产地差异代谢物也在H地区样本中表现出更高的丰度。
3.4 新疆一枝蒿已知代表性代谢物的靶向分析
非靶向分析中,差异变量的筛选需要经过多种步骤,例如,选择VIP>1的变量时,由于代谢物含量的尺度差异,高丰度代谢物对于模型的作用更大,加之背景噪音的影响,较低丰度的差异离子信息会被掩盖,从而丢失一些重要信息。因此,本研究另外选取了新疆一枝蒿中25种已知代表性代谢物,对其进行了靶向分析,以此更系统地考察不同产地的代谢物差异。代表性已知代谢物包含20种黄酮类、3种有机酸类、1种倍半萜类化合物和1种绿原酸。在负离子模式下,花、茎、枝叶样品中分别检测到18、16和11种。结合原始轮廓图和单变量统计分析,筛选出产地相关的已知代谢物,如表2所示。人工品种中,咖啡酸、蒙花苷、芦丁、金丝桃苷、花旗松素、木犀草素-7-O-葡萄糖苷、一枝蒿酮酸、生松素共8种已知代谢物具有显著的统计学差异。整体而言,上述代谢物在H地区样本中具有更高的含量,相比于F地区样本,大多高出2~3倍。野生品种中,蒙花苷、芹黄素、黄杞苷、山奈酚、花旗松素、生松素、异鼠李素、芦丁、金丝桃苷、一枝蒿酮酸、绿原酸共11种已知代谢物具有显著的统计学差异。与人工品种的情况相反,在野生品种中,大部分代谢物在F地区样本中具有更高含量,其中,蒙花苷的含量是H地区样本的20倍以上。
蒙花苷、芦丁在人工品种和野生品种中均被识别为产地差异代谢物,而且差异倍数较大,整合分析两个品种共4组数据发现,这两种代谢物在FW组中含量最高。蒙花苷有抗衰老、抗疲劳、抑制血糖升高作用[25]。芦丁具有抗炎、维持血管抵抗力、降低其通透性、减少脆性等作用,可用于防治脑溢血、高血压、视网膜出血、紫癜和急性出血性肾炎等疾病[26]。此外,特征有效成分一枝蒿酮酸在各组中含量差别不大,但是FW组中含量最高。
对比非靶向与靶向分析筛选出的产地差异代谢物发现,已知代谢物并未包含在结构未知的差异代谢物中,表明靶向分析为非靶向分析提供了补充作用,将两者结合,能够更加全面地评价代谢组差异。
综合上述分析结果,在人工品种中,通过非靶向分析筛选出29种产地差异代谢物,包括10种黄酮类代谢物、12种绿原酸类似物、7种一枝蒿酮酸衍生物;通过靶向分析筛选出8种已知产地差异代谢物。同理,在野生品种中,通过非靶向分析筛选出45种产地差异代谢物,包括17种黄酮类代谢物、14种绿原酸类似物、14种一枝蒿酮酸衍生物;通过靶向分析筛选出11种已知产地差异代谢物。由此,建立了人工品种新疆一枝蒿植物的产地标志物组,包括37种代谢物;野生品种新疆一枝蒿植物的产地标志物组,包括56种代谢物。
4 结 论
针对阿勒泰富蘊地区和哈密地区的新疆一枝蒿植物物质基础是否一致的问题,采用基于UHPLC-MS/MS技术的代谢组学分析方法,从人工栽培品种和野生品种两种角度,花、茎、枝叶3个层面,开展系统研究;同时针对新疆一枝蒿中25种已知代表性代谢物进行了靶向分析。结果表明,产地因素对于其代谢组具有影响,并且对于野生品种的影响大于人工品种。结合非靶向与靶向分析,建立了两种品种新疆一枝蒿植物的产地标志物组,可用于产地鉴别或质量评估。本研究结果为后期新疆一枝蒿的质量评价体系的建立提供了新的研究思路和分子学研究基础。
References
1 FANG Xian-Feng. Xinjiang Chemical Industry,2017,(3-4): 5-9
方险峰. 新疆化工,2017,(3-4): 5-9
2 LIU Yong-Min,SHAWUTI-Yikemu,Annals of Uygur Medicine (Part I). Urumqi: Xinjiang people's publishing house,1986,(7): 1-3
刘勇民,沙吾提·伊克木. 维吾尔药志(上). 乌鲁木齐: 新疆人民出版社,1986,(7): 1-3
3 TAO Hai-Ying,SUN Yu-Hua,HU Zheng-Mei,LIU Fa. Chinese Medicine Pharmacology and Clinic,2007,23(2): 64-66
陶海英,孙玉华,胡正梅,刘 发. 中药药理与临床,2007,23(2): 64-66
4 LIU Yong-Min,YU De-Quan. Chinese Journal of Pharmacy,1985,39(7): 310-313
刘勇民,于德泉. 药学学报,1985,39(7): 310-313
5 SONG Wei-Xia,JI Teng-Fei,SI Yi-Kang,SU Ya-Lun. Chinese Journal of Traditional Chinese Medicine,2006,31(21): 1790-1792
宋卫霞,吉腾飞,司伊康,苏亚伦. 中国中药杂志,2006,31(21): 1790-1792
6 JI Teng-Fei,YANG Jian-Bo,SONG Wei-Xia,WANG Ai-Guo,SU Ya-Lun,YUAN Ling. Chinese Journal of Traditional Chinese Medicine,2007,32(12): 1187-1189
吉腾飞,杨建波,宋卫霞,王爱国,苏亚伦,袁 玲. 中国中药杂志,2007,32(12): 1187-1189
7 Gu D,Yang Y,Abdulla R,Aisa H A. Rapid Commun. Mass Spectrom.,2012,26(1): 83-100
8 Zhang C,Wang S,Zeng K W,Cui F X,Jin H W,Guo X Y,Jiang Y,Tu P F. Bioorg. Med. Chem. Lett.,2014,24(17): 4318-4322
9 YONG Jian-Ping,HAJI AKBER Aisa. Computers and Applied Chemistry,2011,28(5): 535-539
雍建平,阿吉艾克拜尔·艾萨. 计算机与应用化学,2011,28(5): 535-539
10 HAJI AKBER Aisa,YONG Jian-Ping,ZHAO Jiang-Yu. US Patent,US 12/585447,2013
阿吉艾克拜尔·艾萨,雍建平,赵江瑜. 美国专利,US 12/585447,2013
11 Su Z,Wu H K,He F,Usmanova S,Asia H A. Helv. Chim. Acta,2010,93(1): 33-38
12 Fang M Z,Chao Q F,Lan Y,Liu X M,Xu X,Fan Y H,Zhang F C. Food Sci.,2010,31(16): 83-86
13 LI Zhi-Jian,GU Li-Na,SIRAFI Ai-Bai. Pharmacology and Clinics of Chinese Materia Medica,2012,28(3): 149-150
李治建,古力娜,斯拉甫·艾白. 中药药理与临床,2012,28(3): 149-150
14 WAN Ying-Jie,XIA Jian-Xin,TANG Li. Chinese Journal of Traditional Chinese Medicine,2017,42(23): 4565-4573
万英洁,夏建新,唐 丽. 中国中药杂志,2017,42(23): 4565-4573
15 Nicholson J K,Lindon J C,Holmes E. Xenobiotica,1999,29(11): 1181-1189
16 Wienkoop S,Morgenthal K,Wolschin F,Scholz M,Selbig J,Weckwerth W. Mol. Cell. Proteomics,2008,7(9): 1725-1736
17 Grimplet J,Wheatley M D,Jouira H B,Deluc L C,Cramer G R,Cushman J C. Proteomics,2009,9(9): 2503-2528
18 Mao X X,He J M,Li T G,Lu Z H,Sun J,Meng Y X,Zeper A,Chen J. Sci. Rep.,2016,6: 21043
19 Holzlechner M,Strasser K,Zareva E,Steinhuser L,Birnleitner H,Beer A,Bergmann M,Oehler R,Deschmann M M. J. Proteome Res.,2017,16(1): 65-76
20 CHEN Lu-Lu,WANG Zhong-Hua,ZHOU Zhi,HE Bing-Shu,HE Jiu-Ming,HUANG Luo-Jiao,NURBOLAT Aidarhan,LIU Ge-Yu,HAJIAKBER Aisa,ZEPER Abliz. Chinese J. Anal. Chem.,2018,46(5): 735-742
陳路路,王中华,周 帜,何秉淑,贺玖明,黄罗娇,努尔波拉提·阿依达尔汗,刘戈宇,阿吉艾克拜尔·艾萨,再帕尔·阿不力孜. 分析化学,2018,46(5): 735-742
21 LIU Guo-Qiang,DONG Jing,WANG Hong,WAN Le-Ren,DUAN Yu-Shu,CHEN Shi-Zhong. Journal of Chinese Mass Spectrometry Society,2009,30(5): 287-294
刘国强,董 静,王 弘,万乐人,端裕树,陈世忠. 质谱学报,2009,30(5): 287-294
22 Ablajan K,Abliz Z,Shang X Y,He J M,Zhang R P,Shi J G. J. Mass Spectrom.,2006,41(3): 352-360
23 Ye J,Qin J J,Su J,Lin S,Huang Y,Jin H Z,Zhang W D. Rapid Commun. Mass Spectrom.,2013,27(19): 2159-2169
24 Zhang C,Wang S,Zeng K W,Li J,Ferreira D,Zjawiony J K,Liu B Y,Guo X Y,Jin H W,Jiang Y,Tu P F. J. Nat. Prod.,2016,79(1): 213-223
25 Chinese Pharmacopoeia. Part I,2000: 269
中国药典(第一部),2000: 269
26 ZANG Zhi-He,CAO Li-Ping,ZHONG Ling. Chinese Journal of Medicine,2007,26(7): 758-760
臧志和,曹丽萍,钟 铃. 医药导报,2007,26(7): 758-760
