阳离子化荧光金纳米簇的合成及siRNA递送研究
2020-07-04胡献丽朱琳嶺李苓菱徐志爱张文
胡献丽 朱琳嶺 李苓菱 徐志爱 张文
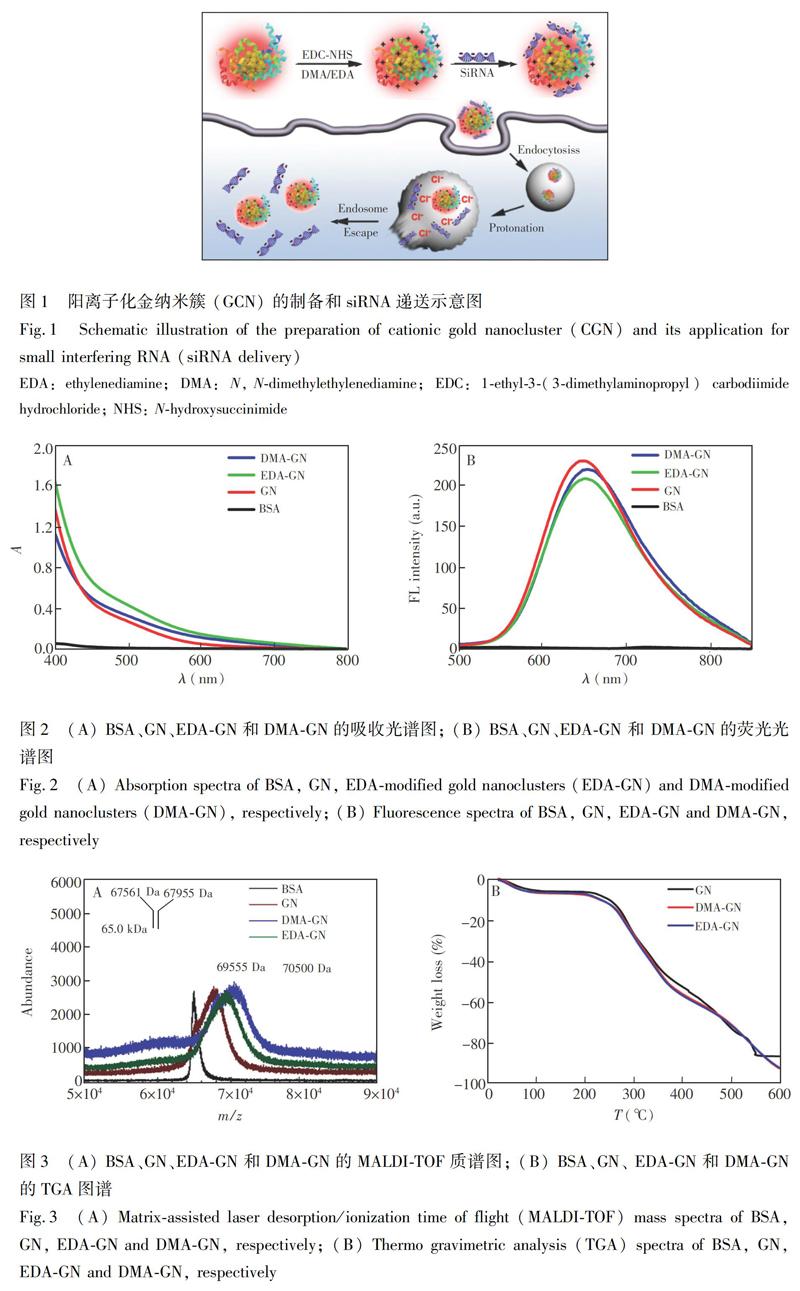

摘 要 基于Small interfering RNA(siRNA)的RNA干扰(RNA interference,RNAi)策略已经成为生物医学研究的常规手段,而通常采用的基于聚阳离子或阳离子磷脂的siRNA递送系统递送效率低、细胞毒性高,而且缺少示踪功能,严重制约了siRNA药物临床转化。为克服传统siRNA递送载体的不足,本研究发展了一种新型siRNA荧光纳米递送系统。首先利用牛血清白蛋白为模板,通过生物矿化策略合成具有近红外荧光发射的金纳米簇(Gold nanocluster,GN),利用乙二胺(Ethylenediamine,EDA)或N,N-二甲基乙二胺(N,N'-Dimethylethylenediamine,DMA)對GN进行共价修饰,得到阳离子化金纳米簇(Cationic gold nanocluster,CGN),同时实现siRNA高效递送和荧光示踪。然后,以表达绿色荧光蛋白(Green fluorescence protein,GFP)的肺癌A549细胞(A549-GFP)为细胞模型,验证了CGN可实现siRNA高效递送,并沉默A549-GFP细胞的GFP表达;进一步利用共聚焦激光扫描显微镜实现了GN细胞分布的荧光示踪。本研究结果表明,CGN有望用作siRNA递送载体和示踪探针。
关键词 siRNA;金纳米簇;阳离子化;荧光示踪;递送载体
1 引 言
Small interfering RNA(siRNA)是具有21~25个核苷酸序列的短链RNA。基于siRNA的RNA干扰技术(RNA interference,RNAi)可特异性降解信使RNA(Messenger RNA,mRNA),沉默目标基因的蛋白表达,已在生物医学基础研究和疾病治疗方面发挥了重要作用[1~4],针对RNA干扰机制的基础研究获得了2006年诺贝尔生理或医学奖。近年来,针对杜氏肌营养不良症、脊髓性肌萎缩症和遗传性转甲腺素蛋白淀粉样变性等疾病的siRNA药物已陆续获准上市[5,6]。尽管siRNA药物已取得较大进展,但由于其具有较大分子量,而且带有负电荷,不能主动跨越细胞膜进入细胞内,siRNA药物的高效递送仍是制约siRNA药物临床转化的主要瓶颈[7,8]。
非病毒阳离子载体(主要包括阳离子聚合物和阳离子脂质体)可通过静电相互作用,与负电性siRNA形成纳米级复合物,实现siRNA的细胞及活体高效递送[9~11]。但是,常规阳离子载体通常缺乏成像功能,不便于监控siRNA在细胞及体内的转染过程。 开发具有成像功能的siRNA递送系统备受关注[12,13]。在各种成像方式中,利用荧光探针的光学成像方式具有背景干扰小、 空间分辨率高、 可避免电离辐射等优点,是生物成像应用的优先选择。 通常使用的有机小分子荧光探针可标记递送载体,但有机小分子染料光稳定性较差,易光漂白,限制了其广泛应用[14~16]。半导体量子点的荧光量子产率高于传统有机荧光染料,而且具有更好的光稳定性及更窄的荧光发射光谱,已被用于siRNA胞内递送及荧光成像。然而,量子点因为生物降解性差而导致的生物安全性问题,严重制约了其生物医学转化[17~20]。随着量子局限团簇技术的发展,科研人员开始开发基于贵金属的纳米团簇(Metal nanocluster,MN)。MN具有粒子尺寸小、荧光寿命长、稳定性好及毒性低等优点,已被广泛用于生物成像探针方面的研究[21~23]。其中,荧光金纳米簇(Gold nanocluster,GN)由于荧光性能独特、化学稳定性高、生物相容性好,在疾病标志物及特异性信号分子的荧光检测方面具有良好的应用前景[24~26]。在GN的制备方法中,以蛋白质为模板材料,利用仿生矿化策略合成的GN既能留了蛋白质模板的三维结构,又能在较宽的pH范围内保持稳定。目前,基于牛血清白蛋白(Bovine serum albumin,BSA)、胰蛋白酶、胰岛素、溶菌酶合成的GN已广泛用于细胞核靶向、癌细胞成像及离子传感等多个方面[27~32],但是,由于以蛋白质为模板合成的GN通常带负电,难以负载siRNA,所以GN用于siRNA递送方面的应用鲜见报道[33]。
本研究以BSA为模板,合成了具有近红外荧光发射特性的GN,并通过共价作用进行阳离子修饰,获得的荧光阳离子化金纳米簇(Cationic gold nanocluster,CGN)用于siRNA高效递送及荧光示踪。在中性条件下,siRNA带负电,可通过静电相互作用吸附在CGN表面,形成纳米复合物。此纳米复合物经细胞摄取后进入酸性内涵体,CGN利用“质子海绵”效应[34~37]使内涵体破裂并释放siRNA,实现siRNA的胞浆递送,并高效沉默目标基因。以稳定表达绿色荧光蛋白(Green fluorescence protein,GFP)的A549肺癌细胞(A549-GFP)为细胞模型,证实了CGN可将siRNA高效输送至A549-GFP细胞中,并有效抑制GFP表达;同时,利用CGN的荧光成像功能考察了siRNA/CGN纳米复合物在细胞内的分布行为。初步研究结果表明,CGN有望用于siRNA胞内递送和荧光示踪。
2 实验部分
2.1 仪器与试剂
Cary 60紫外-可见光谱仪、Cary Eclipse荧光光谱仪(美国Agilent公司);Omniflex飞行时间质谱(Matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF MS,德国Bruker公司);热重分析仪(Thermal gravimetric analyzer,TGA,日本Shimadzu公司);NanoSizer动态光散射仪(Dynamic light scattering,DLS,英国Malvern公司);Fluoview FV-1000共聚焦激光扫描显微镜(Confocal laser scanning microscopy,CLSM,日本Olympus公司);凝胶成像仪(Chemi Doc MP System,美国Bio-Rad公司);JEM-2100F透射电子显微镜(Transmission electron microscopy,TEM,日本电子株式会社)。
BSA、乙二胺(Ethylenediamine,EDA)、N,N-二甲基乙二胺(N,N'-Dimethylethylenediamine,DMA)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(1-[3-(Dimethylamino)propyl]-3-ethylcarbodiimide hydrochloride,EDC·HCl)、N-羟基琥珀酰亚胺(N-Hydroxysuccinimide,NHS)、氯金酸(Chloroauric acid,HAuCl4)和3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT,Sigma-Aldrich公司);Lipo-2000、Hoechst 33342、Lysotracker green和Gibco胎牛血清(Thermo Fisher Scientific公司);透析袋(截留分子量3.0 kDa,Spectrum Laboratories 公司);其它化学试剂均为分析纯试剂,购于国药集团化学试剂有限公司。所有的玻璃仪器使用前均用浓HCl-浓HNO3(3∶1,V/V)洗净,然后用乙醇和超纯水冲洗。siRNA-GFP、siRNA-NC及siRNA-NC-Cy3序列购于Takara生物工程有限公司(大连)。
siRNA序列如下: siRNA-GFP: 5'-GGC TAC GTC CAG GAG CGC ACC-3';siRNA-NC: 5'-CGG UGA GCC AGG CGU GCA AUU-3'。
2.2 GN的合成
参照文献[27]的方法合成GN,具体过程如下:在37℃恒温和剧烈搅拌(900~1000 r/min)下,向5 mL BSA溶液(50 mg/mL)中,迅速加入5 mL HAuCl4溶液(10 mmol/L),反应2 min后,快速加入0.5 mL NaOH溶液(1.0 mol/L),在37℃下搅拌(900~1000 r/min)12 h,最终得到棕色的GN胶体溶液。
2.3 GN的阳离子化修饰
将EDA(0.65 mL,10 mmol)或DMA(0.65 mL,10 mmol)溶液用6.0 mol/L HCl调节至pH 4.8,然后加入新制备的GN,并加入18.1 mg EDC/11.0 mg NHS(94 μmol),室温搅拌2 h。然后,溶液用醋酸缓冲液调节至pH 4.75,用5 μm 的滤膜过滤反应液,接着用截留分子量为30 kDa的离心超滤管离心(5000 g,30 min,15℃)除去未反应物质,最后,用去离子水透析纯化。纯化后的溶液冷冻干燥,得到棕色固体即为DA或DMA共价修饰的CGN。
2.4 电泳分析
利用琼脂糖凝胶电泳迁移法检测CGN负载siRNA能力。使用TAE缓冲液(40 mmol/L Tris-acetate,1.0 mmol/L EDTA,pH 8.0)制备1.0%(w/V)琼脂糖胶,300 ng siRNA分别与不同浓度的GN混合,外加80 V电压作用20 min,然后进行凝胶成像。
2.5 细胞培养
A549非小细胞肺癌细胞从中国科学院上海细胞库获得。采用慢病毒载体转染方式构建GFP稳定表达的A549稳转株(A549-GFP)[38]。A549和A549-GFP细胞使用含有10%胎牛血清、100 μg/mL硫酸链霉素和100 U/mL 青霉素钠的DMEM高糖细胞培养基,在37℃恒温、 5%CO2的湿润培养箱中培养。
2.6 体外细胞毒性评价
将A549细胞以3.5 × 103细胞/孔的密度接种于96孔细胞培养板中,每孔加100 μL培养基。孵育24 h后,加入不同质量浓度的GN或CGN,继续培养24 h,利用MTT法测定细胞存活率。
2.7 siRNA转染实验及GN的细胞分布
将A549-GFP细胞置于24孔细胞培养板孔内的10 mm2 盖玻片上培养,密度为5.0 × 104细胞/孔,经过24 h预培育后,加入负载了siRNA-GFP的CGN(siRNA/CGN质量比为1∶20,siRNA浓度为1.0 μg/mL),并以混合相同含量siRNA的商业转染试剂Lipo-2000混合物作为对照,Lipo-2000用量参照使用说明。继续孵育48 h,培养好的细胞先用PBS清洗,然后用4%(V/V)多聚甲醛固定。使用共聚焦激光扫描显微镜进行细胞成像,计算A549-GFP细胞的GFP沉默效率。
为了考察GN和siRNA的胞内分布行为,将A549细胞以5.0 × 104细胞/孔的密度在24孔细胞培养板孔内的10 mm2 盖玻片上培养。经过24 h预培育后,加入负载Cy3-siRNA-NC的CGN(siRNA/CGN质量比为1∶20),siRNA浓度为1.0 μg/mL。继续孵育12 h后,用Hoechst-33342和Lysotracker-Green (DND-26,75 nmol)染色30 min。培养好的细胞先用PBS清洗,然后用4%(V/V)多聚甲醛固定。用共聚焦激光扫描显微镜进行细胞成像。滤光片设置Hoechst-33342 (Ex=360 nm,Em=450 nm)、Lysotracker-Green (Ex= 488 nm,Em= 515 nm)、CGN (Ex= 360 nm,Em= 675 nm (far-red))和Cy3 (Ex=543 nm,Em= 595 nm)。
3 結果与讨论
3.1 CGN复合物的合成及siRNA负载原理
蛋白质保护的GN生物相容性良好,荧光性质稳定,荧光发射波长可调,而且可发射近红外荧光[39,40]。基于此,本研究利用BSA生物矿化合成的GN进行阳离子化修饰,并用作siRNA的
递送载体。阳离子化的GN(DMA/EDA-GN)的制备过程及对siRNA的递送原理如图1所示。在碱性条件下,以BSA为模板时,HAuCl4被还原,合成可发射近红外荧光的GN[27]。在EDC/NHS的活化作用下,EDA或DMA能与GN表面BSA上的谷氨酸等残基反应,使BSA-GN阳离子化。siRNA呈负电性,即可通过静电作用吸附在CGN表面,从而实现对siRNA的有效负载。负载了siRNA的纳米复合物进入细胞后,细胞内的酸性pH环境使EDA或DMA上的胺基质子化,产生“质子海绵”效应[34~37],破环内涵体,释放siRNA,有效沉默靶基因。
3.2 DMA/EDA-GN复合物的表征
3.2.1 吸收及荧光光谱表征 首先对合成的GN和CGN进行吸收及荧光光谱表征。如图2A所示,BSA在400~800 nm的波长区间内无明显吸收峰,并在480 nm光激发下不发射荧光。本研究中,BSA同时作为模板和保护剂,合成的GN在480 nm附近出现特征吸收峰,且在480 nm光激发下,650 nm波长附近出现较强的荧光发射,800 nm附近仍有荧光,证明成功制备出了近红外GN。而GN经阳离子化后,其吸收光谱保持不变,480 nm光激发时仍然有较强的荧光,最大荧光发射波长略有红移(图2B)。
3.2.2 MALDI-TOF 质谱及热重(TGA)分析
采用MALDI-TOF质谱分析了DMA/EDA-GN纳米复合物的组成。由图3A可知,BSA的分子量为65.0 kDa。经过生物矿化合成GN后,GN的分子量变为67955 Da,数值增加了2955 Da,根据文献[27,41]的方法计算可得BSA包裹金原子的数量为15。共价修饰DMA后,纳米复合物质量增加至70500 Da,由此计算得GN上DMA的连接数量为37,同样地,可分析出EDA的连接数为38。进一步利用热TGA法分析DMA/EDA-GN纳米复合物的组成。金原子化学性质稳定,耐高温,因此,当DMA/EDA-GN纳米复合物经600℃高温处理后,有机组分DMA、EDA和BSA均被高温分解,最终剩余物质为金。热重分析结果(图3B)显示,GN的热降解率为90%,DMA/EDA-GN的热降解率约为95%,与质谱分析结果一致。
3.2.3 DLS和TEM表征 本研究合成的GN为稳定的淡棕色溶液,通过DLS考察了其阳离子化前后纳米复合物的尺寸。如图4A所示,溶液条件下的GN粒径约为8 nm,分散较为均匀,经过DMA/EDA修饰的CGN粒径略微增大,约为10 nm,没有发生明显团聚。从TEM图(图4B)可知,修饰后的GN仍为均匀分散的球形,表明阳离子化过程不影响GN的形貌。3种GN长时间放置后仍保持稳定。
3.2.4 Zeta电位及电泳分析 进一步利用Zeta电位分析仪考察了DMA/EDA-GN纳米
复合物修饰前后的电位变化。由于BSA在中性条件下带负电,BSA合成的GN表面也呈负电性,测得Zeta电位值为(19.8 ± 1.7) mV。经过DMA/EDA修饰后,表面电位发生了很大变化:由负电性反转为正电性,分别变为(30.9 ± 1.5) mV和(28.9 ± 0.9) mV,复合物表面带正电,说明DMA和EDA的成功修饰。因此,带正电的纳米复合物表面可成功负载带负电的siRNA。通过凝胶电泳考察了CGN负载siRNA的能力。
由图5可知,带负电的GN难以负载siRNA,即使将GN与siRNA的质量比增加至60∶1,也无法负载siRNA,阻止siRNA迁移。然而,将GN阳离子化修饰后,基于正负电荷的较强静电作用,CGN和siRNA在质量比为10∶1时,便可有效负载siRNA,当CGN/siRNA的质量比增加至60∶1时,CGN可完全阻止siRNA迁移。电泳实验表明,DMA/EDA-GN可有效负载siRNA,有望用于siRNA递送。
3.2.5 细胞毒性分析 siRNA递送载体的细胞毒性对其临床应用至关重要。将A549肺癌细胞分别与GN、EDA-GN和DMA-GN孵育24 h,采用MTT法评价GN的细胞毒性,结果如图6所示。GN具有良好的生物相容性,在浓度为250 g/mL时,细胞仍然保持80%的代谢活力。修饰EDA/DMA后,EDA-GN和DMA-GN组的细胞存活率约下降10%,阳离子化修饰并未显著增大GN的细胞毒性。
3.3 细胞对siRNA/CGN复合物的摄取及分布研究
细胞实验中,选取野生型A549细胞为模型,使用共聚焦激光扫描显微镜(CLSM)研究siRNA/CGN纳米复合物的细胞摄取及分布行为。采用Cy3标记的siRNA-NC对siRNA进行定位,使用细胞核染色剂Hoechst 33342对细胞核进行定位。首先考察siRNA和GN在细胞内的分布,如图7A所示,在A549细胞中可同时发现Cy3的荧光信号和DMA-GN的荧光信号,且两者存在共定位,表明细胞成功摄取了siRNA/CGN纳米复合物。为了证实细胞对siRNA的摄取,使用Hoechst 33342对细胞核进行定位。如图7B所示,Cy3-siRNA和CGN分布在细胞核周围,进一步表明CGN可实现对siRNA的有效胞内递送。另外,研究表明,非病毒载体成功递送siRNA的瓶颈在于能否实现内涵体逃逸。如负载的siRNA不能从内涵体中及时释放,将被转运到溶酶体,并被溶酶体内的酶降解,失去活性[42,43]。为了证实CGN载送的siRNA可实现内涵体逃逸,进一步利用Lysotracker green對溶酶体进行定位。游离Cy3-siRNA和A549细胞共孵育后,细胞内未观察到Cy3红色荧光,表明游离siRNA无法进入细胞。相反,DMA-GN可将siRNA高效递送到细胞内。特别是DMA-GN组的Cy3和Lysotracker green的荧光信号呈分离状态,表明siRNA可从内涵体逃逸到胞浆,避免溶酶体降解(图7C和7D)。
3.4 GFP基因沉默研究
以A549-GFP细胞为细胞模型,考察了DMA-GN和 EDA-GN的基因转染效率。siRNA-GFP可有效抑制GFP基因表达,将siRNA-GFP/CGN纳米复合物与A549-GFP 肺癌细胞共孵育,通过GFP基因表达研究其基因沉默效率。如图8所示,未处理细胞组中的所有细胞均可观察到绿色荧光表达。商品化转染试剂Lipo-2000组可高效递送siRNA,使得GFP阳性率约下降50%。但是,Lipo-2000处理组细胞数量显著减少,且细胞呈圆球状,表明Lipo-2000对细胞有毒副作用。使用与Lipo-2000组同等剂量的siRNA,siRNA-GFP/EDA-GN或siRNA-GFP/DMA-GN组的GFP蛋白阳性率分别下降到42.0%±5.0%和28.7%±2.5%。DMA-GN组的GFP沉默效率约为Lipo-2000阳性对照组的2倍,但细胞数目较多,而且状态与未处理组相近,表明CGN不仅细胞毒性比Lipo-2000小,且对siRNA-GFP的转染效率高,有望用于siRNA高效递送。同时,DMA-GN的siRNA转染能力显著高于EDA-GN,可能与二甲基胺的质子缓冲能力和内涵体逃逸能力相关[44]。
4 结 论
基于GN的易合成、生物相容性好以及具有稳定的近红外荧光发射等特性,利用胺类化合物对其进行阳离子化修饰,制备CGN,成功实现了siRNA的有效载送和荧光示踪。将siRNA/CGN作用于A549-GFP肺癌细胞后,可有效沉默GFP基因表达,使GFP基因表达率降至28.7%,其抑制效果接近商业转染试剂Lipo-2000。相比于Lipo-2000,siRNA/CGN复合物的細胞毒性较低,A549细胞受到的影响较少。因此,此siRNA递送体系具有制备简单、生物相容性好、载送效率高等优点,为siRNA基因递送及疾病治疗提供了更多的可能。
References
1 Elbashir S M,Harborth J,Lendeckel W,Yalcin A,Weber K,Tuschl T. Nature,2001,411(6836): 494-498
2 Mello C C,Conte D. Nature,2004,431(7006): 338-342
3 de Fougerolles A,Vornlocher H P,Maraganore J,Lieberman J. Nat. Rev. Drug Discovery,2007,6(6): 443-453
4 Resnier P,Montier T,Mathieu V,Benoit J P,Passirani C. Biomaterials, 2013,34(27): 6429-6443
5 Shen X L,Corey D R. Nucleic Acids Res.,2018,46(4): 1584-1600
6 Zhang X P,Goel V,Robbie G J. J. Clin. Pharmacol.,2019,DOI: 10.1002/jcph.1553
7 Cooper B M,Putnam D. ACS Biomater. Sci. Eng.,2016,2(11): 1837-1850
8 Lchelt U,Wagner E. Chem. Rev., 2015,115(19): 11043-11078
9 Blagbrough I S,Metwally A A,Ghonaim H M. Mol. Pharmaceut.,2012,9(7): 1853-1861
10 Liu L,Zheng M Y,Librizzi D,Renette T,Merkel O M,Kissel T. Mol. Pharmaceut.,2016,13(1): 134-143
11 Patil M L,Zhang M,Minko T. ACS Nano,2011,5(3): 1877-1887
12 Nuhn L,Hirsch M,Krieg B,Koynov K,Fischer K,Schmidt M,Helm M,Zentel R. ACS Nano,2012,6(3): 2198-2214
13 Mudd S R,Trubetskoy V S,Blokhin A V,Weichert J P,Wolff J A. Bioconjugate Chem.,2010,21(7): 1183-1189
14 Wu C F,Bull B,Szymanski C,Christensen K,McNeill J. ACS Nano,2008,2(11): 2415-2423
15 Nie H L,Jing J,Tian Y,Yang W,Zhang R B,Zhang X L. ACS Appl. Mater. Interfaces,2016,8(14): 8991-8997
16 Kobayashi H,Ogawa M,Alford R,Choyke P L,Urano Y. Chem. Rev.,2010,110(5): 2620-2640
17 Qi L F,Gao X H. ACS Nano,2008,2(7): 1403-1410
18 Derfus A M,Chen A A,Min D H,Ruoslahti E,Bhatia S N. Bioconjugate Chem.,2007,18(5): 1391-1396
19 Lee H,Kim I K,Park T G. Bioconjugate Chem.,2010,21(2): 289-295
20 Maity S,Bain D,Patra A. J. Phys. Chem. C, 2019,123(4): 2506-2515
21 Jin R C. Nanoscale,2010,2(3): 343-362
22 Zheng J,Nicovich P R,Dickson R M. Annu. Rev. Phys. Chem.,2007,58(1): 409-431
23 Diez I,Ras R H. Nanoscale,2011,3(5): 1963-1970
24 Wang Y L,Xu C,Zhai J,Gao F P,Liu R,Gao L,Zhao Y L,Chai Z F,Gao X Y. Anal. Chem.,2015,87(1): 343-345
25 Wang Y L,Cui Y Y,Zhao Y,Liu R,Sun Z P,Li W,Gao X Y. Chem. Commun.,2012,48(6): 871-873
26 An D Y,Su J G,Weber J K,Gao X Y,Zhou R H,Li J Y. J. Am. Chem. Soc.,2015,137(26): 8412-8418
27 Xie J P,Zheng Y G,Ying J Y. J. Am. Chem. Soc.,2009,131(3): 888-889
28 Wei H,Wang Z D,Yang L M,Tian S L,Hou C J,Lu Y. Analyst,2010,135(6): 1406-1410
29 Liu C L,Wu H T,Hsiao Y H,Lai C W,Shih C W,Peng Y K,Tang K C,Chang H W,Chien Y C,Hsiao J K,Cheng J T,Chou P T. Angew. Chem. Int. Ed.,2011,50(31): 7056-7060
30 Thakur N S,Mandal N,Banerjee U C. ACS Omega,2018,3(12): 18553-18562
31 Li Z,Peng H,Liu J,Tian Y,Yang W,Yao J,Shao Z,Chen X. ACS Appl. Mater. Interfaces, 2018,10(1): 83-90
32 Wang Y,Chen J,Irudayaraj J. ACS Nano,2011,5(12): 9718-9725
33 Lei Y F,Tang L X,Xie Y Z,Xianyu L X,Zhang L M,Wang P,Hamada Y,Jiang K,Zheng W F,Jiang X Y. Nat. Commun.,2017,8: 15130
34 Nel A E,Madler L,Velegol D,Xia T,Hoek E M V,Somasundaran P,Klaessig F,Castranova V,Thompson M. Nat. Mater.,2009,8(7): 543-557
35 Remaut K,Sanders N N,Geest B G D,Braeckmans K,Demeester J,Smedt S C D. Mat. Sci. Eng.,2007,58(3-5): 117-161
36 Behr J P. CHIMIA,1997,51(1-2): 34-36
37 Varkouhi A K,Scholte M,Storm G,Haisma H J. J. Control. Release,2011,151(3): 220-228
38 Li N,Yang Y,Ding M,Huang W D,Li H G,Ye J,Xiao J,Zha X L,Xu H N. Mol. Biotechnol.,2014,56(12): 1079-1088
39 Shang L,Dong S J,Nienhaus G U. Nano Today,2011,6(4): 401-418
40 Lu Y Z,Chen W. Chem. Soc. Rev.,2012,41(9): 3594-3623
41 Dichiarante V,Tirotta I,Catalano L,Terraneo G,Raffaini G,Chierotti M R,Gobetto R,Bombelli F B,Metrangolo P. Chem. Commun., 2017,53(3): 621-624
42 Dominska M,Dykxhoorn D M. J. Cell Sci.,2010,123(8): 1183-1189
43 Wittrup A,Ai A,Liu X,Hamar P,Trifonova R,Charisse K,Manoharan M,Kirchhausen T,Lieberman J. Nat. Biotechnol.,2015,33(8): 870-876
44 Yu H J,Guo C Y,Chen X,Feng B,Liu J P,Chen X Z,Wang D G,Teng L S,Li Y X,Yin Q,Zhang Z W,Li Y P. Theranostics,2016,6(1): 14-27
