乳腺浸润性导管癌BRCA1/2基因变异与肿瘤突变负荷相关
2020-07-04廖健伟吴畏李晓娟萧晓琴蒋圆玲彭小芳欧阳能太
廖健伟, 吴畏, 李晓娟, 萧晓琴, 蒋圆玲, 彭小芳, 欧阳能太*
乳腺癌是女性最常见的恶性肿瘤[1],可分为浸润性和非浸润性。其中浸润性导管癌占了乳腺癌患者的绝大多数,以ER、PR、HER2为基础的分子分型对此类乳腺癌内分泌治疗和靶向治疗有明确指导作用,然而其晚期治疗效果有待进一步提升。近年来,以免疫检查点抑制剂为代表的免疫治疗备受关注,2019年PD⁃L1抑制剂Atezolizumab被FDA批准应用于转移性三阴性乳腺癌的治疗。然而,包括乳腺癌在内多种实体肿瘤采用免疫治疗的平均应答率只有20%左右,挖掘免疫治疗的疗效预测因子至关重要。肿瘤突变负荷(TMB)作为极具潜力的免疫疗效预测因子,已列入非小细胞肺癌NCCN指南。TMB是指在基因组DNA每百万碱基中被检测出的体细胞基因变异总数,包含碱基替换、插入或缺失等变异。经典的检测TMB方法是用全外显子组测序,检测2万多个基因的全外显子区,检测成本较高,然而以FoundationOne为代表的多基因靶向测序也可计算TMB,成本相对较低,临床相对容易推广。最近美国FDA受理了PD1抑制剂Prebrolizumab单药治疗TMB高且既往治疗后进展的实体瘤,预示该预测因子将有可能成为泛癌种免疫治疗预测标志物。回顾性研究亦发现,TMB与免疫检查点抑制剂的疗效成正相关[2]。进一步有研究发现,POLE基因变异与TMB的高低有显著相关性,POLE突变的肿瘤TMB较高,免疫疗效较好[3]。然而,其它基因与TMB的相关性仍不清楚。高通量测序技术的应用使得肿瘤分子分型变得更加精细,可一次性检测多个基因,更全面地了解肿瘤基因突变谱,同时计算TMB,为快速寻找新的疗效预测因子以及探索TMB的内在生物学机制提供了可能。本研究旨在通过高通量测序技术,全面分析乳腺浸润性导管癌的基因突变情况,寻找潜在新的免疫疗效标志物,为进一步药物研发以及临床诊治提供参考。
1 材料与方法
1.1 材料
收集2018年10月至2020年3月中山大学孙逸仙纪念医院收治的原发性乳腺癌患者32例,平均(50.5±10.20)岁,所有病例的肿瘤组织均经病理科确诊均为乳腺浸润性导管癌,ER、PR、HER2的表达情况如表1。
1.2 DNA提取及杂交捕获测序
FFPE肿瘤组织标本及外周血白细胞DNA的测序建库采用OncoScreen Plus试剂盒(燃石,广州),流程如下:取200 ng DNA,用Covaris M220(Covaris,MA,USA)进行打断,接着依次进行末端修复、磷酸化和接头连接。然后将200~400 bp的片段经过探针杂交、磁珠纯化、PCR扩增形成目的文库。文库定量后,在 Nextseq550测序仪(Illumina,Inc.,USA)进行双端测序检测,检测520个癌症相关基因,总覆盖长度1.64 Mb,组织标本平均测序深度1000×,白细胞标本平均测序深度100×。

表1 32例乳腺癌患者ER、PR、HER2表达情况表
1.3 测序数据分析
数据分析流程参照先前的报道[4]。体细胞变异主要通过与人类参考基因组hg19版本比较得出。拷贝数变异的计算以待测样本检测深度与阴性样本基线(n>50)进行统计分析,拷贝数低于1.5为缺失,大于2.64为扩增。微卫星不稳定性主要检测63个微卫星的状态,>40%微卫星异常判定为MSI⁃H,同时通过检测 MLH1、MSH2、MSH6、PMS2和EpCAM等错配修复基因的突变进一步确认。肿瘤突变负荷TMB的计算排除拷贝数变异、基因重排、大片段重排以及EGFR、ALK基因的激酶区变异,编码区域为1.26 Mb,计算公式为TMB=基因变异(上述变异除外)/1.26 Mb。
1.4 统计学方法
应用SPSS 20.0软件和GraphPad Prism 7进行统计学数据分析。根据分组采用Fisher确切概率法比较组间的差异,P<0.05为差异有统计学意义。比较两组样本均数采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 32例乳腺癌的基因变异结果
取32例乳腺浸润性导管癌标本共检测出体细胞基因变异482个,按不同的变异方式可分为9类(如表2所示)。其中,发生频率最高的变异类型是拷贝数扩增和错义变异。由于同义变异多数不影响蛋白功能,将同义变异剔除后进一步分析发现,检出率最高的变异基因为TP53和PIK3CA,分别占7%和5%(表3)。肿瘤突变负荷中位值约为5.6。分别以5和10作为分界阈值,大于10/Mb的有3例,5~10/Mb的有15例,小于5/Mb的有14例(表4)。
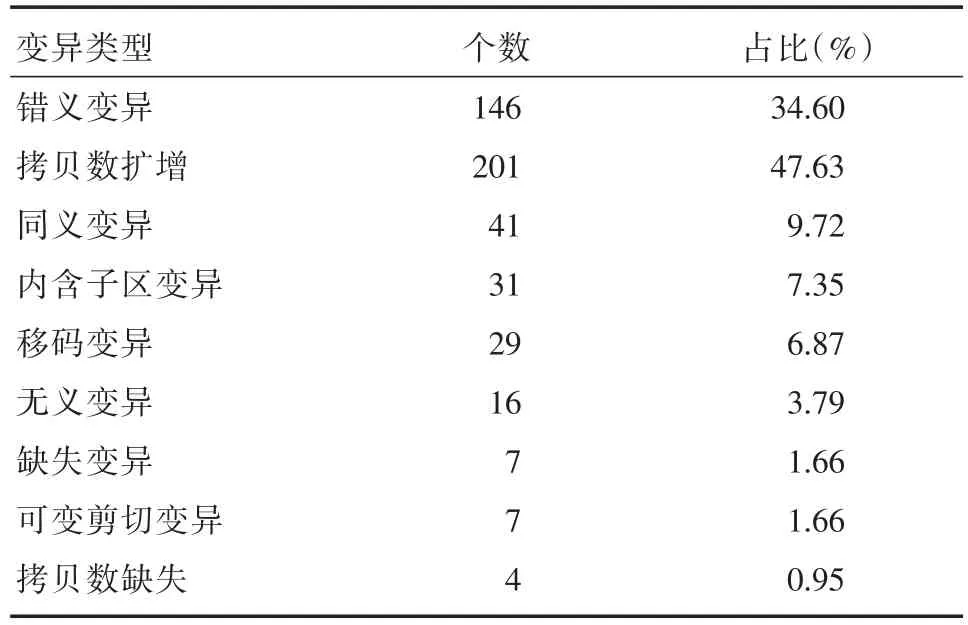
表2 32例乳腺癌基因变异类型
2.2 基因变异与乳腺癌分子分型的关系
根据ER、PR、HER2的免疫组化结果,将32例乳腺癌进行分组,分别为三阴性组4例、HER2阳性组4例和其它表达组24例。分别比较不同组之间TP53、PIK3CA和TMB基因突变。结果如表5~7所示,32例标本中,检测出84.4%TP53突变(27/32例),50%PIK3CA突变(16/32例)。另外,我们对乳腺癌的重要基因BRCA1/2和PI3K信号通路的的抑制因子PTEN也进行了分析,结果显示18.8%BRCA1/2突变(6/32例),和9.4%PTEN突变(3/32例)。BRCA1/2、TP53、PIK3CA、PTEN以及TMB的突变与ER、PR、HER2的表达均无明显相关性(P>0.05)。

表3 32例乳腺癌各变异基因的占比

表4 32例乳腺癌肿瘤突变负荷的分布
2.3 不同基因变异与TMB的相关性
如图1所示,BRCA1/2基因有害变异与乳腺浸润性导管癌的TMB高低明显相关,携带BRCA有害突变的乳腺浸润性导管癌TMB明显高于未携带BRCA突变者(P<0.05)。常见变异如TP53、PIK3CA以及PTEN与TMB的高低均未发现明显相关性(P>0.05)。
3 讨论
近年来,因为治疗效果显著,以PD1/PD⁃L1为代表的免疫治疗逐步推广到各种肿瘤的临床治疗中,然而整体有效率较低,因此寻找有效的免疫治疗疗效预测因子显得尤为重要。
肿瘤突变负荷TMB定义为每兆碱基发生的体细胞变异总数。一般认为,肿瘤的体细胞变异频率越高,越容易产生能被免疫细胞所识别的抗原,有利于免疫杀伤。有研究发现,肠癌肿瘤抗原的增加与肿瘤浸润性免疫细胞的数量正相关,并且患者有更高的生存率[5]。黑色素瘤的研究发现,肿瘤基因突变越多,患者对细胞毒T淋巴细胞相关抗原4(cytotoxic lymphocyte antigen 4,CTLA⁃4)抑制剂的反应越好,可能的原因是抗原多的情况下,CTLA⁃4抑制剂使得免疫细胞的活化与效力更强[6,7]。而在一项非小细胞肺癌的研究中,肿瘤突变负荷越高,其客观缓解率越高,且无进展生存期(progression free survival,PFS)越长,中位PFS约为14.5个月,而TMB低的亚组中位PFS只有3.5月[8]。对于小细胞肺癌,高的TMB同样被证实可作为免疫疗效好的预测因子[9]。一项针对泛癌种的超过7000名患者的研究发现,包括乳腺癌在内的大多数实体瘤,TMB越高,对免疫抑制剂应答反应越好,总体生存率越高[10]。PD⁃L1表达已被批准用于免疫治疗的伴随诊断,但PDL1与TMB无明显相关性[11]。

表5 不同受体分型与TP53、PIK3CA基因变异的关
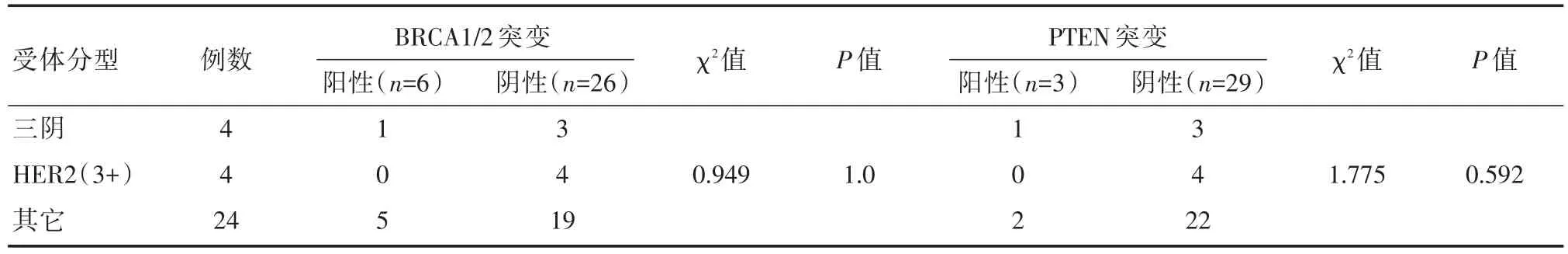
表6 不同受体分型与BRCA1/2、PTEN基因突变的关系
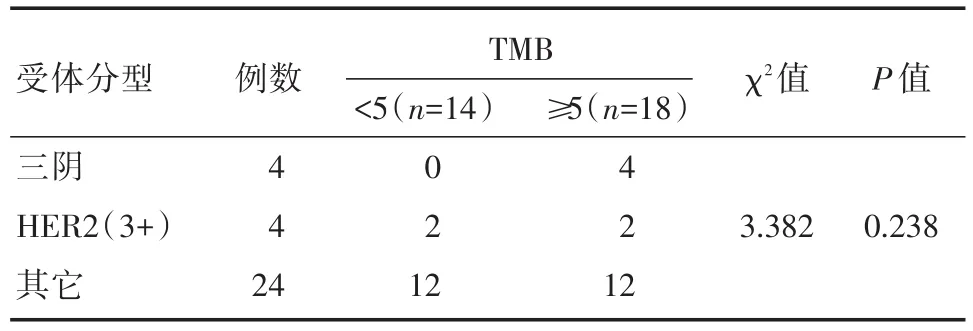
表7 不同受体分型与TMB的关系

图1 BRCA1/2、TP53、PIK3CA、PTEN突变与TMB的相关性
伴随MSI、NTRK重排等为代表的新型分子标志物的问世,应用高通量测序技术可以从肿瘤患者甄别出获益群体,达到精准诊疗[12-14]。本研究采用高通量测序技术,分析乳腺浸润性导管癌中不同亚型的基因突变状态,并围绕TMB进行了相关性分析。据文献报道,TP53、PIK3CA是乳腺癌最常见的变异基因,均占27%[15]。BRCA1/2突变发生率约为11%[16]。而我们检测到TP53突变占84.4%,PIK3CA突变占50%,BRCA1/2突变占18.8%,是否与以前报道不一样,还需增大样本量进一步研究。本研究发现,TP53突变、PIK3CA激活突变或PTEN失活突变与TMB的高低均无显著相关性。
在一项3000多例乳腺癌样本的研究中,TMB的中位值约为2.63,低于本研究,该差异可能是入组标准和病例数不同所致。本研究的TMB值在不同受体分组中无明显差别,与一项转移性乳腺癌循环肿瘤DNA的小样本研究中观察到的结果一致[17]。另外,我们发现携带BRCA1/2基因变异的乳腺浸润性导管癌亚组,其TMB水平比没有BRCA1/2变异的组高。BRCA1/2基因是同源重组修复的重要基因,其突变导致基因组不稳定,与乳腺癌、卵巢癌等多种肿瘤易感性密切相关,并且是PARP抑制剂的疗效标志物。近年来,尽管BRCA1/2突变的病例在胰腺癌中占比较少,但基于良好的治疗效果,美国FDA批准PARP抑制剂Olaparib用于治疗携带BRCA1/2胚系突变的转移性胰腺癌。而有趣的是,不管微卫星状态是否稳定,携带BRCA1/2突变的胰腺癌其TMB和PD⁃L1表达均较高[18]。可能的原因是BRCA1/2突变介导的同源重组修复缺陷导致基因组修复能力减弱,变异增多。因此,BRCA1/2基因不仅可作为PARP抑制的疗效预测分子,还可能作为TMB的潜在预测因子。
综上所述,我们的研究结果提示乳腺浸润性导管癌BRCA1/2的有害突变是与TMB相关,可能是免疫疗效的潜在预测因子。BRCA1/2基因突变的患者TMB较高,可能对免疫治疗较敏感。
