糖脂代谢紊乱大鼠模型肠道菌群结构变化
2020-07-03魏晓艺车念聪张哲滔彭思扬郑亚琳
魏晓艺 车念聪 张哲滔 田 甜 彭思扬 刘 柯 郑亚琳
现代常见的高糖高脂饮食习惯是导致或加重糖脂代谢异常情况的重要因素。与糖脂代谢异常相关的疾病发生率也逐渐提升,其中,糖尿病是全球性的公共卫生问题之一。经济快速增长,饮食结构西化,人口流动性变化,使得中国的糖尿病发生率大幅上升。与2001年全国性调查报道的5.5%的发生率比较, 2010年这一比例已经上升到11.6%。基于此的预测表明,中国拥有世界上最多的糖尿病患者。一项前瞻性研究认为,肥胖、高血压和血脂异常与2型糖尿病的风险直接相关[1~3]。人体肠道中寄居着大量厌氧和需氧细菌群体,可以通过能量代谢、免疫调节和炎症机制等多种途径影响肥胖、2型糖尿病、非酒精性脂肪肝等多种代谢性疾病的发生、发展。肠道细菌数量可达到100万亿,占有量较大的为厚壁菌门、拟杆菌门、放线菌门、变形菌门等[4,5]。本研究采用Illumina Miseq高通量测序技术,对正常组和链脲佐菌素(STZ)联合高糖高脂饮食诱导的糖脂代谢紊乱大鼠肠道菌群结构改变的特征进行了初步分析,旨在探索肠道菌群与血糖、血脂的关系,为通过调节肠道菌群来改善血糖、血脂代谢提供实验基础。
材料与方法
1.动物及模型制备:本实验动物伦理经首都医科大学动物伦理学委员会审核通过(伦理编号:AEEI-2017-019)。造模方法延续课题组的前期研究[6]。SPF级雄性SD大鼠16只,体质量180~200g,购于北京维通利华实验动物技术有限公司,饲养在首都医科大学实验动物部SPF级动物房。室温保持在22±2℃,相对湿度为26%±2%,按正常昼夜节律调节光照时间。在使用普通饲料进行适应性饲养2周后,采用随机数字表,将动物分为正常组(Z组)和模型组(M组),每组8只。正常组动物予以普通饲料,模型组动物饲以高糖高脂饲料(基础饲料58.8%,猪油10%,蔗糖20%,胆盐0.2%,蛋黄粉10%,胆固醇1%)。饲养4周后,所有大鼠禁食12h,模型组大鼠经腹腔注射柠檬酸钠缓冲液配制的1%链脲佐菌素(STZ),剂量为35mg/kg;正常组大鼠经腹腔注射等量0.9%氯化钠溶液。注射1周后经尾尖采血检测造模组大鼠空腹血糖,以空腹血糖>16.7mmol/L为造模成功。模型组大鼠以高糖高脂饲料继续喂养,每周定时测空腹血糖、体质量。首次注射STZ后对模型组大鼠血糖进行检测,有1只大鼠空腹血糖不达标,以同样方法补注,1周后复测血糖仍<16.6mmol/L,故淘汰;正常组大鼠死亡1只,故实验结束时,正常组存活大鼠7只,模型组7只。饲养全过程中动物自由饮食饮水。第14周末,动物隔夜禁食12h,次日先经尾静脉采血检测大鼠空腹血糖及体质量,后经腹主动脉取血,静置约2h后3000r/min离心15min,取血清冻存于-20℃冰箱备用;剖腹,取盲肠内容物于无菌冻存管中,快速放入-80℃冰箱中保存。
2.血生化指标的测定:采用日本奥林巴斯株式会社全自动生化仪AU480检测各组大鼠血清总胆固醇(TC)、甘油三脂(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量;罗氏血糖仪(活力型)检测大鼠空腹血糖(GLU);放免法检测血清胰岛素(INS);稳态模型评价胰岛素抵抗指数(HOMA-IR),即空腹血清胰岛素×空腹血糖/22.5,以评价胰岛素抵抗(IR)水平。
3.肠道菌群结构的检测:称取150~200mg粪便,首先抽提细菌总DNA,后对其DNA纯度进行测定。将样本在冰上融化后,充分混匀并离心,取适量样本,采用NanoDrop2000超微量分光光度计测定其DNA纯度和浓度;采用琼脂糖凝胶电泳技术检测DNA完整性。随后将样本保存至-80℃冰箱,纯度合格可进行肠内容物微生态检测。对 OTU 丰度矩阵中每个样本的序列总数在不同深度下随机抽样,以每个深度下抽取到的序列数及其对应的 OTU 数绘制稀疏曲线。得到 OTU 稀疏曲线,如图1稀释曲线所示,在随机抽取的序列总数达到15000以后趋于平缓。测序深度达标,可进行后续多样评估。在检测样本中微生物DNA序列后,根据数据库进行划分,每个OTU的代表序列用于分类地位鉴定以及系统发育学分析。根据OTU在不同样本中的丰度分布,评估每个样本的多样性水平。最后,对各样本(各组之间)在不同分类水平的具体组成进行分析。
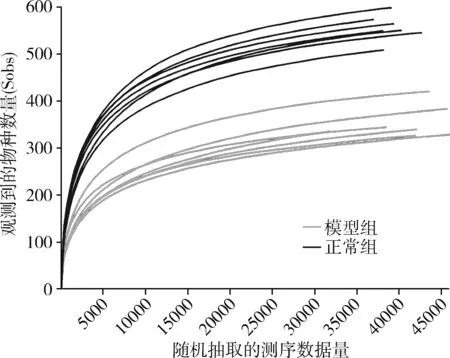
图1 稀释曲线
结 果
1.大鼠体质量情况:模型组大鼠在注射STZ后体质量迅速减轻,且后续增重较慢,最终体质量明显低于正常大鼠。与正常组比较,模型组大鼠反应迟缓,毛色黄暗成缕,粪便稀软。体质量情况如表1所示。
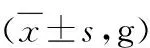
表1 大鼠体质量情况
与正常组比较,*P<0.05
2.血脂与糖代谢情况:模型组大鼠LDL-C和INS高于正常组,差异有统计学意义(P<0.05);模型组的TC、TG、GLU和HOMA-IR与正常组比较,差异有统计学意义(P<0.01);两组间HDL-C水平比较,差异无统计学意义,详见表2。
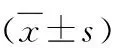
表2 血脂与糖代谢情况
与正常组比较,*P<0.05,**P<0.01
3.肠道菌群整体结构:正常组、模型组共检测出1317个OTU,其中共有OTU 507个,仅占38.5%,两组间丰度差异较大(图2A),正常组独占的OTU有241个,为不受糖脂代谢紊乱因素影响存在的;模型组独占的OTU为62个,为受糖脂代谢紊乱影响产生的。如图2B所示,正常组与模型组的点总体分布较为分散。
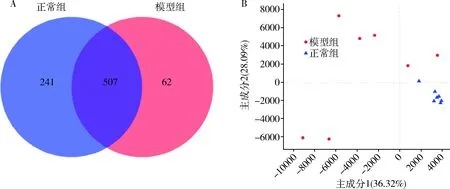
图2 肠道菌群整体结构图A.维恩图;B.PCA图,百分比表示主成分对样本组成差异的贡献值。横、纵坐标轴的刻度是相对距离,无实际意义
4.肠道菌群Alpha多样性:在进行微生物群落丰富度和多样性分析时,常用Sobs、Chao、ace指数来描述群落物种的丰富度,用Shannon、Simpson指数来反映物种的多样性。与前述其他4个指数不同,Simpson指数的值与其所反映的指标呈负相关。如表3所示,模型组的Sobs、Chao、ace、Shannon指数均显著低于正常组(P<0.01);与模型组比较,正常组的Simpson指数较低(P<0.01)。

表3 肠道菌群微生物Alpha多样性系数表
与正常组比较,*P<0.01
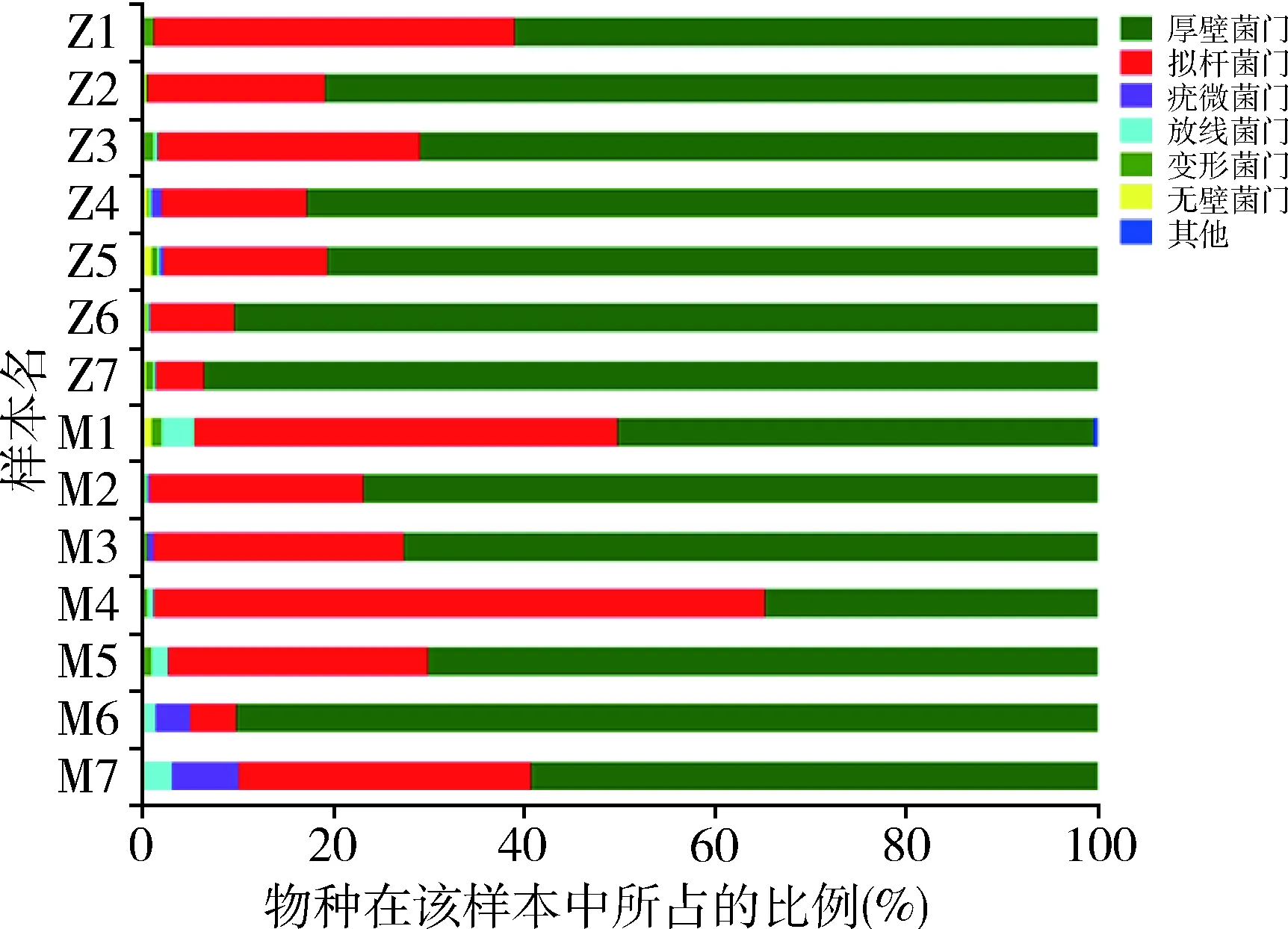
图3 群落组成柱形图(门)
5.肠道菌群物种注释及差异分析:在门这一级别检测出的主要种类,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、无壁菌门(Tenericutes)丰度依次递减(图3)。其中放线菌门在模型组中比例升高,差异有统计学意义(P<0.01),详见表4。在门这一级别检测出5类细菌在两组间比较差异有统计学意义,其中正常组的蓝藻菌门、Saccharibacteria菌门显著高于模型组,差异有统计学意义(P<0.01);放线菌门、螺旋体(Spirochaetae)和某无分类细菌(unclassified_k_norank)在模型组中的比例明显高于正常组(P<0.05,图4)。在纲这一级别中,梭菌纲(Clostridia)、拟杆菌纲(Bacteroidia)、芽胞杆菌纲(Bacilli)、丹毒丝菌纲(Erysipelotrichia)、Negativicutes钢、疣微菌纲(Verrucomicrobiae)和放线菌纲为丰度较高的菌属。其中梭菌纲(属厚壁菌门)在正常组大鼠的肠道菌群中比例大于模型组;放线菌纲(属放线菌门)在模型组大鼠肠道菌群中比例更高,二者比较差异均有统计学意义(P<0.05,图5)。在所有菌目中,检出差异有统计学意义的为梭菌目(Clostridiales)和红蝽菌目(Coriobacteriales)(属放线菌门)在模型组大鼠菌群中比例更低(P<0.05),双歧杆菌(Bifidobacteriales,属放线菌门)在模型组大鼠菌群中比例更高(P<0.05,图6)。
表4 两组大鼠主要肠道菌群差异的比较
与正常组比较,*P<0.01
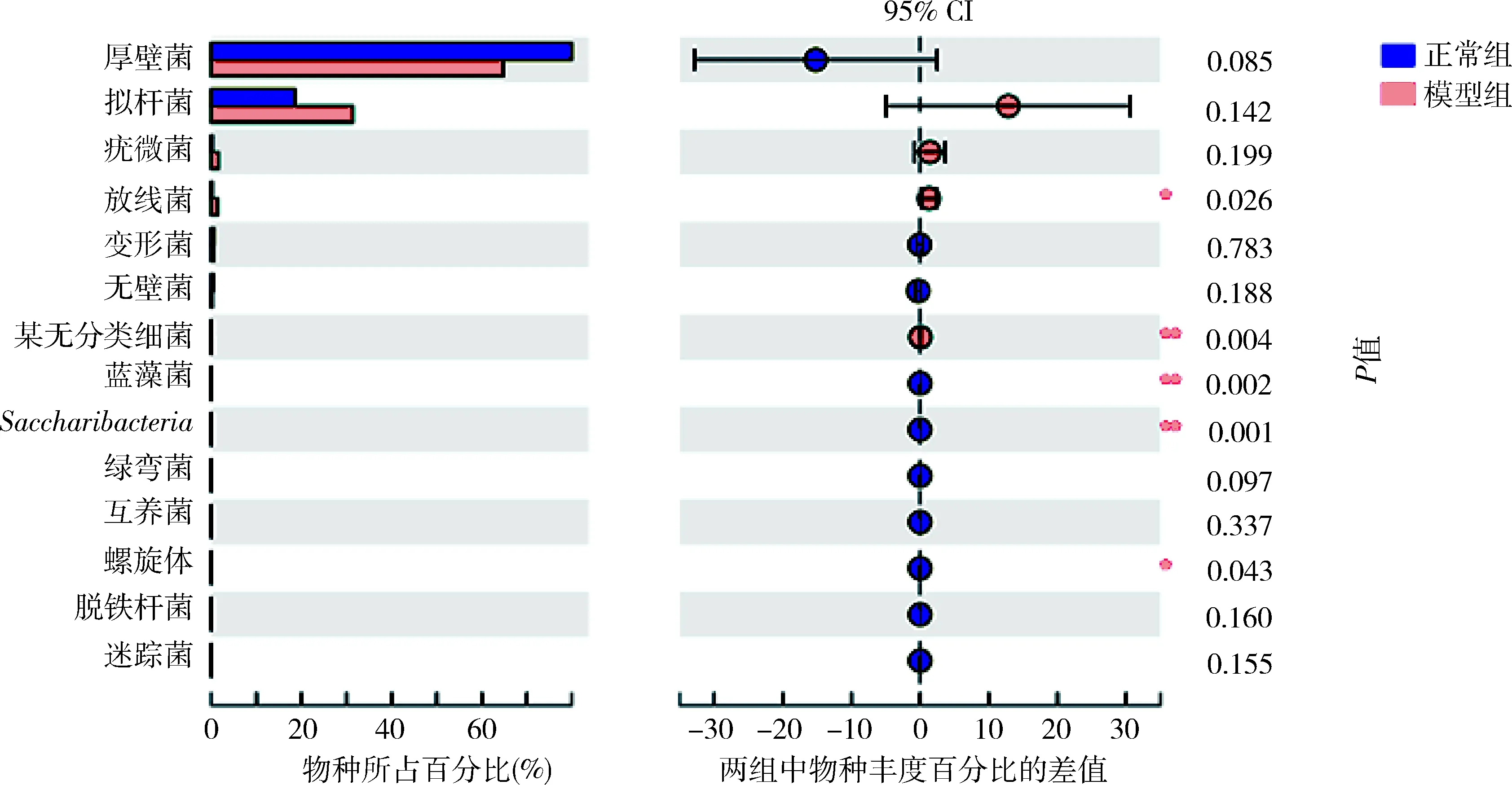
图4 正常组与模型组大鼠肠道菌群差异分析(门)圆点颜色显示为物种丰度占比较大的分组颜色,圆点上的Ⅰ型区间为差值的上下限值;与正常组比较,*P<0.05,**P<0.01
图5 正常组与模型组大鼠肠道菌群差异分析(纲)与正常组比较,*P<0.05,**P<0.01
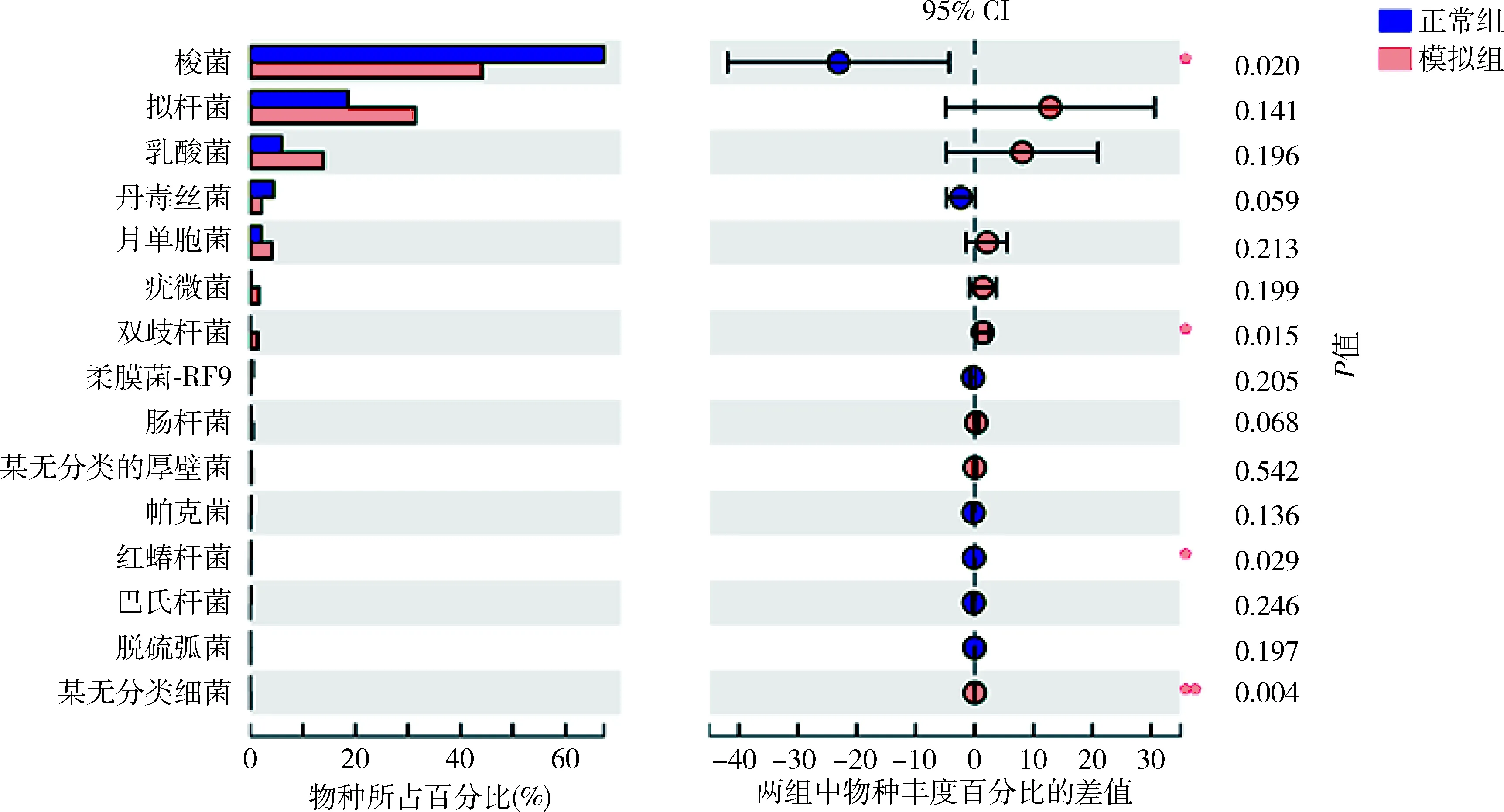
图6 正常组与模型组大鼠肠道菌群差异分析(目)与正常组比较,*P<0.05,**P<0.01
采用LefSe多级物种差异判断分析,比较正常组大鼠和模型组大鼠肠道菌群丰度在各级分类水平下的差异,如图7所示,圆圈由内向外依次为门、纲、目。由此可见此模型可引起7个分类水平的微生物群的上调,其中4个与放线菌门相关;另外造成梭菌门等20个分类水平微生物群的降低。
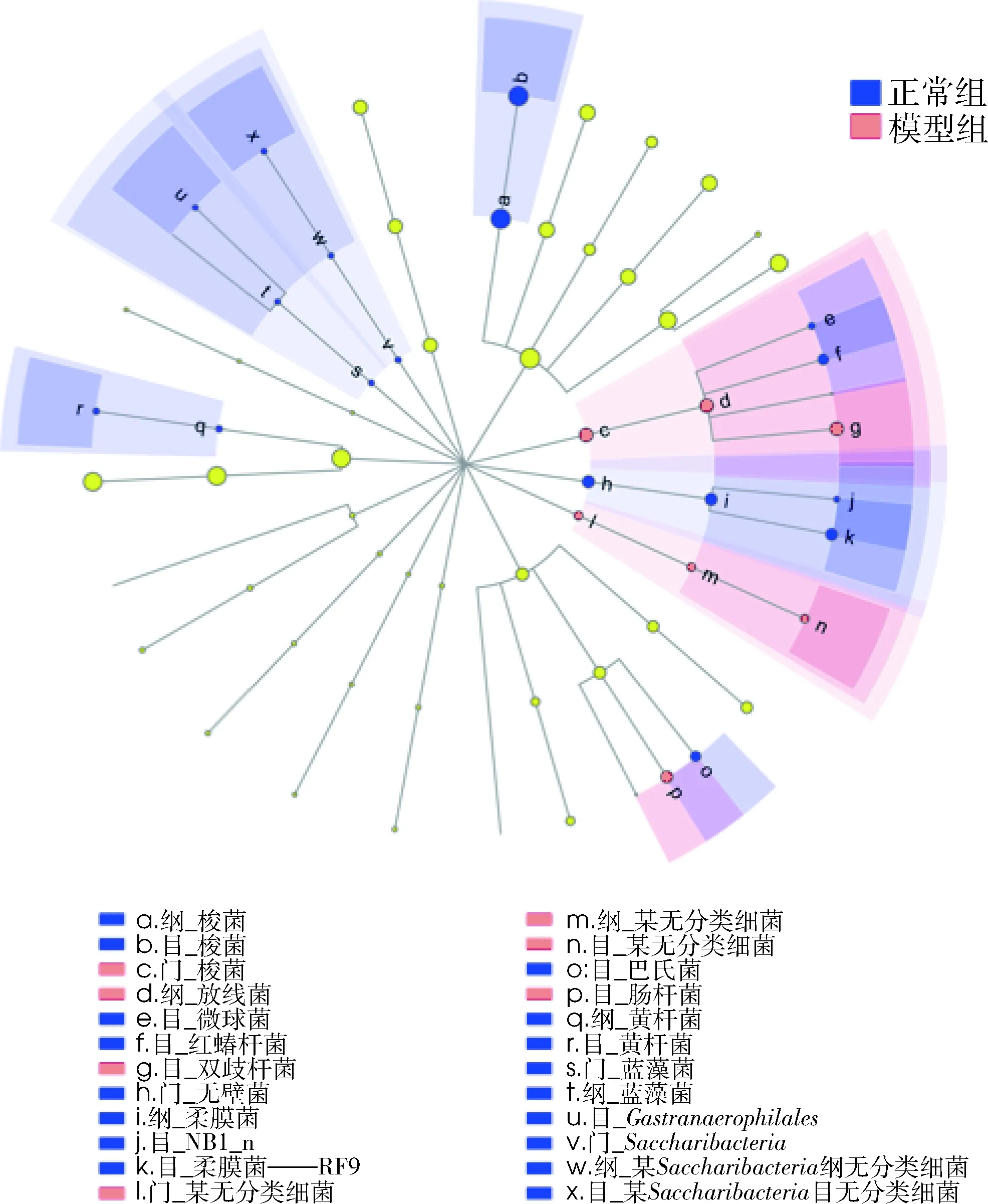
图7 基于分类等级树的组间差异分类单元展示图圆圈由内向外依次为门、纲、目。淡黄色节点表示在组间无显著差异; 红色节点表示在该水平上下调的微生物类群;蓝色节点表示在该水平上上调的微生物类群
6.糖脂代谢指标与菌群的相关性分析:当模型组TG异常时,脱铁杆菌门(Deferribacteres)、变形菌门、Saccharibacteria菌门比例改变(P<0.05),与TG的变化呈负相关;当TC异常时,脱铁杆菌门含量改变(P<0.05),Saccharibacteria、蓝藻菌门(Cyanobacteria)发生显著变化(P<0.01);HOMA-IR的变化与放线菌门的比例呈正相关,与Saccharibacteria、蓝藻菌门和柔膜菌门(Tenericutes)的比例呈负相关(图8)。
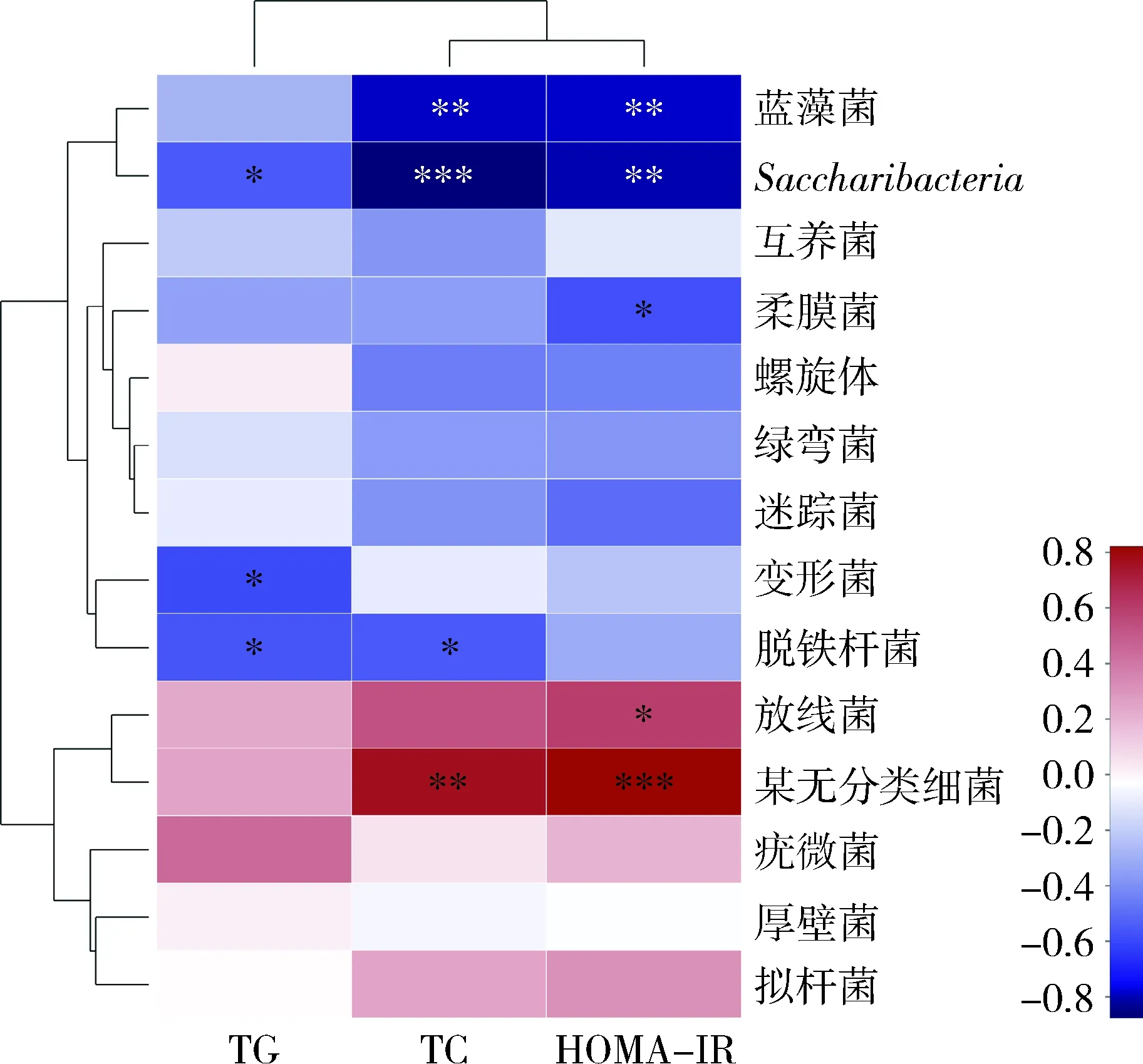
图8 TG、TC、HOMA-IR与肠道菌群(门)相关性热图红色方框代表某微生物类群与环境呈正相关;蓝色方框代表某微生物类群与环境呈负相关;*P<0.05,**P<0.01,***P=0.000
讨 论
糖脂代谢紊乱常见于糖尿病、非酒精性脂肪性肝病、肥胖等疾病。对于这一病理状态而言,分析肠道菌群的结构以及找到某类特殊菌种,可以为揭示其发生原因提供支持。本实验延续课题组前期基础,采用小剂量(35mg/kg)注射STZ的造模方法,破坏胰岛β细胞,早期造成胰岛素分泌不足,大鼠血糖逐渐升高[7]。在高糖高脂饲料喂养下,大鼠血糖持续保持高水平,使得胰岛β细胞代偿性分泌大量胰岛素,表现为高胰岛素血症状态;因胰岛β细胞的增殖性在出生后急剧下降,且再生性低,同时饲以高糖高脂饲料,血糖调节失代偿,大鼠始终处于高血糖状态[8]。持续的高血糖、高血脂和高胰岛素血症导致胰岛素抵抗,表现为糖脂能量利用和储存紊乱的状态[9]。有研究者研究肠道菌群发现,低微生物丰度者患代谢性疾病的风险更高[10]。另有研究者通过调查肥胖与正常人群的肠道菌群后认为,低微生物丰度组的人群常伴有高胰岛素症、体脂增高、高甘油三酯血症,提示这类人群罹患糖尿病、非酒精性脂肪性肝病等代谢性疾病的风险增高[11]。本实验通过16S高通量技术分别对两组大鼠肠道菌群进行测序,结果发现模型组大鼠的肠道菌群结构发生了显著的变化。通过对OTU的比较,笔者观察到模型组大鼠的肠道菌群多样性较正常组显著降低,与一些非酒精性脂肪肝、2型糖尿病、肥胖等代谢疾病模型的菌群特征表现相合,而菌群结构改变和糖脂代谢紊乱的因果关系,还有待于进一步研究[12~14]。
另外,许多研究发现一种厚壁菌门代谢产物丁酸盐具有抗炎、改善胰岛素抵抗的作用,高糖高脂饮食导致厚壁菌的减少,可能与肥胖、IR及糖尿病的发生有关[15,16]。本实验系统发育学的结果提示,模型组厚壁菌门的比例较正常组略低,模型组胰岛素抵抗程度较正常组的增高可能与厚壁菌的减少有关。进一步在纲的水平上探究其的变化,结果显示厚壁菌门级别上的差异主要由梭菌纲(Clostridia)导致。在既往研究中,Jia等发现非肥胖型糖尿病(NOD)小鼠梭菌的相对丰度与空腹血糖呈负相关,并推测机制为丁酸梭菌CB0313.1通过参与2型免疫,调节T细胞而形成富集梭菌的环境,从而延缓和(或)抑制NOD 小鼠1型糖尿病的发生[17]。一项针对345例中国T2DM患者肠道菌群的研究显示,糖尿病患者肠道菌群中一些产生丁酸盐的厚壁、梭菌等丰度降低,厚壁菌门和梭菌纲的比例显著减少[18]。本次研究显示,与正常组比较,模型组的梭菌纲丰度显著降低,说明梭菌可能是糖尿病发展中的一类标志细菌,与糖尿病的发生及糖脂代谢紊乱相关。另外,一些梭菌被证实与维持肠黏膜稳态有关,肠黏膜通透性的改变也与糖脂代谢紊乱有关[19,20]。关于梭菌的其他作用以及影响糖脂代谢的机制有待进一步研究。
有研究者针对2型糖尿病、胰岛素抵抗、肥胖等开展的研究发现,患病组肠道菌群结构表现为高厚壁菌低拟杆菌的状态。而Zhou等[21]和Larsen等[22]的研究发现,模型组肠道菌群出现了厚壁菌门比例低、拟杆菌门比例高的情况。在本次小样本的研究数据中发现,模型组拟杆菌比例较正常组也有上升趋势,二者的所占比例可能与糖脂代谢存在相关性,后续可进行大样本量数据研究,以明确其与糖脂代谢紊乱的具体关系。除厚壁菌、拟杆菌外,放线菌也是人体肠道菌群内的优势菌种。在医药、农业、生物技术中,放线菌是酶抑制剂的重要新来源,对控制糖尿病、肥胖症、高脂血症等碳水化合物依赖性疾病也有较高价值。然而目前鲜有放线菌和糖脂代谢互作机制的报道。本实验中笔者发现模型组放线菌门的比例显著增加,而同样属于放线菌纲的红椿菌和双歧杆菌在模型组中的比例相反,这可能表明不同的放线菌群之间存在拮抗关系;另外放线菌门与HOMA-IR的相关性较大,说明在高糖高脂饮食联合STZ诱导的糖脂代谢紊乱模型中放线菌可能是潜在的标志性菌,可能会为从菌群方面调控糖脂代谢紊乱状态的研究提供一定的参考。
