H2O2修饰层状钛酸的离子交换性能
2020-07-03周雯丽孔新刚
张 瑾,周雯丽,王 兴,孔新刚
(1.西京学院理学院,陕西西安710123;2.陕西科技大学材料科学与工程学院,陕西西安710021)
离子交换技术广泛应用于化工、冶金、采矿、电镀等行业排放的含有重金属离子污水的处理中,特别是重金属镉、铅等,其对水生环境和人类健康都会造成不可逆转的危害[1-2]。目前,水处理所采用的离子交换材料主要有离子交换树脂、沸石、杂多酸盐、金属铁氰化物和亚铁氰化物、多价金属磷酸盐、层状钛酸盐等。其中,层状钛酸盐由于具有解吸脱附速度快、循环再生性好和合成方法简单等特点而受到广泛关注[3-4]。然而,该类材料与大多数高价(二价、三价)重金属离子进行交换时,其离子交换能力相对较弱(相对一价金属阳离子,离子交换容量低和交换速度慢)[5-8]。因此,提升层状钛酸盐的重金属离子交换能力,在水处理和重金属分离提取等领域具有重要的意义。
目前,针对层状钛酸盐离子交换能力弱的问题,学者们主要采用微结构调控和官能团修饰改性两种手段来进行改善。微结构调控是通过调节形貌和粒径尺寸,来增大比表面积和吸附位点的思路,提升其离子交换的容量和速度[9-13]。官能团修饰改性的思路是通过材料与有机官能团键合,主要基于有机官能团与交换离子之间较强的静电作用和络合作用,来提升层状材料的离子交换性能。例如,L.Hu等[14]、Y.Chang等[15]、H.Chao 等[16]、H.Wang等[17]、G.Niu 等[18]、安会琴等[19]、汪雷[20]利用十六烷基三甲基溴化铵、木质素磺酸盐、二硫化碳等有机试剂作为改性剂,通过与层状钛酸盐的Ti-O-发生亲核取代反应或亲核加成反应,在层状钛酸表面引入了氨基、黄原酸基、木质素磺酸基等官能团。然而,在这些改性方法中,尽管引入的氨基、黄原酸基、木质素磺酸基等官能团能与大多数高价阳离子发生络合作用,但是它们都是吸电子基团,会降低TiO6层的负电荷密度,导致离子交换容量低。此外,这些官能团的修饰改性主要是发生在层状钛酸盐的表面上,存在改性方法复杂等问题。
事实上,层状钛酸对大多数二价和三价金属阳离子交换能力弱的根本原因是这些离子的水合离子半径较大,弱化了与TiO6层的静电引力[21-22]。由于层状钛酸盐离子交换反应的主要区域是TiO6层间,所以其离子交换性能除了受到交换离子的性质、自身的微结构以及外界因素(实验条件)的影响外,最主要是由自身内部TiO6层间化学结构与性质特点所决定,TiO6层的负电荷密度越大,被交换离子数就越多,与交换离子间的静电引力也越强,使离子交换的容量和速度越大、越快。如果采取供电子基团对层状钛酸盐内部的每一个TiO6层进行修饰,增大TiO6体层的负电荷密度,则势必会大幅度提升其离子交换的容量和速度。因此,本文通过H2O2处理层状 H1.07Ti1.73O4·H2O(HTO),增大层状钛酸的TiO6体层负电荷密度,以此深入研究层状钛酸盐的离子交换能力。
1 实验部分
1.1 实验试剂与仪器
KOH、LiOH、TiO2、乙酸锌、乙酸钴、乙酸镍、乙酸铜、H2O2溶液(质量分数30%),分析纯,国药集团化学试剂有限公司。
X-射线衍射仪(XRD,D/max-2200PC,Cu Kα),日本理学公司;场发射扫描电镜(FE-SEM,S-4800),日本日立公司;透射电镜(TEM,G2F20STWIN),美国FEI公司;X-射线荧光光谱仪(XRF,Horiba XGT-7200),日本岛津公司;红外光谱仪(FT-IR,Vertex70),德国布鲁克公司。
1.2 H2O2修饰H1.07Ti1.73O4样品制备
取5.1 g KOH、0.6 g LiOH、6.9 g TiO2和25 mL去离子水加入到反应釜中并搅拌10 min,然后在250℃下水热反应24 h,随炉冷却至室温后,取出产物。经抽滤和去离子水洗涤,得到白色层状K0.8Li0.27Ti1.73O4钛酸盐。将白色K0.8Li0.27Ti1.73O4样品加入到1 L硝酸溶液(0.2 mol/L)中,磁力搅拌24 h后抽滤,将滤饼再次加入到1 L新鲜的硝酸溶液(0.2 mol/L)中,继续搅拌24 h。为了将碱金属离子完全交换出来,该过程重复3次后去离子水洗涤至滤液呈中性,得到层状H1.07Ti1.73O4·H2O(HTO)板状粒子。将层状HTO白色粉体加入到500 mL H2O2溶液中,磁力搅拌10 min,经抽滤得到黄色样品,即为H2O2修饰HTO(H2O2-HTO)。
1.3 离子交换性能测试
称取0.5 g H2O2-HTO样品,加入到100 mL浓度为0.3 mol/L的乙酸盐溶液(乙酸锌、乙酸钴、乙酸镍、乙酸铜)中进行离子交换,磁力搅拌24 h后,将滤饼再次加入到100 mL浓度为0.3 mol/L的新鲜乙酸盐溶液,继续搅拌24 h。为了达到最大离子交换量,该过程重复3次后去离子水洗涤至滤液呈中性,得到的离子交换H2O2-HTO样品分别记为Zn-H2O2-HTO、Co-H2O2-HTO、Ni-H2O2-HTO、Cu-H2O2-HTO。作为对照,HTO样品在相同的条件下,分别在乙酸锌、乙酸钴、乙酸镍、乙酸铜溶液中进行离子交换,得到的样品分别记为Zn-HTO、Co-HTO、Ni-HTO、Cu-HTO。
2 结果与讨论
2.1 XRD与组成分析
层状钛酸HTO由TiO6八面体层和层间H3O+构成,其在2θ=9.71°有一个很明显的衍射峰,这是层状化合物的典型特征峰,对应的(020)晶面,晶面间距(TiO6八面体层间距)为0.913 7 nm。图1(a)为HTO与Co2+、Ni2+、Cu2+、Zn2+离子交换 48 h所得产物的XRD图。图中,M表示Co2+、Ni2+、Cu2+、Zn2+。从图1(a)可以看出,离子交换前后产物的结晶性与晶体结构都没有发生明显变化。相对于HTO,4种离子交换产物(Zn-HTO、Co-HTO、Ni-HTO、Cu-HTO)的(020)晶面衍射峰均发生了轻微的右移,其原因是这些二价离子的水合半径小于H+的水合半径,而且二价离子交换一价离子使层间离子数量减少,离子交换后TiO6八面体层间距减小。采用XRF进一步对离子交换后层间金属离子含量进行了分析,图1(a)中标注了离子交换产物中金属离子与Ti的物质的量比(基于电荷守恒,理论上H1.07Ti1.73O4·H2O层间的H+被二价离子完全交换,二价离子与Ti的物质的量比为0.535∶1.73)。由此可以看出,4种离子交换产物中,Zn-HTO产物的n(Zn)/n(Ti)最大(0.51∶1.73),表明HTO的离子交换具有选择性。
层状钛酸HTO经H2O2处理后,得到H2O2-HTO的TiO6八面体层间距变大(0.967 9 nm),这是由于H2O2分子半径比水分子半径大所致。图1(b)为H2O2-HTO与Co2+、Ni2+、Cu2+、Zn2+离子交换所得产物的XRD图。从图1(b)可以看出,离子交换前后,各种离子交换产物的衍射峰变化很明显。除了Cu2+离子交换产物的结晶性有所减弱外,Zn2+、Co2+、Ni2+与H2O2-HTO离子交换后得到的产物分别在7.50°和15.00°附近出现两个特征峰,与H2O2-HTO相比,衍射峰发生了明显的变化,层间距变大。这是因为H2O2-HTO离子交换后,晶体结构的空间群和晶胞参数发生了改变。对于H2O2-HTO而言,一个单胞的b/2即为层间距,所以(020)晶面对应的晶面间距就是TiO6八面体层间距。而H2O2-HTO离子交换后,空间群和单胞发生了变化,b值就是层间距,所以(010)晶面对应的是TiO6八面体层间距。由此可以看出,H2O2-HTO与Zn2+、Co2+、Ni2+离子交换后,其TiO6八面体层间距变大。图1(b)中标注了H2O2-HTO离子交换后进入层间的金属离子与Ti的物质的量比。相对于HTO,H2O2-HTO与Co2+、Ni2+、Cu2+、Zn2+离子交换产物中,金属离子与Ti的物质的量比都大幅度提高,并大于0.535∶1.73,其中Zn-H2O2-HTO和Co-H2O2-HTO产物中金属离子与Ti的物质的量比理论值(二价离子与Ti的物质的量比为0.535∶1.73)高出了一倍。
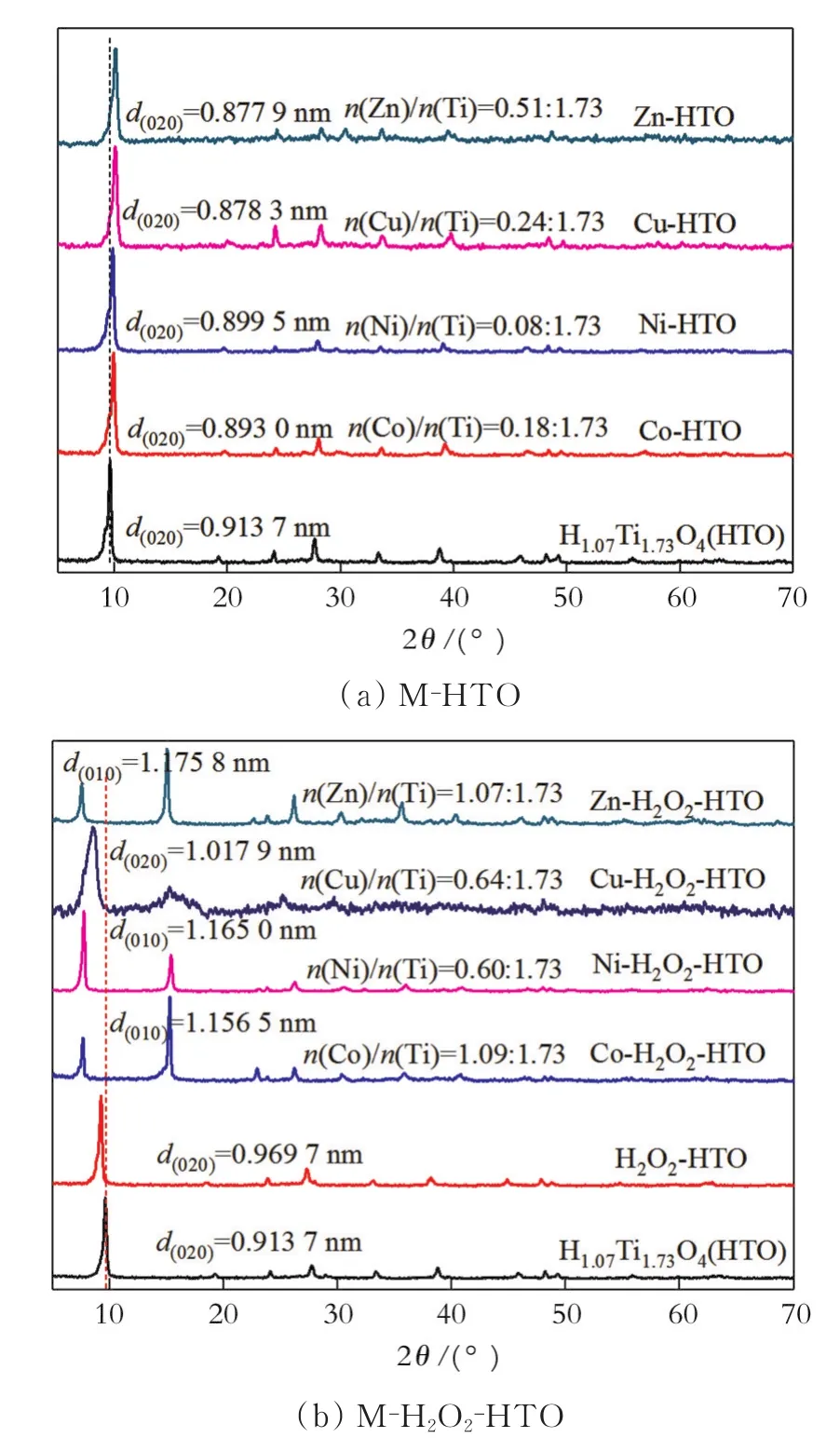
图1 样品与Co2+、Ni2+、Cu2+、Zn2+离子交换所得产物的XRD图
表1为HTO和H2O2-HTO在水体系和醇体系的Zeta电位值。由表1可知,无论在醇体系还是水体系下,H2O2-HTO的Zeta电位均比HTO低,表明H2O2的引入使TiO6八面体层的负电荷增多,这是导致H2O2-HTO的离子交换能力提高的主要原因。

表1 HTO和H2O2-HTO在水体系和醇体系的Zeta电位值
2.2 形貌与选区花样衍射(SAED)分析
图2为样品的SEM照片,其中插图为对应样品的光学照片。从图2可以看出,HTO前驱体具有板状形貌且表面光滑,其宽度约为3 μm,厚度约为100 nm(见图2(a)),样品为白色粉末;H2O2处理以及离子交换后,样品的板状形貌没有发生变化且表面依然光滑(见图2(b)),这表明H2O2处理与离子交换对样品的形貌没有影响;H2O2处理过程中,样品颜色由白色变为黄色,这是因为H2O2分子进入TiO6八面体层间并与Ti配位形成了Ti-O-O所致。离子交换后,所得离子交换产物Co-H2O2-HTO为深褐色,Ni-H2O2-HTO为黄绿色,Cu-H2O2-HTO为翠绿色,Zn-H2O2-HTO为浅黄色。

图2 样品的SEM照片(插图为对应样品的光学照片)
图3为样品的TEM和SAED照片。其中,样品TEM照片与SEM结果一致。图3(a)展现出一套单晶的衍射斑点,晶面间距分别为0.373 nm和0.292 nm,对应HTO(100)和(001)晶面,且两晶面夹角为90°,然后计算得出在HTO板状颗粒基面上,[010]晶带轴与入射电子束方向平行,即HTO的[010]晶带轴是垂直于板状颗粒的基面。而(010)晶面垂直于[010]晶带轴,因此在HTO板状颗粒平铺的状态下,在选区电子衍射花样中观察不到(010)晶面衍射。经过H2O2处理后,H2O2-HTO的选区电子衍射花样与HTO类似,测量所得H2O2-HTO(100)和(001)晶面对应的晶面间距值相差不大,晶面夹角为90°,也进一步说明H2O2处理没有对HTO的基本晶体结构产生影响,只是H2O2分子进入层间,增大了TiO6八面体层间的距离。

图3 样品的TEM和SAED照片
2.3 FT-IR分析
对离子交换产物进行了红外和拉曼测试,结果见图4。从图4(a)可以看出,每一个样品在406 cm-1处的吸收峰对应TiO6八面体中Ti-O的振动[23],HTO在 3 447、1 624 cm-1处的吸收峰归属于层间的 H3O+和 H2O[24];Co-HTO、Ni-HTO、Cu-HTO和Zn-HTO表现出与HTO类似的红外吸收峰,与HTO的唯一区别是,它们在3 441 cm-1处的吸收峰消失,这表明 HTO与Co2+、Ni2+、Cu2+、Zn2+离子交换后所得产物中TiO6八面体层间的水消失或者减少。从图4(b)可以看出,H2O2-HTO红外吸收峰与HTO区别是,924 cm-1处吸收峰消失,895 cm-1处出现新吸收峰,其归属于O-O的伸缩振动[25-27];Co-H2O2-HTO、Ni-H2O2-HTO、Cu-H2O2-HTO、Zn-H2O2-HTO四个样品也表现出了与H2O2-HTO相似的红外吸收峰,895 cm-1处的吸收峰依然存在,表明离子交换后O-O过氧键也依然存在。

图4 与Co2+、Ni2+、Cu2+、Zn2+离子交换产物的FT-IR光谱
2.4 离子交换性能
在醋酸锌溶液(固液比为0.5 g/100 mL,浓度为0.3 mol/L)中,HTO和H2O2-HTO在不同离子交换时间得到产物的XRD图,结果见图5。

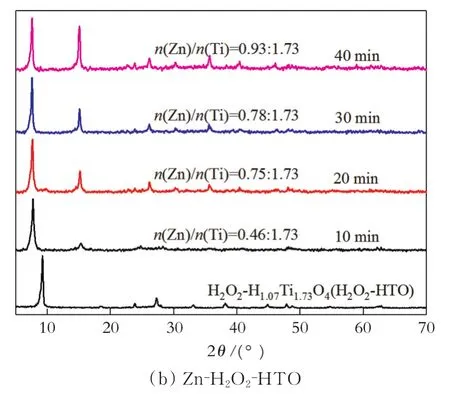
图5 HTO和H2O2-HTO与Zn2+在不同离子交换时间得到产物的XRD图
从图5(a)可以看出,HTO离子交换前后层状结构依然存在,而且产物和前驱体的结晶性几乎没有发生变化。随着HTO离子交换时间的延长,产物中n(Zn)/n(Ti)逐渐增大;当离子交换时间为20~40 min时,n(Zn)/n(Ti)变化不显著,这表明HTO与Zn2+的离子交换进行到20 min时,已经基本达到了交换平衡。从图5(b)可以看出,离子交换后产物在2θ=7.5°和15.0°附近出现了新的衍射峰,在 2θ=7.5°的衍射峰对应于(010)晶面,2θ=15.0°的衍射峰对应于(020)晶面。随着离子交换时间的延长,(020)晶面对应的衍射峰强度(相对于(010)晶面)逐渐增强;离子交换时间为20~40 min时,产物中n(Zn)/n(Ti)变化不显著,表明H2O2-HTO与Zn2+的离子交换进行到20 min时,已经基本达到了交换平衡。与HTO相比,H2O2-HTO在醋酸锌溶液中离子交换量较高。
在研究与Zn2+离子交换的基础上,深入考察了HTO和H2O2-HTO对于其他3种离子(Co2+、Ni2+、Cu2+)的离子交换性能(固液比为0.5 g/100 mL,浓度0.3 mol/L),结果见图6。从图6可以看出,与Co2+、Ni2+、Cu2+进行离子交换的情况和Zn2+离子交换情况一致。
图7为离子交换产物中金属离子与Ti的物质的量比与离子交换时间的关系。从图7可以看出,HTO分别与 Co2+、Ni2+、Cu2+、Zn2+离子交换时,离子交换量较小;H2O2-HTO与4种离子交换时,离子交换量都得到大幅度提升。同时,每一种离子进入层间的含量都不同,尤其是在H2O2-HTO与Co2+或Zn2+进行离子交换时,表现出了较好的离子交换特性。

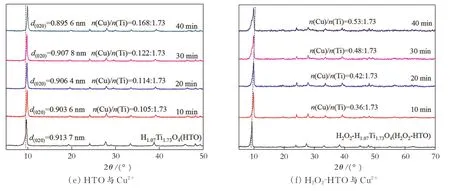
图6 HTO和H2O2-HTO与Co2+、Ni2+、Cu2+在不同离子交换时间得到产物的XRD图
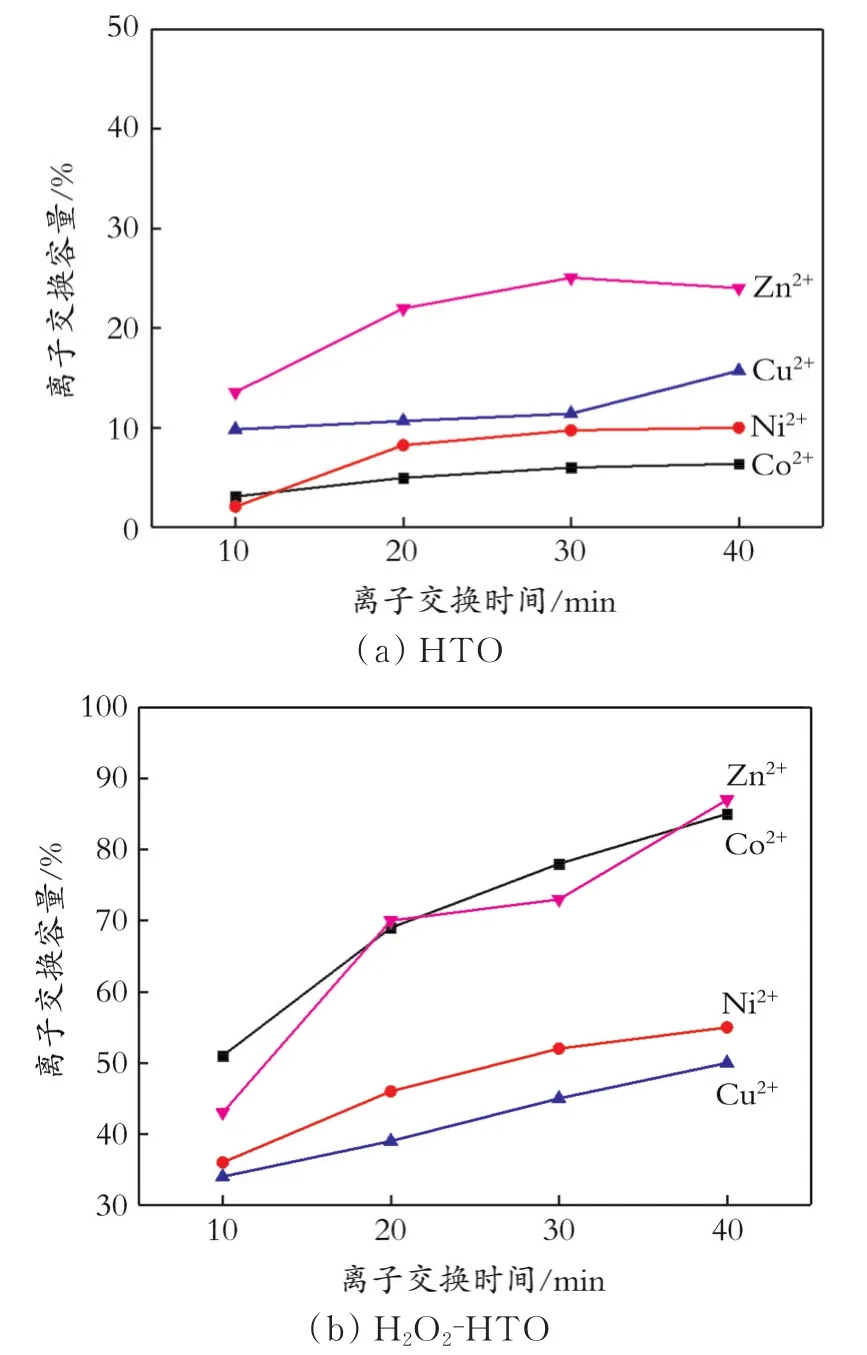
图7 离子交换产物中金属离子与Ti的物质的量比与离子交换时间的关系
2.5 机理分析
基于以上实验测试分析,提出离子交换产物的形成机理图,如图8所示。HTO是由TiO6八面体层和层间H3O+通过静电作用力结合而成的层状结构,层间距为0.92 nm。HTO直接与 Co2+、Ni2+、Cu2+、Zn2+等进行离子交换后,层间部分或者全部的H3O+被二价金属阳离子交换出来,使层间距减小。当HTO经过H2O2处理后,具有较大半径的H2O2进入了层间,并与TiO6八面体层中的Ti发生配位,使TiO6八面体层的负电荷增多,同时层间距也增大。H2O2的这种双重作用更有利于H2O2-HTO与金属阳离子离子交换。

图8 H2O2修饰层状钛酸的离子交换机理图
3 结 论
对层状钛酸 H1.07Ti1.73O4·H2O(HTO)进行 H2O2处理,将H2O2分子引入层状钛酸的TiO6八面体层间,形成黄色的H2O2修饰HTO,并且H2O2改性对HTO层状结构和形貌没有影响。Zeta电位分析表明,H2O2的引入使TiO6八面体层的负电荷增多。离子交换实验表明,H2O2修饰HTO相对于HTO,其离子交换容量都得到大幅度提升,其主要原因是H2O2的引入使TiO6八面体层的负电荷增多,尤其是在H2O2-HTO与Co2+与Zn2+离子进行交换时,表现出了较好的离子交换特性。
