放大内镜联合窄带成像技术与窄带双焦距技术对胃内浅表性病灶的诊断价值比较
2020-07-02
目前胃癌是全球发病率第4位,病死率第2位的恶性肿瘤[1],在中国胃癌发病率及病死率均居第2位[2],早期胃癌的5年生存率>90%[3-4],而进展期胃癌的5年生存率<30%[5]。降低胃癌病死率的关键是提高早期胃癌的检出率。内镜及活组织检查是目前胃癌诊断的金标准,放大内镜联合窄带成像技术(ME-NBI)能清晰地显示黏膜表面的微血管和微腺管。在临床工作中,ME-NBI技术较多应用于早期胃癌的内镜下诊断[6-8],但该技术操作时对焦困难,对操作医师的要求极高,往往需要复杂而精细的准备工作,通常需择期再次检查,无法做到普查。
新型双焦距内窥镜(GIF-HQ290)及其图像处理装置(EVIS LUCERA ELITE,CV-290,Olympus)及CLV-290SL光源的诞生使放大操作更为简单,无需择期再次充分准备行放大检查,一次内镜检查即可完成普及筛查和双焦距放大,在食管、胃及肠道肿瘤病变的诊断中应用较广泛[9-11]。但窄带双焦距技术(DF-NBI)与ME-NBI在胃部病变的鉴别诊断中是否具有同样良好的诊断效能,目前国内外的相关文献极少,本研究就此进行探讨,评价两者对鉴别胃内浅表性病灶的诊断价值。
1 对象与方法
1.1 研究对象
连续性纳入2017年7月至2018年12月在上海市普陀区利群医院消化内镜中心普查过程中使用新型图像处理装置(EVIS LUCERA ELITE,CV-290,Olympus)、CLV-290SL光源及 GIF-HQ290内镜(统一安装黑帽)白光检查发现的胃内浅表性病灶患者。
1.2 方法
对存在胃内浅表性病灶的患者即刻行DF-NBI诊断及靶向活组织检查。排除有胃息肉、进展期胃癌、胃大部切除手术史、食管胃底静脉曲张及严重系统性疾病、无法纠正的凝血障碍、精神疾病、急性上消化道出血等的患者。使用GIF-HQ290检查过程中均使用注水装置去除胃内泡沫及黏液。
由于放大内镜操作需复杂的准备工作,因此符合入选标准的患者均择期(通常在2周内)使用图像处理装置(EVIS LUCERA ELITE,CV-290,Olympus)、CLV-290SL光源及GIF-H260Z放大内镜行放大内镜检查。放大内镜检查均在麻醉状态下完成,检查前口服相关药物以去除胃内泡沫及黏液,且放大内镜头端统一安装黑帽。放大内镜检查均由经验丰富的内镜医师(独立操作ME-NBI 100例以上)完成,操作医师不得知晓以往胃镜诊断和活组织病理结果。白光模式下发现病变后,切换至NBI模式,然后行放大模式调节,进行ME-NBI诊断及靶向活组织检查,根据活组织病理结果对符合内镜下切除指征的患者行内镜下切除治疗[内镜下黏膜切除术(EMR)、内镜黏膜下剥离术(ESD)],对病变严重超适应证者行外科手术。本研究经医院医学伦理委员会批准,胃镜检查或治疗前患者或亲属均签署知情同意书。
本研究收集的资料包括病灶大小、部位、形态,并根据DF-NBI及ME-NBI表现作出诊断及靶向活组织病理检查:(1)病灶大小 以病理测定为准;(2)病灶部位 分为胃上1/3部,包括贲门、胃底;中1/3部,胃体;下1/3部,胃窦(包括幽门);(3)病灶形态 按消化道浅表性肿瘤性病变巴黎内镜分型标准,分为隆起型和浅表型[12],隆起型包括有蒂(Paris 0-Ⅰp)、亚蒂(Paris 0-Ⅰsp)和无蒂型(Paris 0-Ⅰs),浅表型包括轻微隆起型(Paris 0-Ⅱa)、平坦型(Paris 0-Ⅱb)和轻微凹陷型(Paris 0-Ⅱc);(4)标本来源 包括活组织检查、内镜下圈套器切除术、EMR、ESD及外科手术;(5)病理学诊断依据2010年消化系统肿瘤WHO分类标准[13-15]及维也纳修订分型[16],早期胃癌包括Vienna 4.1型~Vienna 4.4型。病理结果由两位高年资病理科医师进行复核。
1.3 统计学分析

2 结果
2.1 一般情况
共有121例患者(其中3例均有2个病灶,1例有3个病灶)满足入选标准,并接受了DF-NBI及ME-NBI检查。病理结果显示,良性病灶83个(萎缩、溃疡、增生、低级别上皮内瘤变等),早期恶性病灶43个(高级别上皮内瘤变、胃癌)。早期恶性病灶以老年患者多见,病灶直径多≥1 cm,病灶形态以浅表凹陷型为主。两组的基本资料详见表1。

表1 胃良性病灶与早期恶性病灶的基线特征
注:年龄和性别以病例数计算,其余项目以病灶数计算;a无上皮内瘤变病灶比低级别上皮内瘤变病灶;b高级别上皮内瘤变病灶比胃癌病灶;良性病灶患者中未治疗者给予随访
2.2 DF-NBI和ME-NBI鉴别诊断良性病灶和早期恶性病灶的效能
表2显示将靶向活组织检查或术后病理作为标准,DF-NBI及ME-NBI的实时诊断与病理的关系。两者的诊断效能见表3。与ME-NBI相比,DF-NBI诊断良性病灶和早期恶性病灶的敏感度、阴性预测值稍升高,特异度及阳性预测值稍降低,准确度相似,但差异均无统计学意义(P均>0.05)。图1为同一隆起型病灶(病理示低级别上皮内瘤变)的DF-NBI和ME-NBI图像。
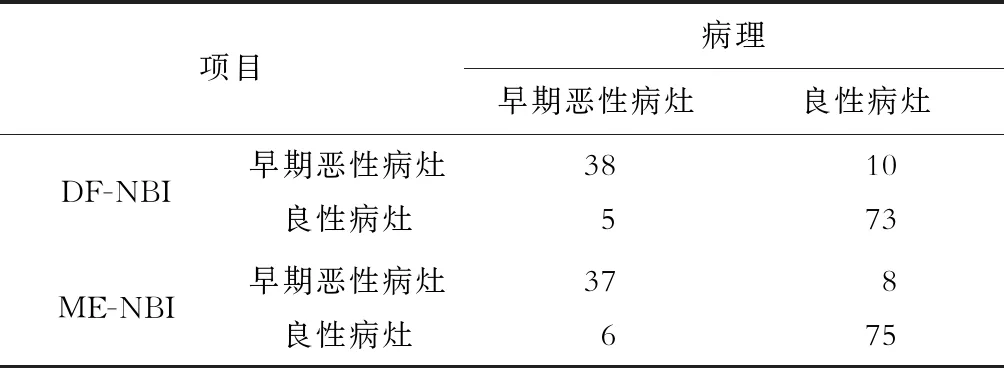
表2 DF-NBI及ME-NBI诊断为良性病灶和早期恶性病灶与病理学诊断的比较

表3 DF-NBI和ME-NBI诊断为良性病灶和早期恶性病灶的诊断效能比较
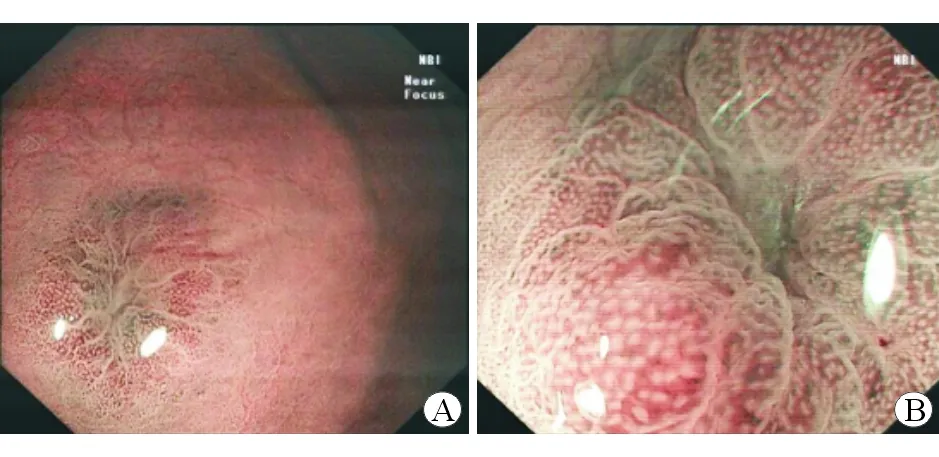
图1同一隆起型良性病灶的DF-NBI和ME-NBI图像ADF-NBI图像BME-NBI图像
3 讨论
随着人们生活水平的提高及健康意识的增强,胃镜检查在经济发达地区越来越普及。ME-NBI能清晰地显示黏膜表面的微血管和微腺管,目前多应用于早期胃癌的内镜诊断。然而中国早期胃癌的检出率远低于日本、韩国等东南亚发达国家[17-18],其原因主要是该技术在操作时对焦困难,对操作医师的要求较高,故仅在三级医院应用较广泛,在基层医院推广困难。此外,由于检查前需要复杂的准备工作,通常需再次择期检查,无法做到普查。
新型的EVIS LUCERA ELITE CV-290图像处理装置及CLV-290SL光源搭载新型疝气灯,NBI照明方式改良,光源更亮,更利于观察病灶。新型的双焦距内镜(GIF-HQ290)利用光学变焦原理,仅需一个按钮即能进行双焦距放大,对操作医师的技能要求低于ME-NBI,在食管及结肠镜检查中占有较大优势,并应用于肿瘤性病变的诊断,在胃内病变诊断中的应用也有相关研究[10],但是该研究仅比较了白光内镜和DF-NBI对早期胃癌的诊断效能,而DF-NBI与ME-NBI对胃部病变的鉴别诊断效能未作比较。因此,本研究比较了两者的诊断效能,以期DF-NBI在临床上能作为普查项目及在基层医院推广,提高早期恶性病灶的检出率,使患者最大程度受益。
本研究结果显示,早期恶性病灶以老年患者居多,恶性病灶部位虽以下1/3胃为主,但中1/3、上1/3发生恶性病灶的比例明显高于良性病灶,差异有统计学意义(P<0.05);病灶直径多≥1 cm,形态以浅表凹陷型为主,这与以往对早期胃癌的研究结果相符[19]。
本研究检查统一使用EVIS LUCERA ELITE CV-290图像处理装置及CLV-290SL光源,避免主机及光源不同引起结果差异。根据VS分型[7-8],在DF-NBI或ME-NBI模式下,如存在明确边界及不规则的微血管和(或)不规则的微腺管,则诊断为早期恶性病灶,非上述表现则诊断为良性病灶。结果显示,DF-NBI和ME-NBI判断良性病灶和早期恶性病灶的敏感度、特异度及准确度分别为88.4%、88.0%、88.1%比86.0%、90.4%、90.0%,DF-NBI的敏感度更高,更易发现早期恶性病灶;但ME-NBI的特异度高于DF-NBI,其原因主要是GIF-HQ290视角更大(140°比75°),更易操作;非放大模式与双焦距模式切换方便,更能直观地从非放大模式的范围及边界观察到双焦距放大模式的病灶观察,更易发现病灶;但ME-NBI的放大倍数高于DF-NBI(100倍比45倍),其对病灶表面的细微结构观察较DF-NBI更仔细,更能排除阴性病灶,特异度更高(图1)。但两者比较差异无统计学意义(P>0.05)。
因此,在临床上可使用双焦距内镜行常规检查,发现可疑病灶即可切换至双焦距放大模式,观察病灶表面的腺管及血管结构,明确是否为肿瘤性病灶,可避免患者再次择期行放大内镜检查,仅对于DF-NBI较难判断的病灶需择期再次行ME-NBI高倍放大,可大幅降低医疗费用,且该操作简单方便,易于在基层医院推广,提高早期恶性病灶的检出率。
本研究不足之处在于:内镜下判断病灶的准确度与内镜医师的临床经验和ME-NBI操作经验有关;本研究为单中心研究,尚需前瞻性多中心大样本研究的进一步验证。
综上所述,DF-NBI鉴别早期恶性病灶的诊断效能与ME-NBI相仿,对于可疑病灶,在普查过程中可即刻行常规DF-NBI,以提高早期恶性病灶的检出率,对于复杂的无法判断的病灶,可进一步行ME-NBI检查,以提高诊断效能,有助于制定最佳治疗方案。
