全氟辛烷磺酸盐(PFOS)对半滑舌鳎(Cynoglossus semilaevis)免疫相关基因表达的影响
2020-07-02汪笑宇戴媛媛贾磊王群山陈春秀
汪笑宇,戴媛媛,贾磊,王群山,陈春秀
天津渤海水产研究所,天津 300457
全氟辛烷磺酸盐(perfluorooctane sulfonate, PFOS)有稳定的C—F化学结构,具有化学稳定性高、耐热性高和表面活性高的特点,是一种持久性有机污染物。PFOS作为表面活性制剂在工业以及民用领域应用十分广泛,例如纺织业、皮革、食品包装和洗涤剂等。这些产品的大量使用使PFOS以各种途径进入到环境及生物体内,并通过食物链逐级累积传递。
海洋是PFOS类污染物的最终归宿[1]。近年来,世界多地的海水和海洋生物体内不断检出PFOS。Gulkowska等[2]测得来自广东省和浙江省的包括鱼类、螃蟹、小虾、牡蛎、蚌和蛤等27个海洋样品中,PFOS浓度范围为0.3~13.9 ng·g-1湿重。近年来,毒理学研究表明,PFOS进入生物体内能够影响基因表达,改变生物酶活性,导致胚胎发育畸形,致使生物体重下降,影响胆固醇水平等[3-7]。长期暴露于低浓度PFOS中,可导致斑马鱼胚胎脊柱畸形,大型蚤(Daphniamagna)的繁殖受到抑制[8],使黄海胆(Glyptocidariscrenulares)DNA甲基化水平升高[9]等。Houde等[10]还发现处于相对较高营养级的动物体内PFOS浓度较高。这说明,水环境和水生生物体内的PFOS可通过食物链的传递和生物富集作用影响到更高营养级生物,威胁人类的健康。因此,各国相继出台了各种措施限制禁止了PFOS类物质的使用[11],PFOS也迅速成为近年来人们关注的热点[12]。
半滑舌鳎(Cynoglossussemilaevis)生长快,适应范围广,营养价值高,近年来已成为增殖放流和人工养殖的最佳品种之一;在我国的黄渤海、东海和南海均有分布,以渤海、黄海海域为多[13],是一种典型的近岸海洋海区鱼类。目前,对半滑舌鳎的研究主要集中在各种环境因子对其生长发育的影响[14-15],以及各种金属离子对半滑舌鳎的毒性作用方面[16]。党红蕾等[17]从细胞水平研究了PFOS对半滑舌鳎肝细胞的毒性效应,表明PFOS对半滑舌鳎肝细胞具有一定的生物毒性。
本实验以半滑舌鳎为研究对象,首次从基因表达水平上,运用RT-PCR分析半滑舌鳎热休克蛋白70(heat shock 70kDa protein1,hsp70)、热休克蛋白90(heat shock 90kDa protein,hsp90)、C型凝集素(c-type lectin domain,c-typelectin)和细胞色素氧化酶(cytochrome c oxidase,cox)等4种免疫相关基因在半滑舌鳎不同组织器官中随时间的表达变化,从mRNA转录水平上探讨PFOS对半滑舌鳎的毒性影响。为研究PFOS污染对健康养殖和海洋生态环境的影响,以及保护重要水产经济种类提供更多的理论依据。
1 材料与方法(Materials and methods)
1.1 实验动物
半滑舌鳎幼鱼取自天津市兴盛海淡水养殖有限责任公司。实验鱼体长范围为12~16 cm,6月龄,在实验室暂养一周以上,暂养期间无死亡。实验前一天停止投饵。选择体型正常,反应灵敏,大小基本一致,外观无异常现象的幼鱼进行随机分组。
1.2 主要试剂及仪器
全氟辛烷磺酸钾(C8F17KO3S),纯度为AR级(Sigma公司,美国),溶解于纯度>99%的二甲基亚砜(dimethyl sulfoxide,DMSO)(上海生工),配成浓度为10 g·L-1的母液,使用时稀释成所需要的浓度。
Trizol(Invitrogen),cDNA第一链合成试剂盒All-in-OneTMFirst-Strand cDNA Synthesis Kit(GeneCopoeia公司),Platinum®SYBR®Green qPCR SuperMix-UDG(Life Technologies公司),其他试剂均为国产分析纯。
Epgiadients PCR仪(Eppendorf,德国),ABI 7500实时荧光定量PCR仪(Life Technologies公司,美国)
1.3 染毒与取样方法
根据预实验结果,实验浓度设置为2 mg·L-1,设置3个平行组,同时设有DMSO对照组。实验容器为40 L透明玻璃缸,每缸水量25 L,放入半滑舌鳎幼鱼6~10尾,供试海水取自自然海水,经沉淀池沉淀和砂滤后待用。实验期间海水pH值为7.6~8.0,温度18~22 ℃。实验过程中昼夜曝气,每天换水1/2。实验期间各组未出现死亡现象。
实验中分别于24 h、48 h、96 h和7 d取出半滑舌鳎的肝、鳃、肠和肌肉组织,每次每个时间点随机取出5尾,其中将3尾鱼的组织随机合成一个样本进行测定,每个时间点共有3个平行样本。组织取出后,用预冷的0.9%生理盐水冲洗,滤纸吸干,称重后装袋密封,放入-80 ℃冰箱中保存备用。
1.4 总RNA提取和第一链cDNA合成
将保存于-80 ℃冰箱的样品取出后于冰上融化,按Trizol试剂说明书提取总RNA,电泳检测完整性,核酸定量仪检测其浓度和纯度,保证其OD260/OD280=1.8~2.0。利用DNaseI处理RNA,去除残留的基因组DNA污染。
以总RNA(约1 μg)为模板,按照All-in-OneTMFirst-Strand cDNA Synthesis Kit (GeneCopoeia Cat. No. AORT-0050)说明书对各组织的总RNA进行反转录,合成第一链cDNA。反应产物4 ℃备用,或者-20 ℃保存。
1.5 引物设计及荧光定量PCR扩增
1.5.1 引物设计
根据NCBI数据库上半滑舌鳎的相关基因序列,分别设计各基因的荧光定量PCR引物,相关基因包括hsp70、hsp90、c-typelectin和cox。选择基因稳定表达及片段大小合适的β-actin(putative beta-actin,β-actin)为内参基因。具体序列与产物大小如表1所示。
1.5.2 荧光定量PCR扩增
按照Platinum®SYBR®Green qPCR SuperMix-UDG试剂盒说明书进行操作,在荧光定量仪ABI 7500 Fast Real-Time PCR system上进行荧光定量PCR扩增。反应体系为20 μL,含cDNA模板1 μL,上、下游引物各2 μL(终浓度为0.2 μmol·L-1),SYBR®Green qPCR SuperMix(2×)10 μL,以ddH2O补足体积。PCR反应程序为:95 ℃预变性10 min;循环条件为95 ℃、15 s,60 ℃、30 s,72 ℃、30 s,PCR循环40。扩增结束后进行熔解曲线分析,确定PCR质量,熔解曲线条件为95 ℃、15 s,60 ℃、1 min,95 ℃、15 s,60 ℃、15 s。
相对定量参考Livak和Schmittgen的方法[18],运用2-△△CT法计算目的基因的表达倍数,△△CT=(CT目的基因-CT管家基因)实验组-(CT目的基因-CT管家基因)对照组。
采用SPSS 23.0软件对组间数据进行单因素方差分析(One-Way ANOVA),P<0.05、P<0.01表明差异显著。所有结果以平均值±标准差(mean±SD)表示。
2 结果(Results)
在PFOS暴露期间,各对照组和实验组均无实验鱼死亡及行为异常,说明实验浓度范围内PFOS对半滑舌鳎无可观测的急性毒性作用。
2.1 PFOS暴露下hsp70 mRNA在半滑舌鳎各组织中的相对表达量分析
PFOS暴露对半滑舌鳎不同组织hsp70 mRNA表达的影响如图1所示。半滑舌鳎hsp70 mRNA相对表达量在各组织中几乎均上调。半滑舌鳎肝组织中hsp70 mRNA相对表达量高于对照组,在24 h达到峰值(P<0.05),随后呈现下降趋势,至7 d时已基本恢复至对照组水平(P>0.05)(图1(a))。鳃组织hsp70 mRNA表达量呈现先升高、再下降的趋势,在48 h达到峰值(P<0.05),至7 d时与对照组无显著差异(P>0.05)(图1(b))。肠组织中hsp70 mRNA表达量在48 h内与对照组并无显著差异(P>0.05),96 h升高达到最高值(P<0.05),随后呈现下降趋势。肌肉组织hsp70 mRNA的相对表达量呈现先下降后升高的趋势,48 h降至最低(P<0.05),96 h升高至峰值(P<0.05),随后7 d时回落至对照组水平(P>0.05)。

表1 实验所用的引物序列Table 1 Primers used for all the expriments
2.2 PFOS暴露下hsp90 mRNA在半滑舌鳎各组织中的相对表达量分析
PFOS暴露对半滑舌鳎不同组织hsp90 mRNA表达的影响如图2所示。肝组织中hsp90 mRNA的表达量与对照组相比呈显著性差异(P<0.05),呈现先降低后升高,再降低的趋势,在48 h达到最高值(P<0.05)(图2(a))。鳃组织hsp90 mRNA表达量48 h和7 d时与对照组呈显著性差异(P<0.05)(图2(b))。肠组织hsp90 mRNA表达量呈现先上升后下降的趋势,在48 h和96 h达到顶峰,7 d后与对照组无显著差异(P>0.05)。肌肉组织hsp90 mRNA表达量与对照组相比呈现显著下调(P<0.05)。
2.3 PFOS暴露下c-type lectin mRNA在半滑舌鳎各组织中的相对表达量分析
PFOS暴露对半滑舌鳎不同组织c-typelectinmRNA表达的影响如图3所示。随着PFOS暴露时间的延长,各组织中c-typelectinmRNA表达量均呈下调表达或表达水平不变。肝组织中c-typelectinmRNA表达呈下调趋势,在24 h下降至最低点,随后48 h~7 d时恢复至对照组水平(P>0.05)(图3(a))。鳃组织中c-typelectinmRNA呈下调表达,其表达量呈现先下降再升高,再下降的趋势,在7 d时达到最低值,与对照组相比呈显著差异(P<0.05)(图3(b))。肠组织中c-typelectinmRNA表达量与对照组没有明显差异(P>0.05)(图3(c))。肌肉组织中c-typelectinmRNA各时间段表达量下调(P<0.05),其相对表达量在48 h达到最低值(图3(d))。

图1 半滑舌鳎不同组织热休克蛋白hsp70 mRNA表达量随全氟辛烷磺酸盐(PFOS)暴露时间的变化注:(a)肝,(b)鳃,(c)肠,(d)肌肉;*表示与对照组相比差异显著(P<0.05)。Fig. 1 Changes of hsp70 mRNA expression in Cynoglossus semilaevis after exposure to perfluorooctane sulfonate (PFOS)Note: (a) Liver, (b) Gill, (c) Intestine, (d) Muscle; *means significant difference between PFOS treatment group and control group at 0.05 level.

图2 半滑舌鳎不同组织hsp90 mRNA表达量随PFOS暴露时间的变化注:(a)肝,(b)鳃,(c)肠,(d)肌肉;*表示与对照组相比差异显著(P<0.05)。Fig. 2 Changes of hsp90 mRNA expression in Cynoglossus semilaevis after exposure to PFOSNote: (a) Liver, (b) Gill, (c) Intestine, (d) Muscle; *means significant difference between PFOS treatment group and control group at 0.05 level.
2.4 PFOS暴露下cox mRNA在半滑舌鳎各组织中的相对表达量分析
PFOS暴露对半滑舌鳎不同组织coxmRNA表达的影响如图4所示。随着PFOS暴露时间的延长,肝组织中cox基因表达下调,其24 h和48 h的相对表达量显著低于对照组(P<0.05),96 h时coxmRNA表达量恢复至对照组水平(P>0.05)(图4(a))。鳃组织中coxmRNA表达量呈现先升高再降低的趋势,48 h时coxmRNA表达量升至最高点,与对照组差异显著(P<0.05)(图4(b))。肠组织中coxmRNA表达出现下调,其相对表达量在24 h和48 h显著低于对照组(P<0.05),在96 h恢复至对照组水平(P>0.05)(图4(c))。肌肉组织中coxmRNA表达量在24 h与对照组差异显著(P<0.05),随后于48 h和96 h回落至对照组水平(P>0.05)(图4(d))。
3 讨论(Discussion)
目前,PFOS的毒性作用机制虽尚未完全阐明,但大量研究表明,PFOS能引起多种生物的基因转录表达发生变化[19-22]。本实验选择了hsp70、hsp90、c-typelectin和cox等4种可能与PFOS免疫毒性相关的基因,其中,hsp70和hsp90属于热休克蛋白家族,是生物体应对外界压力的标志性基因;c-typelectin是固有免疫系统中的重要模式识别受体;cox是线粒体呼吸链的重要组成部分,其基因表达量变化可以直接反映出受到外界压力时机体的能量运转情况。本研究通过RT-PCR技术检测PFOS暴露24 h、48 h、96 h和7 d后,半滑舌鳎各组织中基因表达的变化,初步探讨PFOS对半滑舌鳎的免疫毒性作用。
热休克蛋白的主要功能是维持生物体内环境的稳态。当机体暴露在重金属、有机物和高温等恶劣条件下,机体发生应激反应,热休克蛋白会大量表达,从而帮助机体每个细胞维持正常的生理活动,阻止影响细胞健康的蛋白质相互作用[23-24]。San-segundo等[19]认为hsp70的激活可以由化学物质和蛋白质之间的直接相互作用产生,也可以由氧化应激、离子稳态或能量代谢抑制剂引起的细胞氧化还原状态的扰动所造成的损伤而产生。因此,PFOS作为hsp70诱导剂,可能直接或间接与热休克蛋白发生相互作用,诱导hsp70的大量表达。笔者推测PFOS进入机体细胞后,通过与热休克转录因子结合,使hsp70基因第一时间被激活并大量表达,为机体提供了主要的防御机制。具体的结合及调节机制还需进一步的证实。

图3 半滑舌鳎不同组织c-type lectin mRNA表达量随PFOS暴露时间的变化注:(a)肝,(b)鳃,(c)肠,(d)肌肉;*表示与对照组相比差异显著(P<0.05)。Fig. 3 Changes of c-type lectin mRNA expression in Cynoglossus semilaevis after exposure to PFOSNote: (a) Liver, (b) Gill, (c) Intestine, (d) Muscle; *means significant difference between PFOS treatment group and control group at 0.05 level.
研究表明,鱼类肝脏是PFOS的主要富集场所[20]。在本实验中,hsp70基因在肝组织中的相对表达在24 h达到峰值,达到对照组的23倍左右,表达高峰值的出现也早于其他组织,这表明,肝组织对PFOS胁迫反应较为灵敏,在受到应激反应后迅速启动了hsp70基因的表达。Krøvel等[20]也发现类似现象,将大西洋鲑的肝细胞体外分离后,将其暴露于15 mg·L-1的PFOS中24 h后,hsp70 mRNA表达量显著增加。PFOS还能够引起肝细胞结构和细胞膜的交互功能损伤[25-27]。因此,在受到PFOS胁迫后,肝是发生免疫应激反应的主要器官,在应对有毒物质入侵的免疫反应中占据重要地位。
通过实验数据发现,半滑舌鳎鳃、肠和肌肉中的hsp70基因的相对表达在48 h或96 h达到峰值,表达量是对照组的2~5倍左右。而在长时间受到PFOS胁迫后,hsp70基因的表达都呈现下降趋势,肝、鳃和肌肉组织在PFOS胁迫7 d时hsp70基因表达量均已恢复至对照组水平,推测当胁迫时间超过一定限度时,鱼体免疫功能逐渐下降,从而导致hsp70表达慢慢回落;也可能是hsp70只参与了鱼类机体对抗有毒物质的应急机制,随着胁迫时间的延长,机体启动另一套免疫机制来对抗有毒物质的入侵。东亚三角涡虫[28]和大西洋鲑[20]的暴露实验结果也表明,暴露于PFOS中24 h后,hsp70 mRNA表达显著上升,暴露于PFOS中48 h后,其表达量明显下降,与本实验的研究结果一致。
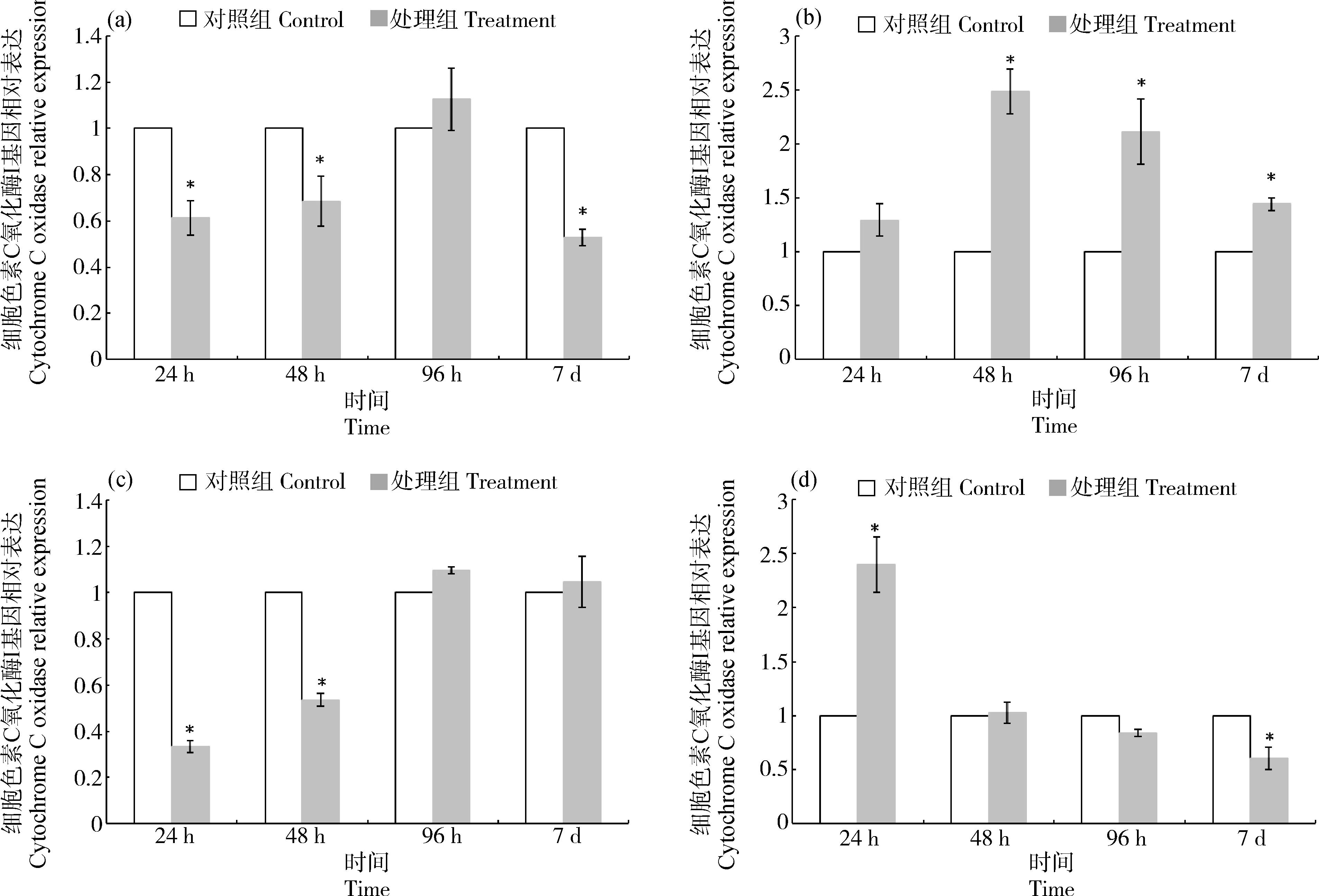
图4 半滑舌鳎不同组织cox mRNA表达量随PFOS暴露时间的变化注:(a)肝,(b)鳃,(c)肠,(d)肌肉;*表示与对照组相比差异显著(P<0.05)。Fig. 4 Changes of cox mRNA expression in Cynoglossus semilaevis after exposure to PFOSNote: (a) Liver, (b) Gill, (c) Intestine, (d) Muscle; *means significant difference between PFOS treatment group and control group at 0.05 level.
热休克蛋白hsp90在进化上高度保守,广泛分布于从原核到真核的各类生物体内,在水生动植物的诱导表达研究中发现,hsp90可以参与水生动植物对热激和冷激、高盐和低盐以及对低溶氧的耐受,还参与了疾病防御、发育调控等方面的生理过程[29]。本研究中,hsp90在半滑舌鳎肝、肠中均呈现了先升高再降低的趋势,在48 h达到最大值,7 d后恢复至对照组水平。在胁迫条件下,hsp90通过降解变性蛋白和运送蛋白质而保护有机体免受不利环境胁迫伤害,因此,hsp90基因表达升高是机体对胁迫导致的变性蛋白质增多做出的响应。随着胁迫时间进一步延长,机体组织细胞受到损伤,降低了正常细胞的代谢能力,导致了hsp90表达降低。鳃组织中hsp90基因的相对表达量在7 d后达到峰值,可能是由于全氟化合物具有生物积累作用,随着积累量的增加,hsp90在7 d后表达才达高峰,一定程度上反映了PFOS积累量与鳃组织免疫机能的关系。肌肉组织hsp90基因的相对表达受到抑制,这可能与基因表达的组织特异性有关,肌肉组织不是关键的免疫器官,因此,在机体受到PFOS胁迫时,体内的转录调节体系优先上调或正常表达免疫相关的组织中的hsp90基因。
本研究结果也表明,hsp70和hsp90基因在半滑舌鳎各组织中出现时序性表达,肝组织中hsp70和hsp90达到最大值的时间点分别是24 h和48 h,hsp90较hsp70延迟;鳃组织中hsp70在48 h达到峰值,而hsp90在7 d后再次上升至峰值;肠组织中达到峰值的时间分别是96 h和48 h,hsp70较hsp90延迟。这表明,hsp70和hsp90虽都是热休克蛋白家族的成员,但在半滑舌鳎受到PFOS胁迫过程中,它们在不同组织中的响应机制完全不同。本研究中,同一基因在不同组织的表达具有一定的组织特异性,这与组织的功能定位及基因参与不同的免疫通路等有关,具体的调节机制还有待进一步研究。
c-type lectin是一类具有糖识别结构域(carbon hydrate recognition domain, CRD)的蛋白超家族,在进化中存在高度保守序列,作为模式识别蛋白参与了众多动物的先天免疫[30-34]。目前,关于c-typelectin基因表达的报道多集中于其在生物体感染致病微生物的过程中发挥重要的免疫功能[35-36]。Feng等[37]发现,罗氏沼虾在受到副溶血弧菌和白斑综合征病毒(WSSV)刺激后,鳃和肠中的MrLec基因表达量均上调。Wang等[38]发现,仿刺参在受到灿烂弧菌刺激后,体腔细胞中的CTL-2 mRNA表达水平显著上升。
本研究中,c-typelectin基因表达量与对照组相比呈显著下调或无明显差异。肝、鳃和肌肉组织中c-typelectin基因表达水平在PFOS胁迫后都出现了显著降低的情况,肠组织中c-typelectin基因表达水平在PFOS胁迫后没有显著性变化,与致病微生物刺激后c-typelectin的基因表达趋势不同。赵芳芳等[39]单独用镉胁迫河南华溪蟹不同时间,肝胰腺、血淋巴中的ShLec21和ShLec23表达量没有显著性变化;而镉胁迫河南华溪蟹后再经细菌感染后,肝胰腺和血淋巴中ShLec21和ShLec23表达量在有些时间段上调。本研究中,除了肠组织,肝、鳃和肌肉组织中的c-typelectin基因在PFOS暴露后均有表达下调而后又上升的情况,可能是由于c-typelectin基因并不参与PFOS的免疫识别,暴露初期,鱼体免疫系统为应激防御有毒物质,从而降低了不相关基因的表达,而PFOS暴露损伤了鱼体的免疫系统,进而导致水体中致病菌的入侵,c-typelectin基因此时才启动表达。综上可知,不同的外源刺激对生物体内c-typelectin基因表达的影响也不相同,C型凝集素作为一种模式识别受体,其特有的结构域能够识别、结合微生物并在其免疫防御过程中发挥重要作用,而对非生物因子刺激,C型凝集素扮演什么样的角色还有待进一步研究。
细胞色素c氧化酶(cox)是线粒体呼吸链电子传递的终末复合物,是线粒体呼吸链的主要限制酶,cox基因表达量的变化可以反映整条呼吸链的效率[40]。而机体在受到外来物质刺激时,其蛋白质利用及糖类的代谢都会大大增加,这些代谢的加快都需要依赖能量的供应,因此,线粒体呼吸链的能量供应与机体的免疫机能息息相关。党红蕾等[17]对半滑舌鳎肝脏细胞系进行PFOS染毒,发现低浓度PFOS(20 μmol·L-1)进入细胞后,通过与线粒体呼吸链辅酶结合,产生活性氧(ROS)并阻碍三磷酸腺苷(ATP)合成过程,产生一系列反应从而诱导细胞启动DNA修复。本研究中,鱼体暴露于PFOS后,鳃组织和肌肉中cox基因相对表达量分别在24 h和48 h上调至峰值,随后回落。Achard-Joris等[41]认为cox基因上调是为了更有效地消耗分子氧并弥补线粒体活力的下降,通过减少细胞中的活性氧来降低PFOS对机体细胞的损害。而肝和肠组织中cox基因相对表达量显著下调,推测PFOS所造成的损伤超出细胞自身修复能力导致了cox基因表达的下降。以上结果表明,PFOS能够对cox基因表达产生影响,进而影响鱼体线粒体能量供应以及细胞的正常运转。
PFOS可影响多种免疫相关基因的表达,本实验仅选取了其中4个基因对PFOS的免疫毒性进行了初步探讨,PFOS的对机体的免疫毒性机制还远不能被准确阐述,还有待于大量实验数据的积累,并需要结合功能蛋白的表达等多方面的研究结果进行综合分析。目前,PFOS的生产和使用已受到严格控制,其在自然水域中的浓度远低于本文中的实验浓度,但是PFOS在生态系统中的富集效应会对食物链高端生物构成潜在威胁,因此,对PFOS毒性仍需作进一步研究。
