纳米银复合材料与抗生素的联合抗菌性能及相关机制研究
2020-07-02王孟珍孙昊宇龙茜林志芬
王孟珍,孙昊宇,龙茜,林志芬
污染控制与资源化研究国家重点实验室,同济大学环境科学与工程学院,上海 200092
抗生素被广泛应用于医疗卫生、农业和畜牧业等领域,对感染性疾病的防治起到关键作用。然而,近年来抗生素的滥用使得细菌耐药问题不断加剧,导致抗菌剂在治疗细菌感染时药效降低甚至完全失效,这较抗菌剂自身的毒性而言对生态安全和人类健康威胁更大[1]。在此情况下,人类迫切需要开发出新的抗菌药物以减少细菌耐药问题。纳米银作为一种新型的抗菌药物,其能穿透微生物的细胞壁进入细菌体内,与巯基结合后破坏细菌的呼吸链并产生活性氧簇抑制细菌生长[2]。相较于传统的银离子,纳米银具有较高的价态和巨大的比表面积,不易被氧化和沉淀,因此纳米银的使用越来越广泛[3]。但是,单一纳米银有释放速度快、易团聚和不稳定等缺点。为了克服这些缺点,有研究人员将纳米银与其他材料制备成纳米银复合材料,不仅能够对纳米银起到稳定和保护作用,还能降低纳米银的释放速度从而获得较好的持效抑菌性能[4-5]。例如,Badu等[6]将纳米银/聚吡咯复合材料覆于棉织物上,通过琼脂扩散板测试实验发现,复合材料在6 h后杀灭大肠杆菌率达100%,而在12 h后杀灭金黄色葡萄球菌率达100%。Tang等[7]在氧化石墨烯的悬浮液中通过柠檬酸钠还原硝酸银制备得到氧化石墨烯-银纳米复合材料并进行毒性实验,发现其对革兰氏阴性菌和革兰氏阳性菌都具有较好的杀菌效果。因此,制备纳米银复合材料并开展其抗菌性能研究对生态安全和人类健康具有重要意义。
在纳米银复合材料的制备过程中,研究比较广泛的纳米银载体材料有沸石[8]、碳纳米管[9]、氧化石墨烯[10]以及纳米二氧化硅[11]等。其中,纳米二氧化硅与其他几种载体材料相比,具有高载药量、良好的生物相容性、低细胞毒性和高比表面积等优势。此外,纳米银与二氧化硅载体结合的时候,既可以被包裹在二氧化硅微球的内部,也可以黏附在其外层,或者两者同时兼具[12-14]。因此,以纳米二氧化硅作为载体制备纳米银复合材料具有广阔的应用前景。
此前关于纳米银抗菌性能的研究表明,纳米银和抗生素联合使用可以产生协同抗菌效果[15-16]。例如,郭春兰等[17]通过观察伤口病原菌和耐药菌阳性率的变化,发现纳米银敷料结合青霉素等抗生素治疗慢性感染伤口具有协同抗菌作用,有助于伤口愈合。Li等[15]认为纳米银更容易与细菌细胞膜的磷脂和糖蛋白反应,可作为载体有利于阿莫西林向细胞表面运输,从而抗菌效果更明显。由此看出单一纳米银与某些抗生素的联合使用可以达到协同杀菌效果,但是有关纳米银复合材料与抗生素联合使用的抗菌性能研究却十分有限。那么,纳米银复合材料与传统抗生素联合暴露是否比单一纳米银复合材料的抗菌效果好?其联合抗菌机制又是如何?这是本文所关注的问题。
本文首先通过溶胶-凝胶法制备出二氧化硅微球作为载体材料,并参考宋笑等[18]报道的方法制备出3种不同结构的纳米银复合材料并简单表征,最后分别测定3种纳米银复合材料对大肠杆菌(Escherichiacoli,E.coli)和枯草芽孢杆菌(Bacillussubtilis,B.subtilis)的单一毒性及AgNPs@SiO2-PD-AgNPs与硫酸卡那霉素(kanamycin sulfate, KS)/盐酸土霉素(oxytetracycline hydrochloride, OH)对受试菌的二元联合毒性。本文旨在得到具有良好抗菌性能的纳米银复合材料,并探索可以产生协同抗菌作用的纳米银复合材料与抗生素的组合,为开发新型抗菌材料提供思路并为其进一步推广使用提供参考。
1 材料与方法 (Materials and methods)
1.1 实验材料
正硅酸四乙酯、氨水(25%~28%)、无水乙醇、甲醇、甲醛和盐酸(36%~38%)均购自国药集团化学试剂有限公司(上海,中国),纯度均为分析纯。多巴胺盐酸盐、三羟甲基氨基甲烷、十六烷基三甲基溴化铵和硝酸银购自上海阿拉丁生化科技股份有限公司(上海,中国),纯度均为分析纯。盐酸土霉素和硫酸卡那霉素购自Sigma-Aldrich化学制品有限公司(上海,中国),纯度为分析纯以上。
本实验中使用的模式生物E.coli(K-12 MG1655)和B.subtilis(168)购自BioVector科技有限公司(北京,中国)。
1.2 纳米银复合材料的制备
1.2.1 纳米二氧化硅(SiO2)的制备
将9 mL的氨水与24.75 mL的去离子水及16.25 mL的无水乙醇混匀得到溶液A;将4.5 mL的正硅酸四乙酯与45.5 mL的无水乙醇混合,用85-1型磁力搅拌器(武汉科尔仪器有限公司,武汉,中国)以1 100 r·min-1转速搅拌20 min,得到溶液B。室温下将B溶液快速加入A溶液中,60 s后将搅拌速度降低至350~400 r·min-1。反应2 h后将溶液进行离心,去掉上清液,沉淀物用乙醇反复洗涤3次后,用DZF-6050型真空干燥箱(上海精宏仪器有限公司,上海,中国)干燥,得到纳米SiO2粒子。
1.2.2 纳米银@二氧化硅(AgNPs@SiO2)的制备
将0.2 g的十六烷基三甲基溴化铵、96 mL的去离子水和2.8 mL的氨水加入到三口烧瓶中,不断搅拌,加热至80 ℃后反应30 min。此时向烧瓶中加入1 mL的硝酸银溶液(0.1 mol·L-1)和0.6 mL的甲醛溶液(1.0 mol·L-1),搅拌5 min后,向混合体系逐滴滴加1 mL的正硅酸四乙酯。反应2 h后将溶液进行离心,去掉上清液,沉淀物用去离子水洗涤后加入80 mL的0.1 mol·L-1的盐酸/乙醇溶液,在80 ℃条件下加热回流4 h后,将溶液进行离心,去掉上清液,将沉淀物真空干燥后得到AgNPs@SiO2粒子。
1.2.3 二氧化硅-聚多巴胺-纳米银(SiO2-PD-AgNPs)的制备
将50 mL 0.1 mol·L-1的三羟甲基氨基甲烷溶液与14.7 mL 0.1 mol·L-1的盐酸混合,加水定容至100 mL,得到pH=8.5的三羟甲基氨基甲烷缓冲溶液。将0.06 g的多巴胺盐酸盐和0.05 g的SiO2颗粒加入30 mL三羟甲基氨基甲烷缓冲溶液中,室温下避光搅拌过夜。将反应产物过滤洗涤后,加到20 mL的硝酸银(1.5 mg·mL-1)溶液中,氮气保护下80 ℃反应30 min。将溶液进行离心,去掉上清液,沉淀物用乙醇反复洗涤3次后真空干燥,得到SiO2-PD-AgNPs粒子。
1.2.4 纳米银@二氧化硅-聚多巴胺-纳米银(AgNPs@SiO2-PD-AgNPs)的制备
将SiO2-PD-AgNPs制备过程中的SiO2替换为AgNPs@SiO2,按照同样的方法反应合成AgNPs@SiO2-PD-AgNPs粒子。
1.3 毒性测定及表征方法
1.3.1 受试菌的培养
液体培养基配方为10.0 g·L-1氯化钠、25.0 g·L-1蛋白胨和12.5 g·L-1酵母膏,pH调节至约为7.0。取E.coli或B.subtilis菌种接种到5 mL液体培养基中,在37 ℃恒温条件下震荡培养(E.coli为6 h,B.subtilis为10 h)至对数生长期,将菌液用1%氯化钠溶液稀释105倍,用于毒性测定。
1.3.2 毒性实验
称取待测样用1%氯化钠溶液配制成母液,将母液用1%氯化钠溶液稀释成等对数梯度的浓度加入96孔板中。每孔溶液总体系为200 μL,其中包括80 μL培养基、40 μL工作菌液以及80 μL待测物质溶液,每个浓度梯度设置3个平行,37 ℃下180 r·min-1震荡培养(E.coli培养12 h,B.subtilis培养19 h),使用GO1510型多功能酶标仪(Thermo Fisher公司,沃尔瑟姆,美国)测定600 nm处的光密度值(OD600)。根据式(1)计算测试样对细菌的抑制率。

(1)
式中:OD600,0为受试菌在无染毒作用下的空白OD600读数的平均值;OD600,i为受试菌在浓度为i的化合物作用下OD600读数的平均值。以测试样浓度的负对数为横坐标,抑制率为纵坐标,绘制剂量-效应曲线,50%抑制率时对应的测试样浓度即为半最大效应浓度(concentration for 50% of maximal effect, EC50)。
EC50是一个经典参数,已在毒理学研究中长期使用。作为衡量物质生物毒性大小的指标,EC50值越小表示物质的毒性越大[19]。根据单独毒性实验研究中每种抗菌剂对受试菌的EC50浓度值来确定配制测试样A(纳米银复合材料,本研究中选用AgNPs@SiO2-PD-AgNPs进行联合毒性实验)与测试样B(KS/OH)的混合溶液浓度,按照AgNPs@SiO2-PD-AgNPs与KS/OH的EC50配制系列二元混合溶液,其毒性比分别为1∶1、1∶5和5∶1。然后按照单一毒性测定方法测定系列混合溶液的联合毒性,并绘制剂量-效应曲线,计算出EC50mix。EC50mix和毒性单位(toxic unit, TU)都是用来表征混合毒性效应的重要参数,TU法参数的物理意义比较明确,计算简捷,评价结果便于理解,用此模型来判断混合物的联合作用结果较为可靠,可以直观地判断出混合毒性的联合效应类型,因此得到广泛的应用[20]。联合毒性的研究是依据单一测试样的EC50来设计的,将单一测试样对受试菌的抑制率为50%时对应的浓度定义为一个毒性单位[21],实验所得联合毒性效应使用的TU的计算如式(2)。
(2)
式中:CA、CB是混合体系产生50%抑制时测试样A、B各自的浓度,EC50A和EC50B是测试样A、B分别作用于细菌时产生50%抑制时的浓度。当TU<0.8时,判定联合毒性效应为协同;当0.8≤TU≤1.2时,判定联合毒性效应为相加;当TU>1.2时,判定联合毒性效应为拮抗[22]。
2 结果与讨论(Results and discussion)
2.1 纳米银复合粒子的表征
使用ZEN3690型粒度分析仪(Malvern公司,马尔文,英国)对复合材料的粒径以及分散系数进行分析,结果如表1所示。AgNPs@SiO2的粒径是553.7 nm,分散系数为0.725;SiO2-PD-AgNPs的粒径是743.6 nm,分散系数为0.547;AgNPs@SiO2-PD-AgNPs的粒径是974.6 nm,分散系数为0.392。可见,3种纳米银复合材料的粒径大小排序为:AgNPs@SiO2-PD-AgNPs>SiO2-PD-AgNPs>AgNPs@SiO2,其中AgNPs@SiO2-PD-AgNPs的分散系数最小,其分散度最好。
此外,用Evolution 350型紫外可见分光光度计(Thermo Scientific公司,沃尔瑟姆,美国)检测3种纳米银复合材料的紫外吸收光谱。结果如图1(a)所示,AgNPs@SiO2无紫外吸收,AgNPs@SiO2-PD-AgNPs和SiO2-PD-AgNPs在475 nm左右产生了最大紫外吸收峰。已有研究表明,纳米银的最大紫外吸收峰在420 nm左右[23-24],所以笔者推测475 nm左右处的最大紫外吸收峰很可能与复合材料中的纳米银有关。对于AgNPs@SiO2,在其制备过程中,甲醛作为还原剂还原硝酸银为纳米银,纳米银被包覆于SiO2微球的孔洞中,因此没有明显的紫外吸收峰,推测其结构如图1(b)所示。而在SiO2-PD-AgNPs的制备过程中,多巴胺会聚合成为聚多巴胺并在SiO2表面形成一层薄膜,随后聚多巴胺还原硝酸银为纳米银后被包覆在聚多巴胺薄膜外面,因此可以检测到紫外吸收峰,其推测结构如图1(b)所示。AgNPs@SiO2-PD-AgNPs结合了前面2种复合材料的特点,SiO2内层和表面都存在纳米银粒子,具有明显的夹心层结构,所以也会出现紫外吸收峰,推测结构如图1(b)所示。此外,纳米银最大吸收峰的位置和形状在很大程度上取决于其粒径、表面吸附的物质以及周围的电介质[25-26]。在AgNPs@SiO2-PD-AgNPs和SiO2-PD-AgNPs这2种复合材料中,由于SiO2的折射率略高于水,纳米银与SiO2的结合导致纳米银周围基质的介电常数与折射率都有所增加,因此,AgNPs@SiO2-PD-AgNPs和SiO2-PD-AgNPs的最大紫外吸收峰(475 nm左右)相对于纳米银的最大紫外吸收峰(420 nm左右)发生了红移。
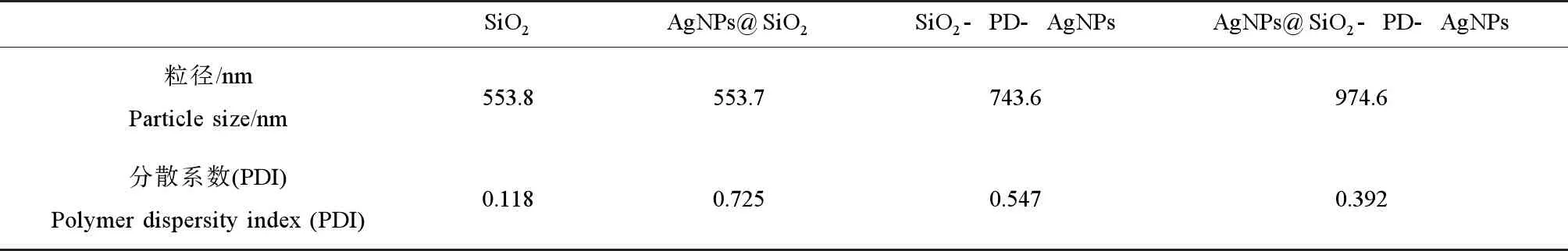
表1 纳米银复合材料的粒径和分散系数Table 1 Particle size and polymer dispersity index of nanosilver composites
注:AgNPs@SiO2为纳米银@二氧化硅复合材料,SiO2-PD-AgNPs为二氧化硅-聚多巴胺-纳米银复合材料,AgNPs@SiO2-PD-AgNPs为纳米银@二氧化硅-聚多巴胺-纳米银复合材料。
Note: AgNPs@SiO2stands for nanosilver@silica; SiO2-PD-AgNPs stands for silica-polydopamine-nanosilver; AgNPs@SiO2-PD-AgNPs stands for nanosilver@silica-polydopamine-nanosilver.
2.2 单一毒性
3种纳米银复合材料对E.coli和B.subtilis的单一毒性数据如表2所示。由实验结果可知,AgNPs@SiO2、SiO2-PD-AgNPs和AgNPs@SiO2-PD-AgNPs对E.coli的EC50分别为65.7、90.7和48.2 mg·L-1,对B.subtilis的EC50分别为466.4、560.0和161.5 mg·L-1。可见3种纳米银复合材料对2种菌的毒性大小顺序一致,均为AgNPs@SiO2-PD-AgNPs>AgNPs@SiO2>SiO2-PD-AgNPs。
此前,已有研究阐明纳米银复合材料主要依靠纳米银和Ag+进入细胞内阻断DNA复制和产生活性氧诱导细胞凋亡来杀死细菌[27]。根据纳米银复合材料抗菌机理的相关研究[28],以AgNPs@SiO2为例,推测其抗菌机理如图2(a)所示。AgNPs@SiO2吸附在细菌表面,在与细胞接触的过程中,纳米银粒子通过硅壳孔道释放出来(如图2(b)),纳米银可能会影响细胞壁上的某些蛋白质和磷脂,诱导膜破裂,影响细胞膜的完整性[29-30],从而使细胞膜通透性增加,进而导致细胞内容物释放。在此过程中,纳米银会释放出Ag+[29,31]。纳米银和Ag+进入到胞内,一方面导致活性氧簇(ROS)的产生,Ag+被氧化为Ag2O,从而灭活呼吸链脱氢酶,抑制细胞呼吸;另一方面Ag+通过与细菌蛋白酶上的巯基(—SH)迅速结合,破坏蛋白质的三维结构,抑制细菌生命活动必需的酶和蛋白质的活性[32],并通过浓缩DNA使其失去复制能力而引起DNA的降解来抑制细菌的生长繁殖[33],最后达到抑菌效果。SiO2-PD-AgNPs和AgNPs@SiO2-PD-AgNPs的纳米银和Ag+的释放过程如图2(c)和图2(d)所示。对于SiO2-PD-AgNPs,因为纳米银粒子覆盖在最外层,所以在与细菌接触的过程中直接释放。由于AgNPs@SiO2-PD-AgNPs具备前面2种材料的特点,因此其最外层的纳米银先流失,然后聚多巴胺膜被水解破坏,最后SiO2内部的纳米银被释放出来。在纳米银释放之后,SiO2-PD-AgNPs和AgNPs@SiO2-PD-AgNPs的抗菌机制与AgNPs@SiO2类似。

图1 3种纳米银复合材料的紫外可见吸收光谱(a)与结构(b)注:1. AgNPs@SiO2-PD-AgNPs;2. SiO2-PD-AgNPs;3. AgNPs@SiO2。Fig. 1 UV-vis spectra (a) and the structure (b) of three kinds of nanosilver compositesNote: 1. AgNPs@SiO2-PD-AgNPs; 2. SiO2-PD-AgNPs; 3. AgNPs@SiO2.

表2 3种纳米银复合材料的半最大效应浓度(EC50)Table 2 The concentration for 50% of maximal effect (EC50) of three kinds of nanosilver composites (mg·L-1)
本研究中纳米银复合材料的抗菌性能主要由纳米银的负载率决定。对于AgNPs@SiO2来说,该材料是将纳米银的还原反应和正硅酸乙酯的水解反应同时进行,使纳米银能够更多地被包裹于SiO2微孔中,其对纳米银的吸附率较高。而SiO2表面的聚多巴胺虽具有一定的黏附性,但其负载的纳米银粒子可能相对较少,导致SiO2-PD-AgNPs毒性较AgNPs@SiO2小。AgNPs@SiO2-PD-AgNPs是在AgNPs@SiO2的基础上,对材料表面进行进一步修饰,从而进一步提高了纳米银的负载率,因此AgNPs@SiO2-PD-AgNPs的毒性最大。从受试菌来看,3种材料对E.coli的毒性均大于对B.subtilis的毒性,即E.coli对纳米银复合材料的敏感度要远远高于B.subtilis。笔者推测这可能与2种菌的细胞壁结构有关:E.coli是革兰氏阴性菌,细胞壁结构较为单薄,含极少肽聚糖,纳米银和Ag+容易渗透到细胞质中;对于B.subtilis来说,细胞壁坚固致密的肽聚糖层会阻碍纳米银和Ag+的渗透,抑菌效应减弱[34]。
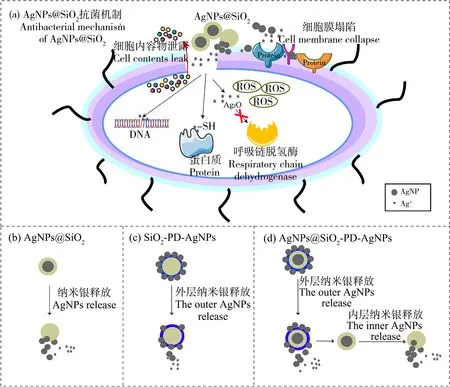
图2 3种纳米银复合材料的抑菌机理注:ROS表示活性氧簇;—SH表示巯基。Fig. 2 Bacteriostatic mechanism of three nanosilver compositesNote: ROS stands for reactive oxygen species;—SH stands for hydrosulfuryl.
2.3 联合毒性
为了探究纳米银复合材料与抗生素的联合抗菌性能,本研究选用单一毒性最大的AgNPs@SiO2-PD-AgNPs与广泛应用的抗菌药物KS/OH进行二元联合[35-37],测定二元混合物对E.coli和B.subtilis的联合毒性,结果如表3所示。可见,AgNPs@SiO2-PD-AgNPs与KS在毒性比为1∶1、1∶5和5∶1时对E.coli的联合毒性效应为协同,对B.subtilis的联合毒性效应为相加,而AgNPs@SiO2-PD-AgNPs与OH在毒性比为1∶1、1∶5和5∶1时对2种菌的联合毒性效应均为相加。
以往的研究指出纳米银与抗生素产生协同抗菌效应的可能原因是由于抗生素分子包含许多活性基团,例如羟基和酰胺基(图3(a)),它们容易与纳米银通过键合反应成为抗生素-纳米银复合物[24,38]。本研究中,AgNPs@SiO2-PD-AgNPs和KS在3种不同浓度配比下对E.coli都可以产生协同效应,表明二者的协同效应不会受浓度配比的影响。笔者推测纳米银复合材料和KS对E.coli的协同作用机理如图3(b)所示。AgNPs@SiO2-PD-AgNPs首先释放出纳米银粒子(图2(d)),KS和纳米银通过键合反应成为KS-纳米银复合物,纳米银与KS的结合会使纳米银的有效表面积发生变化,影响Ag+的释放动力学[39],所以KS-纳米银复合物比相同条件下单独纳米银作用释放了更多的Ag+。Ag+从复合物中的释放一方面增加了细胞膜的通透性,另一方面也导致KS从复合物中解离下来[40-41]。因此,纳米银复合材料与KS联合作用使得进入细菌体内的Ag+和KS含量均大于单独作用时可进入胞内的抗菌剂含量。进入胞内的Ag+导致ROS的产生从而使Ag+被氧化为Ag2O,灭活呼吸链脱氢酶,抑制细胞呼吸,并且Ag+通过与细菌细胞内的蛋白质和DNA分子结合从而引起细菌毒性[29];而KS通过结合于细菌的30S核糖体影响细菌蛋白质的正常合成,进而破坏细菌功能导致E.coli死亡[42]。因此,AgNPs@SiO2-PD-AgNPs和KS对E.coli表现出协同抗菌效应。而B.subtilis是革兰氏阳性菌,其细胞壁较厚(平均20~80 nm),从内向外有15~50层含量丰富的肽聚糖,结构致密,所以相较于E.coli,其细胞膜通透性不易被改变,笔者推测这可能是AgNPs@SiO2-PD-AgNPs与KS二元联合对B.subtilis表现出相加效应的原因。
对于AgNPs@SiO2-PD-AgNPs和OH的联合毒性效应,有研究指出,纳米银与四环素在水溶液中共存时会发生交互反应,改变纳米银与四环素的理化性质,导致Ag+的浓度升高,四环素的浓度降低[43]。Wan等[44]在评价纳米银与抗生素联合抑制大肠杆菌实验中也发现,纳米银与四环素联用不具有协同抑菌效果。因此,笔者推测纳米银复合材料和OH的联合作用机制如图3(d)所示。AgNPs@SiO2-PD-AgNPs首先释放出纳米银(图2(d)),之后OH通过羟基和酰胺基(图3(c))与纳米银结合成为OH-纳米银复合物。但是OH与纳米银会发生交互反应,改变了OH与纳米银的理化性质,导致Ag+浓度增加,OH浓度降低。一方面,OH-纳米银复合物会释放更多的Ag+,与单独的纳米银相比会对细菌产生更大的毒性作用;另一方面,OH浓度的降低减少了其与细菌核糖体的结合,降低了对蛋白质合成过程的影响,和相同条件下单独的OH作用相比对细菌的毒性效应减弱了,总体表现出对细菌的联合抗菌效应为相加。
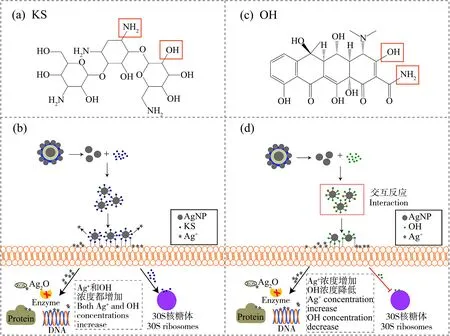
图3 AgNPs@SiO2-PD-AgNPs与2种抗生素的联合抗菌机理Fig. 3 Combined antibacterial mechanism of AgNPs@SiO2-PD-AgNPs and two antibiotics

表3 抗菌混合物的联合毒性作用Table 3 The joint toxic action of antimicrobial mixture
综上,本文制备出3种纳米银复合材料并对其抗菌性能进行探究,研究结果总结如下。(1)3种纳米银复合材料对细菌的单一毒性大小顺序一致,均为AgNPs@SiO2-PD-AgNPs>AgNPs@SiO2>SiO2-PD-AgNPs。此外,E.coli对纳米银复合材料的敏感度要高于B.subtilis。(2)AgNPs@SiO2-PD-AgNPs与KS在毒性比为1∶1、1∶5和5∶1时对E.coli的联合毒性效应为协同,对B.subtilis的联合毒性效应为相加,而AgNPs@SiO2-PD-AgNPs与OH对2种菌的联合毒性效应均为相加。(3)AgNPs@SiO2-PD-AgNPs与KS协同效应产生的主要原因可能是因为二者结合而成的KS-纳米银复合物导致进入细菌体内的Ag+和KS相较于单独的抗菌剂作用时均有增加,对细菌产生更大的毒性作用,表现出协同抗菌效应。因此,可以推测AgNPs@SiO2-PD-AgNPs和KS联用会对革兰氏阴性菌发挥优异的协同抗菌性能。所以,建议在今后的实际运用中,可以将夹心层结构的纳米银复合材料和包含有羟基和酰胺基等活性基团并且不会与纳米银发生交互反应的抗生素联合作用于革兰氏阴性菌;此外,在此基础上有必要进一步探究对革兰氏阳性菌也能产生良好协同抗菌效应的纳米银复合材料与抗生素的组合,为开发新型抗菌材料提供新思路并为联合用药提供参考。
