靶向结合骨肉瘤血管内皮细胞短肽的体外功能验证
2020-07-02杨澜波邹春雨米豫飞王战朝史占军
杨澜波 邹春雨 米豫飞 王战朝 史占军 黄 涛
骨肉瘤起源于成骨细胞,是最常见的运动系统恶性肿瘤,多见于膝关节周围,占青少年骨肿瘤的56%,其特点是全身转移快及局部侵袭强[1~3]。虽然越来越多的新方法被用于骨肉瘤的诊断和治疗,但自20世纪90年代以来,骨肉瘤的总体生存率并没有提高[4]。通过大剂量化疗来克服肿瘤耐药的同时常伴随着严重的不良事件,如严重的骨髓抑制和其他器官毒性,甚至可能危及生命[5]。如何实现有效治疗肿瘤的同时尽可能降低化疗药物的不良反应,是当前研究的一个热点。随着肿瘤分子生物学的发展,人们逐渐开始关注骨肉瘤的靶向化疗[6]。
血管可以为肿瘤细胞输送营养物质和氧气,若无足够的新生血管,肿瘤就无法生长[7]。因此,肿瘤内的血管系统可作为治疗肿瘤的一个有效靶点[8]。肿瘤血管靶向药物为肿瘤治疗提供了一个非细胞毒性的新途径。噬菌体展示技术是一种高效获取全新生物活性肽的实用技术[9]。将噬菌体展示技术应用于寻找特异结合肿瘤血管内皮细胞的短肽,为开发新的肿瘤血管靶向肽类药物提供了新的方向。在之前的研究中,笔者已经利用噬菌体展示技术,筛选出了能与OAVECs靶向结合7肽TY-7,并证实表达此7肽的噬菌体能特异性结合OAVECs。本研究通过合成该肽,在体外细胞水平验证了其与OAVECs结合的特异性,现报道如下。
材料与方法
1.实验动物与材料:3周龄SPF级BALB/c-nu裸鼠,体质量13.8±0.7g,购自南方医科大学动物实验中心,SPF级动物房饲养,模拟正常昼夜节律光照,自由饮食。骨肉瘤UMR-106细胞株购自中国人民解放军空军军医大学,DMEM培养基、0.25%胰蛋白酶/0.02%乙二胺四乙酸(0.25% Trypsin/0.02% EDTA)、Ⅱ型胶原酶、磷酸盐缓冲液(phosphate buffer solution,PBS)、胎牛血清(fetal bovine serum,FBS)及新生小牛血清(newborn calf serum,NBCS)购自美国Gibco公司,Ⅰ型鼠尾胶原购自广州威佳公司,血管内皮生长因子(vascular endothelial growth factors,VEGF)购自上海基因公司,抗细胞Ⅷ因子相关抗原兔多抗工作液、羊抗兔IgG、抗生物素-过氧化物酶(ABC)及DAB试剂盒购自北京博奥森生物技术有限公司,青霉素及链霉素购自华北制药有限公司。侧链保护的20种L型9-芴基甲氧羰基(Fmoc)氨基酸、1-羟基苯并三唑(HOBt)、固相载体 9-芴基甲氧羰基亮氨酰-2-氯三苯基(Fmoc-Leu-2-Cl-Trt resin)树脂、N,N′-异丙基碳二亚胺(DIC)购自广州百奥肽公司,异硫氰酸荧光素(FITC)购自美国Sigma公司。
2.OAVECs特异性结合肽的合成及纯化:采用Fmoc固相合成TY-7,使用制备型高效液相仪分离纯化后于N端标记一个FITC基团。FITC-TKPDKGY(FITC-TY-7)成品使用检测型HPLC仪和质谱仪进行分析鉴定。
3.UMR-106细胞的培养和骨肉瘤动物模型的构建:UMR-106细胞使用含10% NBCS的RPMI1640培养基,在饱和湿度、95%O2和5%CO2及恒温37℃的条件下常规培养。取对数生长期的UMR-106细胞,用胰酶消化后,PBS漂洗两遍,使用无血清RPMI1640培养基制成浓度为108/ml的动物模型接种细胞悬液。选取健康活跃裸鼠,消毒后于裸鼠左侧腋下皮下注射UMR-106细胞悬液0.1ml。造模1周后即可成瘤,3周后肿瘤直径可达1cm。
4.原代培养:正常血管内皮细胞:颈椎脱臼处死裸鼠,无菌条件下迅速打开胸腹腔取出主动脉,PBS液冲净血液,剥除血管周围结缔组织,加入胶原酶37℃消化30min。收集消化后的液体离心(1000r/5min)弃上清,加入培养基(低糖型DMEM、20%FBS、15U/ml肝素、2ng/ml VEGF、青霉素100U/ml、链霉素100U/ml)重悬沉淀后种植于Ⅰ型鼠尾胶原包被的培养皿中。2h后待内皮细胞贴壁后换液去除污染的成纤维细胞。待细胞生长分裂融合成单层、铺满皿底后传代。骨肉瘤血管内皮细胞:在无菌条件下,将荷瘤裸鼠颈椎脱臼处死切取肿瘤,显微镜下分离肿瘤内血管,后续处理与原代培养正常血管内皮细胞相同。
5.血管内皮细胞的免疫组化鉴定:取生长良好的OAVECs、AECs细胞爬片,漂洗后使用4%多聚甲醛固定15min。再次漂洗后加入3%H2O2封闭10min。非免疫血清室温孵育10min,洗片后加入50μl一抗(兔源抗Ⅷ因子相关抗原多抗工作液)4℃过夜。再次洗片后加入50μl二抗(生物素标记羊抗兔IgG工作液)温育30min。最后洗片2次后加入ABC溶液37℃孵育15min,DAB试剂盒显色。空白对照组使用PBS液代替一抗。封片置于镜下观察3个代表性视野,计数100个细胞得出阳性率。
6.FITC-TY-7与OAVECs特异性结合的检测:(1)荧光显微镜:取生长良好的UMR-106、AECs及OAVECs细胞爬片,漂洗固定后避光加入5μmol/L的FITC-TY-7,37℃孵育30min。充分漂洗、中性甘油封片后荧光显微镜观察。另取OAVECs与单纯FITC基团作用作为对照组。(2)流式细胞仪:取生长良好的UMR-106、AECs及OAVECs细胞悬液分别加入流式细胞仪上样管,离心弃上清后加入1~2滴PBS液稀释。每种细胞均分别避光加入FITC-TY-7、单纯FITC基团和PBS液室温孵育30min。最后,PBS液稀释至上样管的2/3,轻振试管后再次离心弃上清,固定后检测。
结 果
1.FITC-TY-7的合成纯化:FITC-TY-7的纯度为98.71%,进行质谱鉴定并测定相对分子质量为1197.3(图1)。

图1 FITC-TY-7质谱鉴定结果图
2.原代培养:肿瘤血管内皮细胞于种植后第4天即可见到明显的内皮细胞集落,正常血管内皮细胞则第6天可见细胞集落。OAVECs和AECs形态上无明显差别,呈多角形、短梭形或不规则形,核清晰,呈椭圆形或圆形。两种细胞均生长迅速,约7~9天后细胞汇合即生长减缓。传至3~4代时,细胞开始逐渐不再贴壁,数目减少,停止生长,变性变形直至死亡。
3. 免疫组化鉴定:Ⅷ因子免疫组化显示AECs和OAVECs胞质均呈黄褐色着色,AECs阳性细胞率为97.3%,OAVECs阳性细胞率为98.7%,而阴性对照组无特殊显色(图2)。

图2 AECs和OAVECs的Ⅷ因子免疫组化鉴定(×200)
4.FITC-TY-7与OAVECs特异性结合的检测:(1)荧光显微镜:OAVECs与FITC-TY-7作用后细胞表面荧光较强且清晰,显示明确结合;而AECs及UMR-106与FITC-TY-7作用后荧光微弱模糊且与背景荧光一致,可认为此两种细胞与FITC-TY-7无特异性结合(图3)。(2)流式细胞仪:OAVECs与FITC-TY-7作用时,荧光标记的阳性细胞比例达89.54%;而AECs和UMR-106与FITC-TY-7作用时,荧光标记细胞比例分别为0.27%和0.22%(图4)。单纯FITC基团分别与3种细胞作用时,荧光标记细胞比例均<1.00%。

图3 FITC-TY-7作用后荧光显微镜成像(×100)
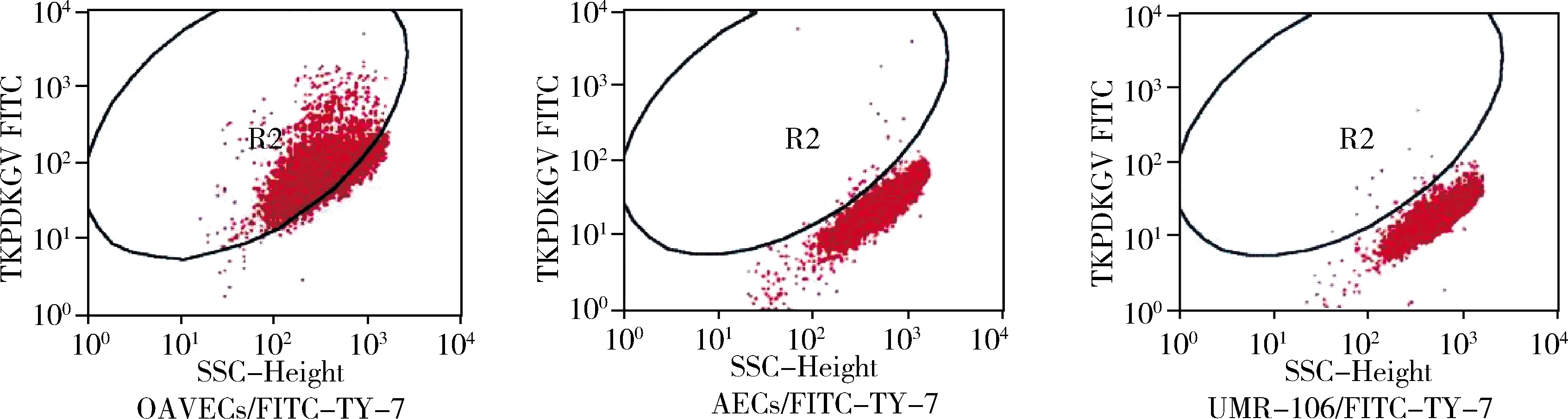
图4 流式细胞仪检测细胞与FITC-TY-7的结合
讨 论
血管在恶性肿瘤进展中起着至关重要的作用,肿瘤生长、转移、复发时必须打开“血管生成开关”,才能诱导肿瘤生长至1~2mm[10]。几乎所有的恶性肿瘤都具有持续的血管生成能力,这是侵袭性的重要基础[7]。近年来,传统细胞毒性抗肿瘤药物的获得性耐药引发了对更具针对性的新治疗策略的探索,肿瘤微环境被认为是重要的潜在治疗靶点,其中最关键的是抗血管治疗[11]。从传统的以肿瘤细胞为中心的治疗策略转向抗血管治疗模式,开辟了肿瘤治疗的新领域[12]。肿瘤抗血管治疗并不是直接通过细胞毒性针对肿瘤细胞,而是通过破坏血管实现阻断氧气、生长因子和营养的供应[13]。越来越多的研究表明,抗血管药物以肿瘤血管内皮细胞为攻击目标,直接针对已建立但异常的肿瘤血管系统,以肿瘤优先的方式迅速阻断血流,导致肿瘤内快速广泛的缺氧和肿瘤细胞死亡[14]。肿瘤血管内皮细胞基因稳定性较好,同质性强,标志物稳定,可以有效避免耐药。另外,静脉应用抗血管药物可直接作用于肿瘤血管内皮细胞,从而提高药效,降低耐药性,减少不良反应[15]。与传统治疗方法比较,直接靶向肿瘤血管可以应用于多种肿瘤,在数小时内达到治疗效果[16]。
多项研究证实通过血栓形成选择性阻断肿瘤血管可有效地杀死肿瘤,延长晚期患者的生存期[13,17]。在过去的几十年里,已经开发出数种专门阻断肿瘤血管的治疗方法,可在数小时或数天内破坏肿瘤血管系统,降低血管密度,抑制肿瘤血流,导致广泛的肿瘤坏死[18~20]。血管靶向化疗有望为恶性肿瘤治疗带来革命性的变化,但是如何寻找特异性结合肿瘤血管内皮细胞的基团至关重要。Bussolati等[21]通过噬菌体展示技术获得了亲和肾肿瘤血管内皮细胞的噬菌体克隆CVGNDNSSC,根据序列合成短肽并证实该肽可特异性结合肾肿瘤血管内皮细胞而不与正常血管及其他肿瘤的血管内皮细胞结合。Arap等[22]同样利用噬菌体展示技术得到了能与前列腺肿瘤血管靶向结合的短肽SMSIARL。而Sharma等[23]则更进一步,把肿瘤血管导敏肽(CGKRK)与促凋亡肽(KLAKLAK)结合制成纳米颗粒,在胶质母细胞瘤和乳腺癌的治疗中显示出良好的效果。
骨肉瘤生长侵袭严重依赖血管的形成,针对肿瘤血管系统的治疗具有广阔的前景,有望成为克服传统大剂量化疗弊端的新策略。为得到可特异性结合OAVECs的低分子基团,管明强等[24]利用噬菌体展示技术获取了能靶向结合UMR-106荷瘤裸鼠肿瘤血管的噬菌体(TKPDKGY),并通过该单克隆噬菌体初步验证了其结合的特异性。本研究中,笔者进一步根据此噬菌体的序列合成了短肽TY-7并标记FITC,在体外细胞水平通过荧光显微镜及流式细胞仪对其与OAVECs的结合特异性进行了验证。荧光显微镜显示TY-7可靶向结合OAVECs,但与正常血管内皮细胞和骨肉瘤细胞无明显结合。流式细胞仪则进一步证实TY-7与OAVECs结合率(89.54%)远高于与UMR-106(0.27%)和AECs(0.22%),说明TY-7能高度与OAVECs特异性结合。以上实验通过定性和定量两方面验证了TY-7具备与OAVECs靶向结合的能力,同时并不与骨肉瘤细胞及裸鼠正常血管内皮细胞结合。
在靶向诊疗的研究中,能否得到可高选择性结合靶点的基团至关重要。本研究中由噬菌体展示技术获得的短肽TY-7具有在体外细胞水平高度特异结合OAVECs的能力。在此基础上,笔者将进一步实现TY-7与效应分子结合,研究其对骨肉瘤的靶向治疗作用,或与造影剂结合,评价其诊断示踪作用,为骨肉瘤血管靶向诊疗提供实验基础。
