MiR-130b在胶质瘤中的表达及对血管生长的影响
2020-07-02周永刚舒俊斌李晓波吕晓俊叶汝勇李正在
张 静 周永刚 舒俊斌 李晓波 吕晓俊 叶汝勇 李正在
新生血管的生成在实体瘤的发展和远处转移过程中发挥着举足轻重的作用,实体瘤生长至2mm3左右就必须要新生血管长入才能继续维持肿瘤血供,血管内皮细胞在肿瘤组织内增殖并相互连接形成新生血管,为肿瘤细胞恶性增殖所必须的氧气及营养成分提供血运通路,同时为肿瘤转移提供了准备条件。胶质瘤作为中枢神经系统最常见的原发性肿瘤,具有极强的侵袭性,当前胶质瘤患者的治疗存在高复发率和高病死率这两大难题,预后较差,同时胶质瘤作为一种血供较为丰富的肿瘤,其血管新生异常旺盛[1, 2]。因此,探讨胶质瘤血管新生的分子作用机制和潜在的遗传异常是当前亟待解决的问题。
既往研究发现,miRNA作为基因组中的非编码序列,可通过与靶基因的3′-UTR的配对从而降解或抑制靶基因mRNA的翻译,进而在机体发育、分化和代谢等多个生物学过程中发挥关键调控作用[3,4]。当前研究表明,miR-130b在肺癌和甲状腺癌等多种实体肿瘤中表达下调[5,6]。同时miR-130b与胰腺癌转移密切相关[7]。在结肠癌细胞中特异性上调miR-130b的表达可抑制肿瘤细胞血管生长[8]。以上研究表明miR-130b与恶性肿瘤多种恶性生物学行为密切相关,而miR-130b在胶质瘤细胞中的表达和恶性生物学行为的关系尚未有研究报道。因此,本研究将探讨miR-130b在胶质瘤血管新生中的作用及具体作用机制,为胶质瘤的防治研究提供有益参考。
材料与方法
1.细胞与试剂:胶质瘤细胞株U251、SHG-44和U87及人正常星形胶质细胞系NHA购自上海细胞生物研究所;DMEM高糖培养基和胎牛血清购自杭州四季青公司;EGM-2培养基购自美国Invitrogen公司;含EDTA胰蛋白酶购自中国吉诺公司;LipofectamineTM2000购自美国Life Technologies公司;miR-130b及内参U6引物和探针由广州锐博生物公司设计合成;RNA反转录试剂盒和实时荧光定量聚合酶链反应试剂盒购自美国ABI 公司;miR-130b模拟物和miR-130b抑制剂及其阴性对照模拟物NC和抑制剂NC均购自上海吉凯基因化学技术有限公司;VEGFA酶联免疫吸附检测(ELISA)试剂盒购自南京凯基生物科技发展有限公司;BCA蛋白浓度测定试剂盒和RIPA裂解液购自北京中山生物工程公司;荧光素酶报告基因检测试剂盒购自美国Promega公司;EMSA试剂盒购自美国Pierce公司;TNF-α和VEGFA抗体购自美国Epitomics公司;β-actin抗体购自美国Santa Cruz公司。
2.细胞培养:U251、SHG-44、U87和NHA细胞均培养于DMEM培养基中,HUVECs培养于EGM-2培养基中,所有培养基中均添加10%的胎牛血清,细胞均置于37℃、5% CO2的饱和湿度细胞培养箱中,当细胞贴壁铺满80%~90%视野时,使用0.25%含EDTA的胰蛋白酶消化传代。
3.细胞分组及转染:收集对数生长期胶质瘤细胞,用完全培养基制成单细胞悬液并调整浓度为5×106/ml,将细胞悬液接种至6孔板中,每孔100μl,每组设3个复孔,待细胞融合至70%~80%时进行细胞转染。根据LipofectamineTM2000 试剂盒说明书进行操作,实验分为以下4组:①模拟物NC组:每孔U87细胞加入100nmol的模拟物NC及5μl 转染试剂;②miR-130b模拟物组:每孔U87细胞加入100nmol的miR-130b模拟物及5μl转染试剂;③抑制剂NC组:每孔U251细胞加入100nmol的抑制剂NC及5μl 转染试剂;④miR-130b抑制剂组:每孔U251细胞加入100nmol的miR-130b抑制剂及5μl 转染试剂,转染后48h收集细胞行PCR检测,确定转染效率后再进行细胞体外实验。
4.qRT-PCR检测miR-130b 的表达:在转染后的胶质瘤细胞中用Trizol试剂提取细胞总RNA,RNA浓度由超微量分光光度计检测,反转录和荧光定量PCR过程严格按照试剂盒说明书进行操作,设置U6作为内参,通过2-△△Ct法计算miR-130b的相对表达量,实验重复3次,取平均值。
5.收集胶质瘤细胞条件培养基(CM):将胶质瘤细胞接种于75cm2培养瓶中,加入适量完全培养基,待细胞生长至80%底面积时用移液器吸去原培养基,用PBS缓冲液反复冲洗4次,再加入不含血清的DMEM培养基20ml,放置细胞培养箱孵育12h后收集上清液,以2500r/min速度下常温离心5min,将上清液用0.22μm过滤器过滤后,保存于4℃冰箱中。
6.ELISA法检测CM中VEGFA含量:取出冷藏的CM,按照VEGFA酶联免疫吸附检测试剂盒说明书进行操作,设立标准品浓度,在ELX808U酶标仪(美国Bio-Tek公司)上自动拟合标准曲线,检测各孔吸光度(A)值,计算出样本CM中VEGFA的含量。
7.Transwell小室侵袭实验:将Matrigel基底胶使用无血清DMEM培养基稀释7倍,将稀释好的基底胶均匀铺被到Transwell上室底部,然后放置于细胞培养箱中培养0.5h以促进Matrigel凝固。待Matrigel胶完全凝固后,小心取出上室并吸去残余液体,再加入50μl无血清DMEM培养基,然后再放置于细胞培养箱中继续孵育0.5h。将20μl细胞悬液加入Transwell上室中,同时在Transwell下室中添加500μl含20%胎牛血清的细胞培养基,然后将Transwell小室放置于细胞培养箱中继续孵育24h,实验重复3次,每组设5个复孔。将放置培养箱中孵育24h的Transwell小室取出,去除上室及下室中的培养基,用棉棒小心擦去小室底膜上的细胞,并用无菌PBS液小心清洗2遍。将Transwell上室放置在10%甲醇溶液中固定20min,用PBS液清洗3遍后再用结晶紫溶液染色15min。将Transwell上室自结晶紫溶液中取出后,使用PBS溶液清洗3遍,将Transwell上室置于载物片上,放置于倒置显微镜下观察并拍照,在高倍镜下随机选择10个视野拍照并采集图像。
8.小管形成实验:将HUVECs接种于6孔培养瓶中,加入含20% FBS的EGM-2培养基,待细胞生长至80%底面积时用移液器吸去原培养基,用PBS缓冲液反复冲洗2次,加入CM培养24h。实验组设置为不同组别CM培养的HUVECs,对照组设置为含1% FBS的EGM-2培养基培养的HUVECs。将不含胎牛血清的培养基和Matrigel胶放置4℃冰箱过夜预冷,待其变成胶冻状,以1∶2的比例混合培养基和Matrigel胶,将250μl稀释后的Matrigel胶加入24孔板中,再放入细胞培养箱中孵育1h,至Matrigel胶凝固。调整HUVECs浓度为2×105/L,将0.1ml细胞悬液接种于预先铺好基质胶的24孔板中,再放置细胞培养箱中孵育过夜,最后在倒置显微镜下观察小管形成状况。
9.荧光素酶报告基因检测:将重组荧光素酶报告载体mut-psiCHECK-TNF-α-3′UTR或wt-psiCHECK-TNF-α-3′UTR共转染入U87细胞中,再分别将miRNA-130b抑制剂或抑制剂NC转染至U87细胞中,转染48h后收获细胞,按荧光素酶报告基因检测试剂盒说明书提供的方法对样品荧光素酶活性进行检测,每组样本设5个复孔,荧光素酶相对活性=萤火虫荧光素酶荧光值/海肾荧光素酶荧光值。
10.EMSA检测NF-κB活性:按照EMSA试剂盒的说明书进行检测,使用细胞裂解液处理细胞后,再使用BSA法对各组细胞蛋白含量进行测定。双链寡核酸NF-κB序列探针(正义链:5′-AGTTGAGGGGACTTTCCCAGGC-3′,反义链:5′-GCCTGGGAAAGTCCCCTCAACCTGA-3′),6.5%非变性聚丙烯酰胺凝胶100V预电泳60min,待溴酚蓝泳动为3/4全长时停止电泳,再将带正电的尼龙膜和胶同时夹入电泳转移槽进行印迹转移,反应条件为380mA转移30min。将膜置于滤纸上吸干水分后转移至紫外灯下交联15min,在封闭液和平衡液中于室温下分别反应20min,经化学发光和X线曝光后拍照,用Quantity One 4.6.2(BIO, RAD)软件对图形进行光密度扫描,灰度值越高表示NF-κB激活程度越高。
11.Western blot法检测蛋白表达:胶质瘤细胞提取蛋白后经按BCA蛋白浓度测定试剂盒说明书提取总蛋白,每份样品使用20μg蛋白质,使用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳后转移至PVDF膜上,在4℃下使用5%脱脂奶粉封闭过夜,硝酸纤维素膜经一抗和二抗反应后滴加新鲜配置的ECL化学发光液显色、曝光和显影。

结 果
1.miR-130b在胶质瘤细胞系和正常星形胶质细胞中的表达:应用实时荧光定量PCR检测胶质瘤U251、SHG-44和U87细胞和正常星形胶质细胞系NHA中miR-130b的表达,NHA细胞中miR-130b的表达水平分别为U251、SHG-44和U87细胞的4.29、7.23和10.30倍,差异均有统计学意义(P=0.000)。在3种胶质瘤细胞株中,U251细胞中miR-130b的表达相对较高,而miR-130b在U87细胞中的表达相对较低,选择U251和U87细胞作为后续实验材料(图1)。
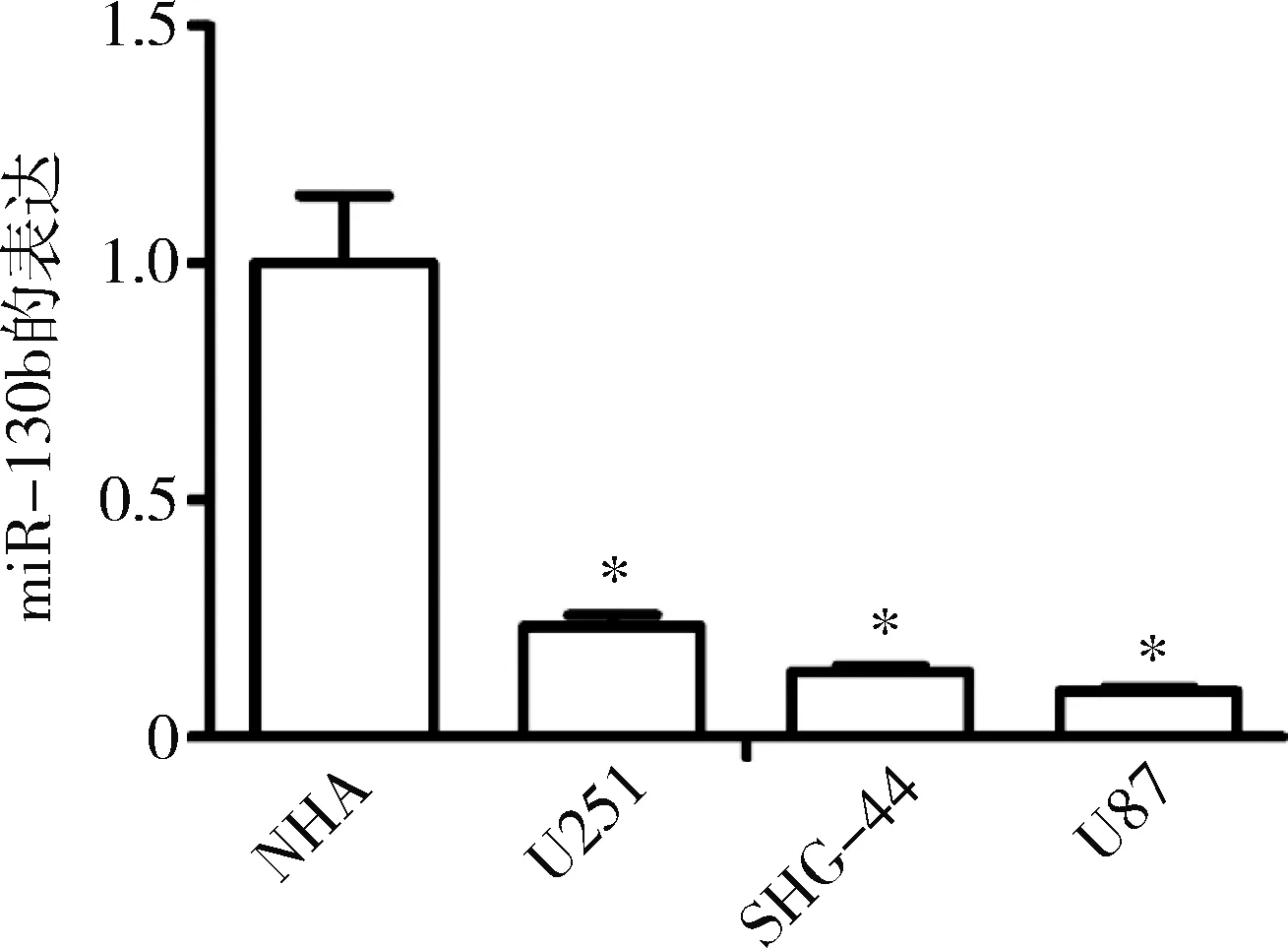
图1 miR-130b在不同细胞株中的表达与NHA比较,*P=0.000
2.转染miR-130b模拟物和miR-130b抑制剂对胶质瘤细胞中miR-130b和VEGFA表达的影响:将miR-130b模拟物转染至U87细胞,同时将miR-130b 抑制剂转染至U251细胞48h后,利用实时荧光定量PCR检测细胞中miR-130b的表达,miR-130b模拟物组U87细胞中miR-130b的表达明显高于模拟物NC组(P=0.000),而miR-130b抑制剂组U251细胞中miR-130b的表达水平显著低于抑制剂 NC组(P=0.000)。miR-130b模拟物和miR-130b抑制剂转染胶质瘤细胞48h后,收集胶质瘤细胞条件培养基,应用ELISA法检测细胞CM中VEGFA的表达水平,miR-130b模拟物组U87细胞CM中VEGFA的表达明显低于模拟物NC组(P=0.004),而miR-130b抑制剂组U251细胞CM中VEGFA的表达水平显著高于抑制剂NC组(P=0.000,图2)。
3.过表达/干扰miR-130b后胶质瘤细胞CM对体外HUVECs侵袭和小管形成的影响:为评估干扰/过表达miR-130b后胶质瘤细胞对体外HUVECs运动能力的影响,笔者分别提取了转染miR-130b模拟物和miR-130b抑制剂及其对照的细胞CM,HUVECs经CM作用24h后进行Transwell小室侵袭实验。如图3A所示,细胞侵袭实验结果表明,HUVECs经miR-130b模拟物组细胞的CM处理后,侵袭出Matrigel的细胞数为14.8±2.8,显著低于模拟物 NC组(34.5±5.9),两组比较差异有统计学意义(P=0.000);而HUVECs经miR-130b抑制剂组细胞的CM处理后,侵袭出Matrigel的细胞数为52.8±6.5,明显高于抑制剂NC组(30.1±4.3),两组比较,差异有统计学意义(P=0.004)。

图2 miR-130b对胶质瘤细胞中VEGFA表达的影响A.miR-130b;B.VEGFA
利用小管形成实验检验过表达/干扰miR-130b的胶质瘤细胞CM对体外HUVECs的血管生成能力,HUVECs在体外Matrigel基质环境中生长12h后,细胞逐渐向两端延长呈梭形,同时细胞延长端开始在Matrigel胶中伸展,相邻细胞开始出现联接并出现管腔样结构。miR-130b模拟物组细胞CM处理的HUVECs体外小管形成数为24.9±2.7,显著低于模拟物NC组(36.7±4.5),两组比较差异有统计学意义(P=0.004);miR-130b抑制剂组细胞CM处理的HUVECs体外小管形成数为57.8±8.3,明显高于抑制剂NC组(31.4±4.5),两组比较差异有统计学意义(P=0.002,图3)。

图3 miR-130b对HUVECs迁移和小管形成能力的影响A.Transwell小室侵袭实验;B.小管形成实验
4.TNF-α是miR-130b的直接靶基因:为了研究miR-130b在胶质瘤细胞血管新生中的可能作用机制,通过检索miRBase数据库获得has-miR-130b序列,并通过运用生物信息学工具RNAhybrid 2.1、TargetScan和PicTar对miR-130b靶基因进行预测发现,TNF-α与has-miR-130b存在潜在的结合位点(图4A)。为此,笔者进一步应用荧光素酶报告检测系统对体外U87细胞中miR-130b对TNF-α的调控作用进行验证。
荧光素酶报告检测系统结果(图4B)显示,与共转染wt-psiCHECK-TNF-α-3′UTR和抑制剂NC后细胞荧光素酶活性比较,在U87细胞中共转染wt-psiCHECK-TNF-α-3′UTR和miR-130b抑制剂后的荧光素酶活性值明显升高,差异有统计学意义(P=0.004);而共转染mut-psiCHECK-TNF-α-3′UTR和miRNA-130b抑制剂后细胞荧光素酶活性值与共转染mut-psiCHECK-TNF-α-3′UTR和抑制剂NC后的细胞荧光素酶活性值比较,差异无统计学意义(P>0.05)。miRNA-130b模拟物和miRNA-130b抑制剂分别转染U87和U251后,应用Western blot法检测胶质瘤细胞中TNF-α蛋白的表达,miR-130b模拟物组U87细胞中TNF-α的表达明显低于模拟物NC组(P=0.000),而miR-130b 抑制剂组U251细胞中TNF-α的表达水平显著高于抑制剂NC组(P=0.000,图4C)。以上结果表明,miRNA-130b可与TNF-α的3′-UTR结合,TNF-α是miR-130b的直接靶向基因。
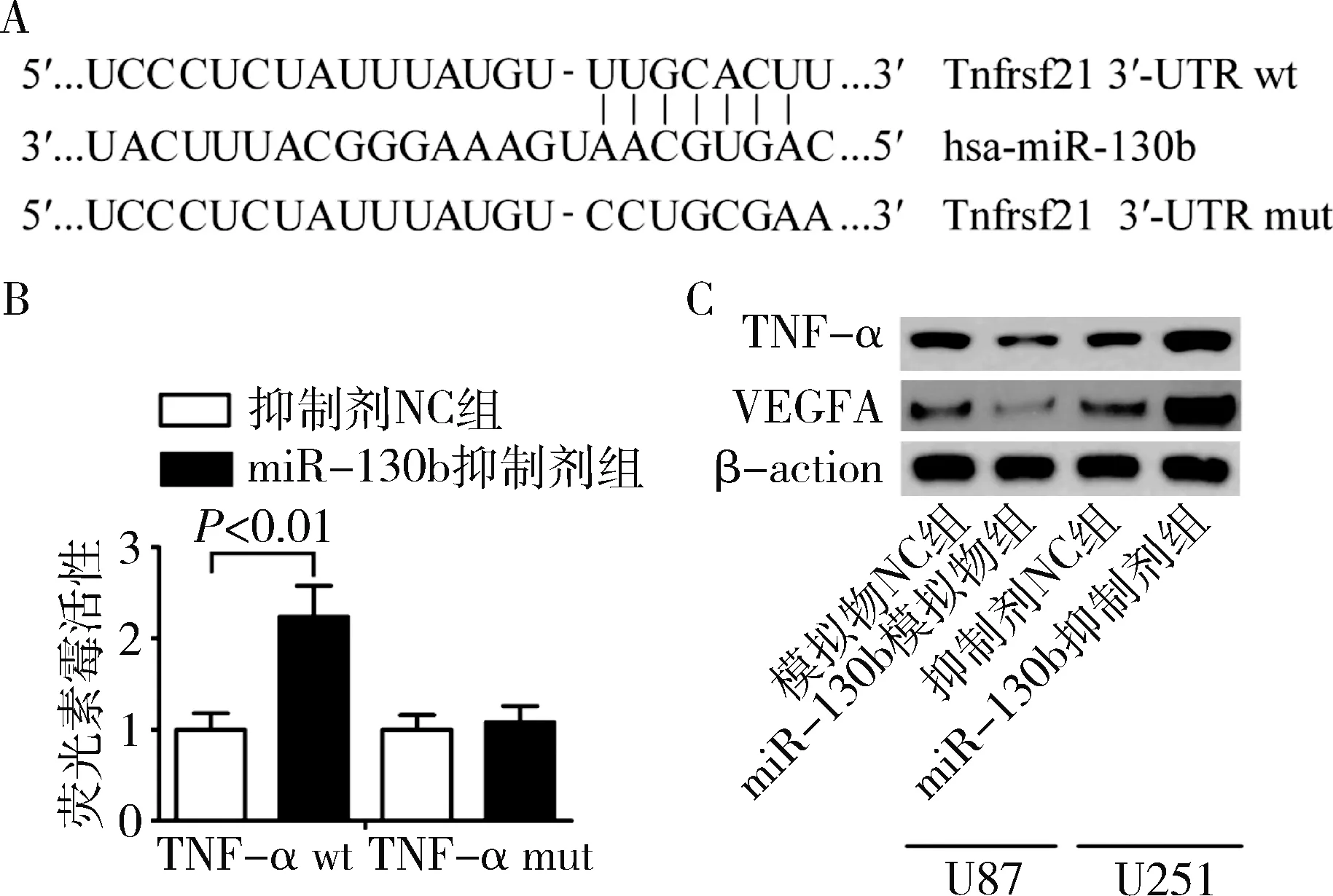
图4 miR-130b对胶质瘤细胞中TNF-α和VEGFA表达的影响A.生物信息学工具预测靶基因;B.荧光素酶报告检测系统;C.蛋白质电泳图
5.过表达/干扰miR-130b对胶质瘤细胞中NF-κB活性及VEGFA蛋白表达的影响:将miR-130b模拟物或模拟物NC转染至U87细胞,同时将miR-130b抑制剂或抑制剂NC转染至U251细胞48h后,利用EMSA检测胶质瘤细胞中NF-κB活性,结果如图5所示,miR-130b模拟物组U87细胞中NF-κB活性较模拟物NC组明显减弱(P=0.000),而miR-130b抑制剂组U251细胞中NF-κB活性显著强于抑制剂NC组(P=0.000)。
miR-130b模拟物和miR-130b抑制剂转染胶质瘤细胞48h 后,应用Western blot法检测胶质瘤细胞中VEGFA蛋白的表达水平, miR-130b模拟物组U87细胞中VEGFA的表达明显低于模拟物NC组(P=0.000),而miR-130b抑制剂组U251细胞CM中VEGFA的表达水平显著高于抑制剂NC组(P=0.000)。
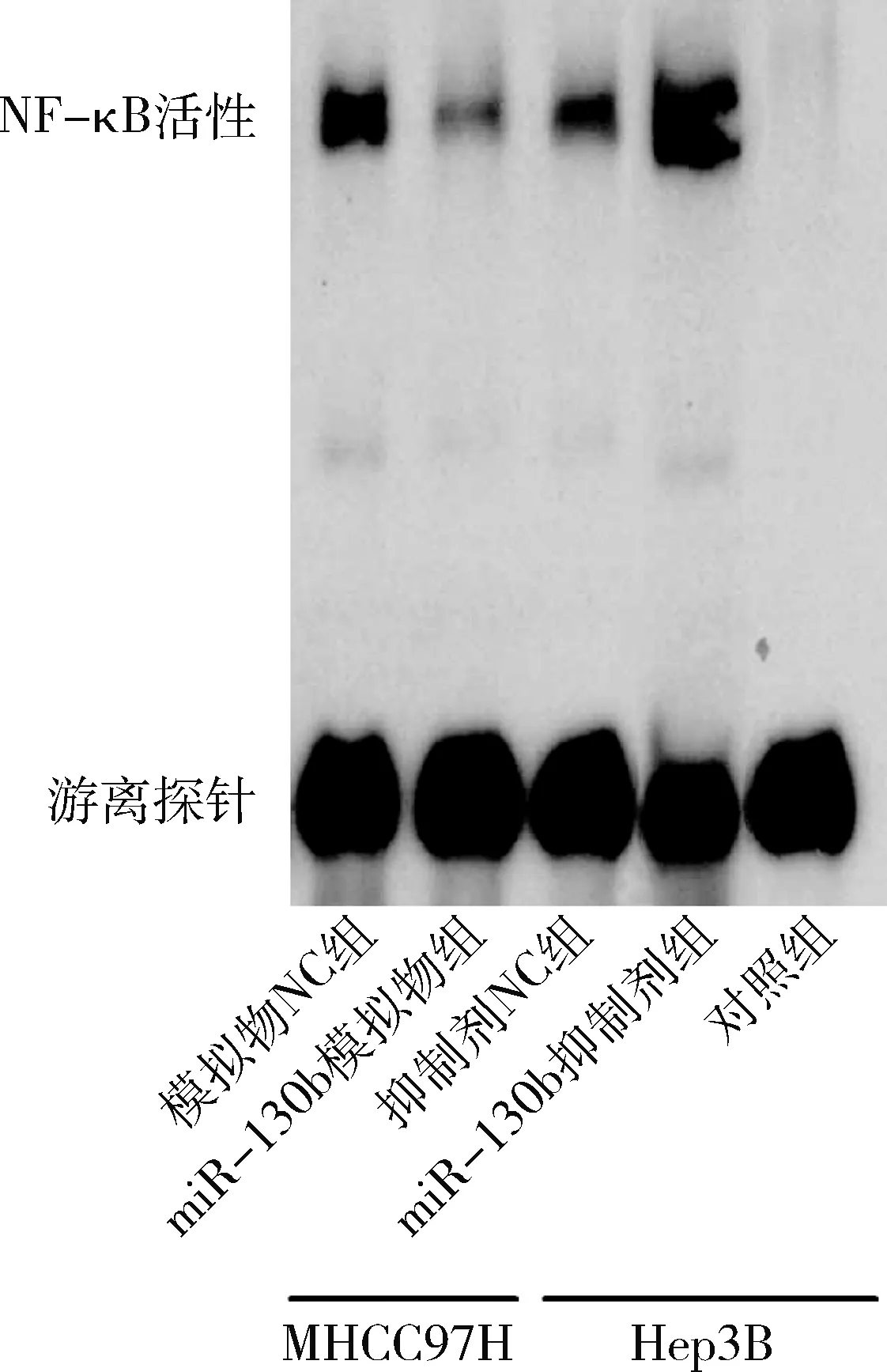
图5 miR-130b对胶质瘤细胞中NF-κB活性的影响
讨 论
目前国内外公认的高级别胶质瘤有效的治疗方案是根治性手术治疗配合术后放疗、化疗,但即便接受正规的内外科联合治疗,其中位生存期也不超过12个月,因此,胶质瘤的防治研究是目前神经外科学家和基础科研工作者所面临的重任。研究表明,miRNAs在多种恶性肿瘤中扮演着致癌基因或抑癌基因的角色,同时在肿瘤转移和血管新生中发挥着重要作用。miR-130b在多种恶性肿瘤中表达减少,同时与肿瘤进展和预后不良相关,但miR-130b与胶质瘤相关性研究尚未见报道。本研究发现,miR-130b在胶质瘤细胞中的表达较正常星形胶质细胞表达下调,因此,需要进一步研究miR-130b在胶质瘤恶性生物学行为中的作用。
血管新生作为一种新生血管管腔形成的生理过程,这个过程受血管生成促进因子和血管生成抑制因子双重调控。既往研究表明,作为血管生成促进因子中最重要的一种,VEGFA在促进多种恶性肿瘤血管生成过程中起着至关重要的作用[9, 10]。肿瘤细胞产生的VEGFA与肿瘤细胞的扩散和转移密切相关[11]。此外,VEGF拮抗剂如贝伐珠单抗应用于临床可改善胶质瘤患者的预后[12]。本研究表明,上调miR-130b的表达可抑制体外胶质瘤细胞CM中VEGFA的表达,而下调miR-130b的表达可促进体外胶质瘤细胞CM中VEGFA的表达。因此,笔者提出miR-130b可能对胶质瘤细胞的血管新生产生一定抑制作用,本研究印证了这一假设。本研究中,笔者首次发现上调miR-130b的表达对HUVECs的运动能力和血管生成具有抑制作用,而下调miR-130b的表达对胶质瘤细胞促进血管生成的启动和维持过程中起到重要作用,从而表明miR-130b对胶质瘤血管新生是必不可少的。然而,关于miR-130b如何调控血管生成以及miR-130b和VEGFA在胶质瘤中的中间信号转导机制尚不清楚。
TNF-α在大量良性疾病和恶性肿瘤的发生和发展过程中扮演着关键调节器的作用[13]。最新证据显示,TNF-α参与调节正常和异常的血管生成;人体血管内皮细胞在TNF-α的作用下可促进血管细胞黏附分子、细胞内黏附分子和VEGFA的分泌[14]。肿瘤细胞活化的肌成纤维细胞所分泌的TNF-α可以通过诱导促血管生成因子的表达,从而促进癌细胞外渗和血管生成[15]。然而,迄今为止尚未有miR-130-b和TNF-α的生物学功能研究报道。在笔者的研究中,下调miR-130b的表达可促进TNF-α在胶质瘤细胞中的表达,而TNF-α在miR-130b高表达的U251细胞中的表达水平显著降低。此外,荧光素酶报告实验进一步证实,miR-130b直接靶向调控TNF-α。
研究表明,NF-κB在癌症的发生和发展中起着至关重要的作用,并且黏附分子和VEGF的表达与激活的NF-κB直接相关[16, 17]。TNF-α作为NF-κB的主要活化因子之一,TNF-α激活NF-κB的作用机制已有详尽的研究[18,19]。本研究表明,miR-130b在胶质瘤细胞中的异位表达可抑制NF-κB活性,而敲除miR-130b的表达可增强NF-κB活性。此外,笔者发现miR-130b的表达下调可增加NF-κB的下游基因,如VEGFA的表达。至此,笔者发现miR-130b与VEGFA之间的调控机制是通过TNF-α/NF-κB这一中间信号通道来实现,TNF-α/NF-κB信号通道可诱导下游促血管生成因子表达,进而促进胶质瘤细胞血管新生,miR-130b/TNF-α/NF-κB/VEGFA信号通路可能在调控胶质瘤血管生成中发挥关键作用。
综上所述,本研究强调了miR-130b和VEGFA之间的相互作用的重要性,miR-130b可直接靶向调控 TNF-α,从而进一步调控NF-κB信号通道而控制胶质瘤血管生成。从机制上看,下调miR-130b可促进TNF-α的高水平表达,并有助于NF-κB激活和其下游基因VEGFA的表达。这样,miR-130b/TNF-α/NF-κB/VEGFA通路可能是未来胶质瘤治疗的具体作用靶点,从而在揭示胶质瘤的发病机制及治疗上具有一定积极意义。
