沉默MAT1基因通过SDF1-CXCR4信号通路抑制骨肉瘤细胞增殖与迁移
2020-07-02巨啸晨孙荣鑫
巨啸晨 舒 莉 周 玲 孙荣鑫
骨肉瘤(osteosarcoma,OS)是最常见的原发性恶性骨肿瘤,起源于骨髓间充质干细胞,其特点是进展迅速且预后不良[1,2]。OS主要发生在儿童和青少年期,据报道,年龄15~19岁的发生率最高,为每年800万~1100万,5年生存率为60%~70%[3,4]。一些患者在确诊时即可出现转移性病灶,另外还有一些无法辨别的亚临床症状的微小转移, 致使该病的治疗效果不甚理想[5,6]。目前,OS的主要治疗手段是手术并辅以放疗和化疗[7,8]。近年来,尽管外科手术方法有所改善,但骨肉瘤患者的生存率并没有得到明显提高,复发和转移的概率仍然较大。因此,进一步探索OS发展的机制并寻找治疗骨肉瘤治疗的新方法是十分迫切的。
细胞周期蛋白依赖性激酶活化激酶 (cyclin dependent kinase-activating kinase,CDK) 通过调控细胞周期在细胞形成以及增殖过程中具有重要作用[9]。CDK的磷酸化由CDK激活激酶(CAK)执行的,CAK是由CDK7、细胞周期蛋白H和辅助蛋白MAT1组成的三聚体复合物[10]。其中,MAT1作为CAK的重要组成部分,在多数癌细胞中过度表达,并参与癌细胞的增殖、转移等生物学行为[11]。有研究表明,MAT1的缺失会阻碍抑癌蛋白的磷酸化并诱导骨肉瘤细胞中的G1阻滞,说明MAT1可能在骨肉瘤的发生、发展中起到了一定的作用[12]。本研究通过RNAi 技术沉默骨肉瘤细胞143B细胞中MAT1的表达,旨在探讨沉默MAT1 表达后对143细胞增殖、迁移的影响,并揭示其潜在机制。
材料与方法
1.主要试剂与材料:人骨肉瘤细胞株Saos-2、MG63、U2OS、143B与人成骨细胞hFOB1.19购自美国美国菌种保藏中心ATCC。本研究主要试剂包括TRIzol试剂与LipofectamineTM 2000 购自美国Invitrogen 公司,胎牛血清、100U/ml 青霉素和100μg/ml链霉素、DMEM/F12培养基购自美国 Gibco 公司,RNase和PI试剂购自江苏凯基公司,TRIzol试剂、Prime ScriptTMRT reagent Kit试剂盒以及SYBR®Premix Ex TaqTMⅡ试剂盒均购自日本TaKaRa公司,CCK-8试剂盒、RIPA 裂解液与BCA蛋白测定试剂盒均购自美国 Bio-Rad 公司,Transwell 小室购自美国 Costar公司。
2.细胞培养:将骨肉瘤细胞株Saos-2、MG63、U2OS、143B以及人成骨细胞hFOB1.19置于含有10%胎牛血清、100U/ml 青霉素和100μg/ml链霉素的DMEM/F12培养基中,在5%CO2、37℃的细胞恒温培养箱中进行常规培养。当细胞密度达到 80%~90%时,加0.25%胰蛋白酶消化传代。本研究所有细胞均为生长良好的第3代对数生长期细胞。
3.qRT-PCR:使用TRIzol试剂从各细胞系(hBMSCs、hFOB1.19、Saos-2、MG63和U2OS)中提取总RNA。按照Prime ScriptTM RT Reagent Kit说明书进行反转录操作获得cDNA。根据SYBR®Premix Ex TaqTM Ⅱ说明并以GAPDH 作为内参基因检测MAT1 mRNA的表达。扩增体系:上游引物1μl、下游引物1μl、cDNA 2μl、SYBR Premix Ex TaqⅡ 12.5μl、无酶水补足25μl。扩增条件:95℃ 3min,95℃ 30s,60℃ 30s,58℃ 30s,40个循环。使用2-ΔΔCt法来计算MAT1 mRNA的相对表达量。使用的引物由上海生工生物有限公司合成,具体序列如下:MAT1上游引物:5′-ACTGCCCTGAGTGTGGTACT-3′,下游引物:5′-TGAAATATGTTGACCCAGCTCATCT-3′;GAPDH上游引物:5′-TTTGCGTCGCCAGGTGAAGA-3′,下游引物:5′-AGTTAAAAGCAGCCCTGGTGA-3′。
4.siRNA 转染:将143B细胞以 2×105个/孔的密度接种于 6 孔板中进行培养,细胞密度达到70%左右时进行转染。细胞分为空白对照组(正常培养,不进行转染)、阴性对照组(转染阴性对照 siRNA-NC)和 siRNA-MAT1 组(转染 siRNA-MAT1),siRNA序列由上海生工生物有限公司设计并合成。根据 Lipofectamine TM 2000 说明书操作,分别将 5μg siRNA 与 250μl OPTI-MEM、10μl 脂质体与250μl OPTI-MEM轻柔混匀,室温孵育10min,然后将两种稀释物混合均匀,室温孵育20min。将混合后的转染试剂加入培养的细胞中,在37℃、5%CO2细胞培养箱中孵育 6h,弃原培养基,更换为DMEM新鲜培养基培养。
5.CCK-8测定:转染后48h,将各组143B细胞以1×104个/孔的密度接种到96孔板中,在37℃、5%CO2培养箱中继续培养孵育。使用CCK-8试剂盒检测细胞的增殖力,分别于24、48、72、96h时,每孔加10μl CCK-8溶液,再将培养板放在培养箱中培养2h,在酶标仪上450nm 处检测各孔吸光光度值。
6.流式细胞术:转染后48h,收集各组143B细胞用于细胞周期分析。使用PBS洗涤细胞,在4℃的75%乙醇中固定24h,去除乙醇,PBS洗涤重悬细胞,加10μl RNase在37℃下孵育10min,再加入5μl PI 37℃避光孵育30min,过300目筛网,使用流式细胞仪检测细胞周期。
7.Transwell小室:转染后48h,将各组143B细胞以2×104个/孔的密度接种于Transwell 小室的上室,并加100μl 无血清培养基,下室中加入600μl含10%胎牛血清的培养基,放入37℃、5%CO2细胞培养箱中孵育24h后取出小室,弃培养液,PBS洗涤,置于40g/L甲醛中固定20min,0.1%结晶紫染色30min,PBS再次洗涤,棉签擦拭掉上层未穿过基膜的细胞,封片后使用倒置显微镜观察拍照并计数。
8.Western blot法检测:转染后48h,使用 RIPA 裂解液抽提各组143B细胞总蛋白,BCA蛋白测定试剂盒检测蛋白浓度。取20μg蛋白样品进行SDS-PAGE电泳,分离的蛋白切胶并转移至PVDF膜,5%脱脂奶粉室温封闭2h,分别加入兔抗SDF-1(1∶500)、兔抗CXCR4(1∶500)、鼠抗β-actin(1∶1000)于4℃孵育过夜,次日使用PBS洗涤3次,每次10min,再用加HRP标记的山羊抗兔IgG(1∶5000)室温孵育2h,PBS洗涤3次,每次10min,在暗室用ECL发光液检测,用扫描仪扫描X线片,用ProtParam 软件对灰度值进行分析,计算蛋白相对表达量。

结 果
1.MAT1在骨肉瘤细胞中高表达:qRT-PCR检测MAT1 mRNA在骨肉瘤细胞株Saos-2、MG63、U2OS、143B以及人成骨细胞hFOB1.19中的表达水平。与hFOB1.19细胞比较,Saos-2、MG63、U2OS细胞中MAT1 mRNA的表达水平均明显升高(P<0.01),其中143B细胞中MAT1 mRNA的表达水平显著升高(P=0.000,图1)。选择143B细胞进行后续实验。
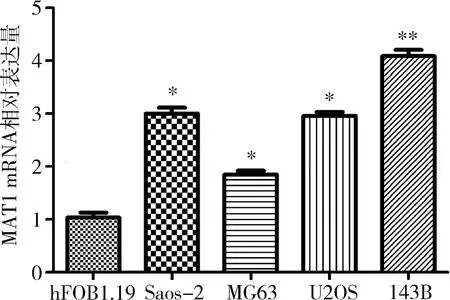
图1 qRT-PCR检测细胞MAT1 mRNA表达水平与hFOB1.19细胞比较,*P<0.01,**P=0.000
2.沉默MAT1对骨肉瘤细胞143B增殖的影响:qRT-PCR检测转染后各组143B细胞中MAT1 mRNA的表达水平,与Blank组比较,siRNA-NC组MAT1 mRNA的表达水平无显著变化,而siRNA-MAT1组MAT1 mRNA的表达水平较Blank组和siRNA-NC组明显下降(P<0.01,图2),表明转染siRNA成功。CCK-8检测在转染143B细胞后24、48、72、96h时细胞的增殖能力,转染siRNA-MAT1的细胞增殖活性较低,在72h时siRNA-MAT1组细胞增殖活力显著低于Blank组和siRNA-NC组(P<0.01,图3)。利用流式细胞术检测转染后各组143B细胞的周期变化,Blank组和siRNA-NC组中细胞G1期比例分别为48.22%、47.89%,S期比例为32.41%、30.67%。而siRNA-MAT1组细胞G1期比例增加,达到60.23%, S 期比例下降至23.55%(图4)。

图2 qRT-PCR检测各组转染143B细胞MAT1 mRNA表达与Blank组比较,*P<0.01;与siRNA-NC组比较,#P<0.01
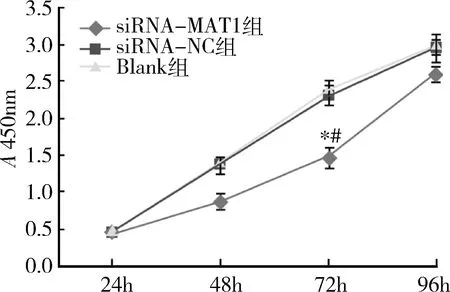
图3 CCK-8检测各组转染143B细胞增殖活力与Blank组比较,*P<0.01;与siRNA-NC组比较,#P<0.01
3.沉默MAT1对骨肉瘤细胞143B迁移的影响:通过Transwell 小室法对转染后各组143B细胞的迁移能力进行分析,siRNA-MAT1组143B细胞迁移的细胞数目明显低于对照组和siRNA-NC组(P<0.01),而siRNA-NC组较Blank组细胞迁移的细胞数目无显著变化(图5)。

图4 流式细胞术检测各组转染143B细胞周期变化
4.沉默MAT1对骨肉瘤细胞143B中 SDF-1/CXCR4信号通路的影响:Western blot法检测转染后各组143B细胞中SDF-1与CXCR4蛋白表达情况,siRNA-NC组SDF-1和CXCR4蛋白表达水平较Blank组无显著变化,而沉默143B细胞中MAT1的表达后,细胞中SDF-1与CXCR4蛋白表达相对于Blank组和siRNA-NC组细胞均显著降低(P<0.01),详见图6。

图6 Western blot法检测各组转染143B细胞SDF-1与CXCR4蛋白表达与Blank组比较,*P<0.01;与siRNA-NC组比较,#P<0.01
讨 论
恶性肿瘤转移是导致OS患者治疗失败的主要原因[13]。深入研究骨肉瘤的发病机制并寻找新型治疗方法,这对提高OS临床治疗效果是至关重要的。而骨肉瘤的发病机制与许多基因的途径相关,因此,探讨骨肉瘤中相关基因改变的研究将有助于理解其转移的分子机制并确定潜在的治疗靶标。
MAT1基因编码的蛋白质可以通过苏氨酸磷酸化来激活与细胞周期蛋白相关的激酶[12]。已有研究发现,MAT1在细胞增殖、分化和胚胎发育中起着至关重要的作用[11,14]。例如,Liu等[15]通过用siRNA或重组腺病毒转染敲除MAT1后,研究表明人胰腺癌的细胞增殖力明显降低并诱导了G0/G1期的阻滞。Fejzo等[16]揭示了ADRM1的过表达增强了卵巢癌ES2细胞的增殖和迁移能力,而MAT1的表达也升高,这表明MAT1可能参与了肿瘤的转移。本研究RT-PCR检测结果显示,MAT1在骨肉瘤细胞株Saos-2、MG63、U2OS以及143B中均高表达,这也提示MAT1可能与骨肉瘤的发生有关。RNAi技术是分子生物学研究中干扰基因表达以及研究基因功能的基因调控手段,能够与靶基因在特定区域特异性结合来切割 mRNA 使靶基因降解[17]。本研究通过RNAi 技术沉默骨肉瘤143B细胞中MAT1的表达检测其对143B增殖和迁移的影响。沉默143B细胞中MAT1的表达后,通过CCK-8检测发现在24、48、72、96h细胞增殖能力均受到抑制,流式细胞术结果显示细胞G1期比例增加而S 期比例下降,Transwell小室细胞迁移实验结果显示细胞迁移率明显下降。说明沉默MAT1表达能够抑制 143B细胞增殖与迁移,并阻滞细胞周期进程。
基质细胞衍生因子-1 (SDF-1)及其特异性趋化因子受体4(CXCR4)在肺癌、大肠癌、乳腺癌及甲状腺癌等多种肿瘤实质细胞中广泛表达,并在恶性肿瘤细胞的增殖、分化、侵袭与迁移等过程中起着关键的调节作用[18~21]。两者特异性结合发生空间构象改变,与此同时,通过活化与其偶联的G蛋白并激活多条信号转导通路,以产生相关联的生物学效应。Liao等[22]通过在体外和小鼠实验研究发现,AMD3100通过抑制JNK和Akt通路降低了CXCR4介导的骨肉瘤转移。本研究结果证实,沉默MAT1表达也能够抑制骨肉瘤143B细胞中SDF-1与CXCR4蛋白表达。但其激活作用或共同参与这一过程的其他信号通路有待于进一步研究。
综上所述,MAT1与骨肉瘤的发展进程关系密切,通过本研究表明沉默MAT1表达可以抑制骨肉瘤143B细胞的增殖与迁移、阻滞细胞周期进程,机制可能与下调 SDF-1与CXCR4表达有关。
