lncRNA MRAK048635_P1对血管平滑肌细胞miRNA的调控作用
2020-07-02方根强黄黎亚赵仙先陈书艳
方根强 祁 佳 黄黎亚 赵仙先 陈书艳
高血压是心脑血管疾病最重要的危险因素。血压持续升高导致的血管重塑和血管功能障碍是造成心脑血管疾病患者死亡的重要原因。血管重塑是由于血管平滑肌细胞 (vascular smooth muscle cell,VSMC)的异常增殖、迁移和侵袭所引起的[1,2]。长度>200nt的长链非编码RNA (long non-coding RNA,lncRNA)是一类重要的非编码转录本[3]。lncRNA可以在转录和转录后水平调节靶基因的表达,并广泛参与众多生物学过程[4]。最近的研究显示,lncRNA在心血管疾病中也起着至关重要的作用。Kumarswamy等[5]研究发现lncRNA uc022bqs.1在心力衰竭患者中的表达水平明显增加,并且与心血管死亡的风险呈正相关。研究发现lncRNA MALAT1与糖尿病引起的微血管功能障碍密切相关[6]。Chen等[7]报道lncRNA NR_104181高表达和NR_027032低表达可能与高血压风险有关。
lncRNA可作为一种竞争性内源性RNA (competitive endogenous RNA,ceRNA)与microRNAs (miRNAs)相互作用,参与调控靶基因的表达。在这一过程中,lncRNA通过应答元件 (miRNAs response element,MRE)竞争性地结合具有相同MRE的miRNAs从而参与靶基因的表达调控[8,9]。另外,再狭窄 (restenosis)主要是由于血管中VSMC过度增殖所致。Lv等[10]研究发现lncRNA H19来源的miR-675通过靶向原癌基因PTEN加重血管再狭窄。另外,Tian等[11]研究发现lncRNA UCA1能够通过抑制miR-26a调控VSMC的增殖和迁移能力。总之,越来越多的证据显示lncRNAs和miRNAs与心脑血管疾病的发生和发展密切相关。因此,准确预测lncRNA的靶miRNAs并对其靶基因进行系统的生物学分析是研究其作用机制的重要环节,而生物信息学工具可以快速有效地提供靶基因预测、基因测序和调控网络构建等方面数据。
为了探究lncRNA在高血压病VSMC中的生物学作用,Yao等[12]利用基因芯片筛选自发性高血压大鼠 (spontaneously hypertensive rats,SHR)和Wistar-Kyoto大鼠 (WKY)的主动脉中VSMC的lncRNA表达谱,结果显示68个lncRNAs被上调,而167个lncRNAs在SHR的主动脉中被下调。研究表明,lncRNA MRAK048635_P1可在Wistar-Kyoto大鼠中出现明显的表达量变化[13]。本团队前期研究结果表明,lncRNA MRAK048635_P1水平的降低可能是高血压血管重构的重要因素,调节vsmc功能和表型,降低MRAK048635_P1可能是治疗原发性高血压的一个潜在靶点[14]。在笔者前期研究中为了进一步探讨MRAK048635_P1潜在的机制功能,尝试预测可能与MRAK048635_P1相互作用的miRNAs,但未获得相关结果。同时,笔者也注意到SHR中MRAK048635_P1的表达水平与WKY比较存在显著差异,说明MRAK048635_P1在大鼠自发性高血压中参与对VSMC的调节。本研究以MRAK048635_P1为切入点,系统分析了其参与调控的miRNAs及相应靶基因,用以探讨MRAK048635_P1与高血压发病机制间的相关性。
材料与方法
1.实验动物和VSMC的制备: 实验用大鼠购自中国科学院上海实验动物中心,生产许可证号:SCXK(沪)2017-0005。VSMC分离自正常大鼠主动脉,具体方法参考文献[15]。所有动物实验均遵循实验室动物保护原则。siMRAK048635_P1和对照组siRNA质粒购自上海吉玛制药技术有限公司,并使用Lipofectamine RNAiMAX Transfection Reagent (13-778-075,美国Invitrogen公司)转染。miR-122-5p inhibitor以及miR-122-5p inhibitor negative control (NC)质粒购自上海吉玛制药技术有限公司。
2.差异miRNAs聚类分析: 实验动物分为空白组、NC组、siRNA1组、siRNA2组 、siRNA3组进行差异miRNAs聚类分析。差异miRNAs聚类分析用于判断不同实验条件下差异miRNAs表达量的聚类模式。根据miRNAs的表达量进行的聚类,通过log10 (TPM+1)进行计算,是为了判断不同实验条件下差异miRNAs表达量的聚类模式。聚类使用的为R软件中的聚类软件包pheatmap,所针对的数据为union_for_cluster (差异miRNAs的并集),以miRNAs的相对表达水平值log2 (ratios) 进行聚类。其采用相应的距离算法,算出每个miRNAs之间的距离,然后通过反复迭代,计算miRNAs之间的相对距离,最后根据miRNAs的相对距离远近分成不同的subcluster,从而实现聚类。
3.GO富集分析: GO分析方法为GOseq,此方法基于Wallenius non-central hyper-geometric distribution,相对于普通的Hyper-geometric distribution,此分布的特点是从某个类别中抽取个体的概率与从某个类别之外抽取一个个体的概率是不同的,这种概率的不同是通过对基因长度的偏好性进行估计得到的,从而能更为准确地计算出GO term被候选靶基因富集的概率[16]。本研究中笔者针对细胞组分、分子功能和生物学过程进行富集分析。
4.KEGG通路富集分析: 通路显著性富集分析以KEGG Pathway为单位,应用超几何检验,找出与整个基因组背景比较,在候选靶基因中显著性富集的Pathway。用BH的方法对P值进行校正,得到的校正后的P值越小代表越显著。这里将P<0.05的通路定义为在候选靶基因中显著富集的通路。
5.qRT-PCR:VSMC分别转染Scr siRNA和siMRAK048635_P1, 检测Scr siRNA组和siMRAK048635_P1组VSMC中MRAK048635_P1、miR-122-5p和Gper1的表达;同时检测miR-122-5p inhibitor组和miR-122-5p inhibitor negative(NC)组VSMC中miR-122-5p和Gper1的表达。使用Trizol(美国Invitrogen公司)提取大鼠VSMC中总RNA,反转录成cDNA(瑞士Biotool公司,B24403),然后进行qRT-PCR(瑞士Biotool公司,B21202)。Gper1上游引物为:5′-GGACAACTTACTGATGCTAGGG-3′;下游引物为:5′-CGGTGCAGCTGGAACAACCGAC-3′。采用20μl PCR反应体系: ddH2O 7μl,上下游引物各0.5μl,PCR Super Master Mix 10μl,cDNA 2μl。qRT-PCR反应条件:95℃ 5min预变性,95℃ 30s变性,55℃ 30s退火、72℃ 30s延伸,共40个循环。采用△△Ct法对实验结果进行分析。

结 果
1.差异miRNAs聚类分析:在VSMC细胞中,特异性siRNA被用来下调大鼠VSMC中MRAK048635_P1的表达水平 (图1A)。然后,通过对敲降效果最好的siRNA2干扰前后的VSMC中miRNA进行二代测序,随后,笔者利用散点图对miRNAs的表达谱进行了分析,发现大量的miRNAs在NC组和siRNA组之间有差异表达 (图1B)。层次聚类分析用于判断各组中差异表达的miRNAs,其结果显示siRNA介导MRAK048635_P1下调后,共有12个差异表达的miRNAs,其中表达上调的miRNAs分别是miR-122-5p (2.3倍)、miR-122b (2.5倍)、miR-127-3p (3.6倍)、miR-206-3p (3.6倍)、miR-434-5p (7.5倍),下调的miRNAs分别是miR-1b (2.6倍)、miR-451-5p (3.6倍)、miR-143-3p (1.5倍)、miR-99a-5p (1.9倍)、miR-133a-3p (2.8倍)、miR-133c (2.8倍)和miR-146a-5p (1.0倍) (图1C)。
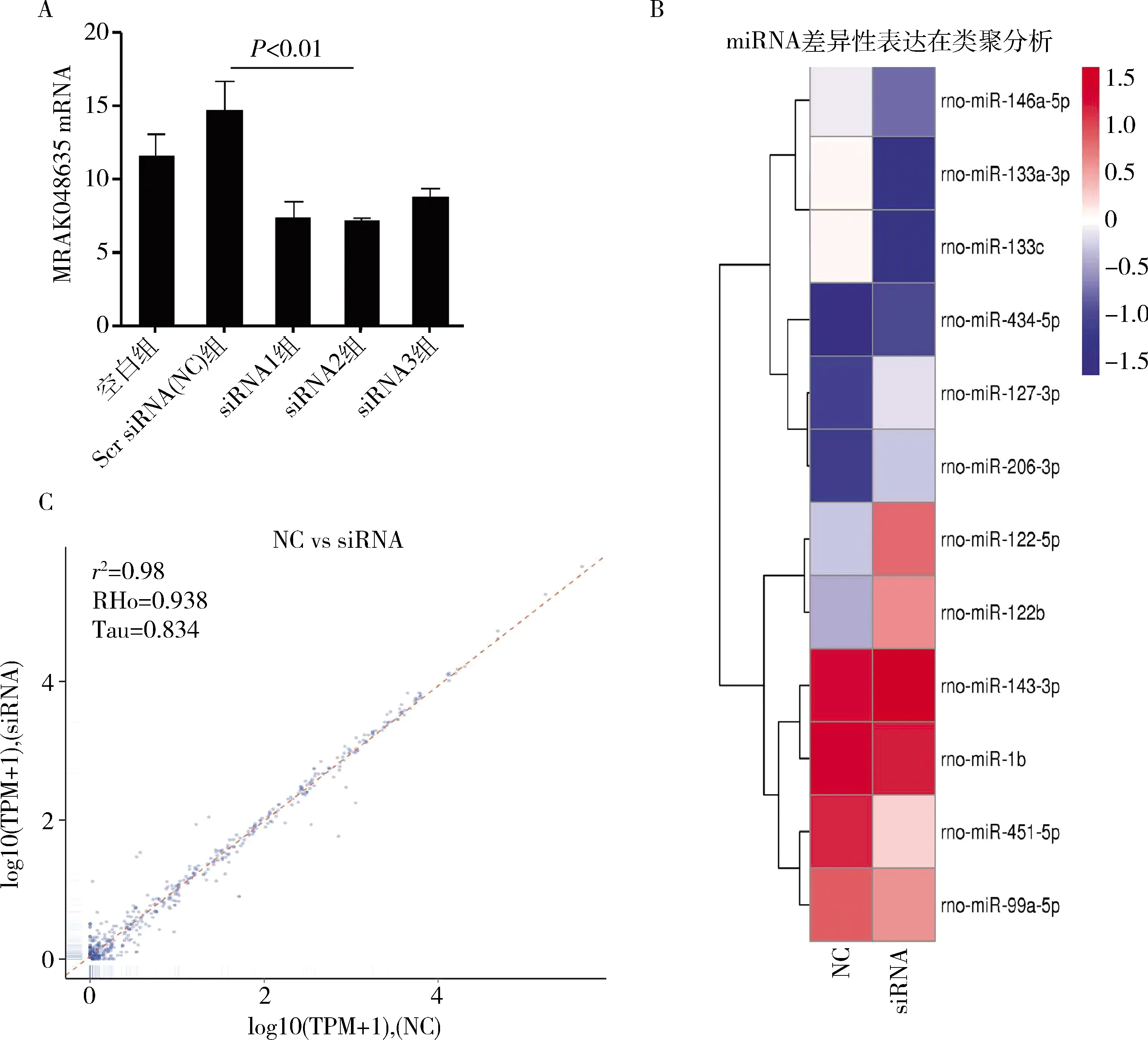
图1 差异miRNAs聚类分析A.在VSMC中,通过qRT-PCR验证siMRAK048635_P1的干扰效率;B. 散点图显示NC组和siRNA组存在表达差异的miRNAs;C. 整体层次聚类图,以log10 (TPM+1)值进行聚类,红色表示高表达miRNAs,蓝色表示低表达miRNAs
2.靶基因预测及GO分析:利用miRanda、PITA和RNAhybrid软件预测的差异表达的miRNAs的靶基因共5066个。笔者对每组差异表达miRNAs的靶基因的集合分别进行GO富集分析(图2)。横坐标为GO 3个大类的下一层级的GO term,纵坐标为注释到该term下的候选靶基因个数及其个数占被注释上的候选靶基因总数的比例。3种不同分类表示Go term的3种基本分类,从左往右依次为生物学过程、细胞成分、分子功能。结果发现其中302个基因具有GO分子功能注释信息,其功能主要富集于血管内皮迁移的负调控、心血管系统发育、信号受体活性、核染色质和蛋白结合以及免疫应答等。在查询GO富集结果中与VSMC相关的基因时,有一个基因G protein-coupled estrogen receptor 1 (Gper1)多次出现。Gper1正是差异表达的miR-122-5p的靶基因。

图2 候选靶基因GO富集柱状图
3.KEGG通路分析:利用KEGG对差异表达miRNAs靶基因集合中的基因进行生物通路富集分析。这些靶基因显著富集于轴突导向(n=8)、昼夜节律 (n=4)、N-糖基生物合成 (n=5)、内吞蛋白加工 (n=9)、内质网矿物吸收 (n=7)、鞘脂代谢 (n=3)、核糖体生物合成 (n=3)、真核生物单纯性疱疹病毒感染 (n=5)、萜类 (n=4)、骨架生物合成 (n=7)、肾素-血管紧张素系统 (n=2)、维生素消化吸收 (n=2)、神经活性 (n=2)、配体-受体相互作用 (n=8)、炎性介质调节 (n=4)、咖啡因代谢 (n=1)、糖酵解及糖异生 (n=3)、果糖及甘露糖代谢(n=2)、脂肪消化吸收 (n=2)及类风湿关节炎(n=3)等相关通路 (P<0.05,图3)。
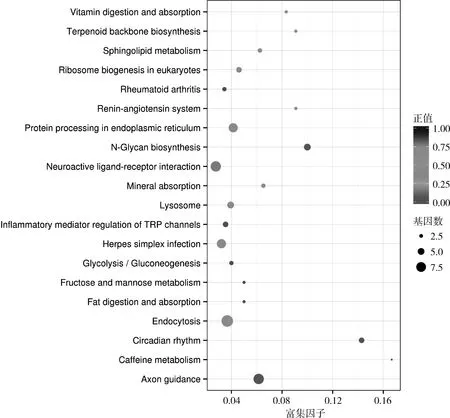
图3 候选靶基因KEGG富集散点图
4.下调的MRAK048635_P1可能通过促进miR-122-5p来调控Gper1的表达: 笔者通过一系列体外实验继续验证了生物信息学的分析结果。在MRAK048635_P1表达下调的大鼠VSMC中,miR-122-5p的表达水平显著增强(P<0.05),而Gper1 mRNA的表达被下调 (P<0.01)。另外,与NC inhibitor组比较,miR-122-5p inhibitor组中的Gper1 mRNA的表达水平显著增强 (P<0.01,图4)。

图4 MRAK048635_P1通过抑制miR-122-5p来调控Gper1的表达 A.转染Scr siRNA和siMRAK048635_P1的VSMC中MRAK048635_P1、miR-122-5p和Gper1的表达;B.转染miR-122-5p inhibitor和miR-122-5p inhibitor negative(NC)的VSMC中miR-122-5p和Gper1的表达;C.MRAK048635_P1/miR-122-5p/Gper1 mRNA轴对高血压疾病潜在的调控机制
讨 论
血管损伤、血管重塑和血管生成是导致高血压并发症的主要原因[17]。lncRNAs和miRNAs参与了血管内皮细胞和VSMC功能的调控。相关研究提示MRAK048635_P1可能在大鼠自发性高血压中参与对VSMC功能的调节,因此对MRAK048635_P1进行靶miRNAs预测及其生物学特性分析具有重要意义[18]。
聚类分析用于判断差异miRNAs在不同实验条件下的表达模式,将表达模式相同或相近的miRNAs聚集成类,进而识别未知miRNAs的功能或已知miRNAs的未知功能,这些同类miRNAs可能具有相似的功能[19]。本研究通过特异性siRNA下调大鼠VSMC中MRAK048635_P1的表达,通过整体层次聚类分析发现MRAK048635_P1下调后共13个差异表达的miRNAs,其中5个miRNAs的表达被上调,7个表达被下调。成熟的miRNAs与其不完全互补的mRNA的3′UTR结合,在翻译水平上抑制靶mRNA的表达。另外,miRNAs也有可能影响mRNA的稳定性。接下来,笔者利用miRanda、PITA和RNAhybrid软件来预测这些差异表达的miRNAs的靶基因[20]。
GO和KEGG分析被用来研究MRAK048635_P1表达下调后差异表达的miRNAs的靶基因的作用机制。GO是基因功能国际标准分类体系。根据实验目的选出靶基因后,研究候选靶基因在GO中的分布状况将阐明实验中样本差异在基因功能上的体现。笔者发现差异表达的miRNAs的靶基因主要富集于血管内皮迁移的负调控、心血管系统发育、信号受体活性、核染色质和蛋白结合以及免疫应答等生物学功能中。值得注意的是,GO富集结果显示,miR-122-5p的靶基因Gper1尚参与调节血管平滑肌的分化。Gper1定位于染色体7p22上,由一条含7次跨膜结构的肽链构成,其主要组成包括配体结合结构域、G蛋白结合结构域以及1个Asp-Arg-Tyr三联体保守序列[21]。Gper1广泛表达于心脏和动静脉的VSMC和内皮细胞中,参与对血管中内源性的血管收缩物质 (如血管紧张素Ⅱ)和血管扩张物质如NO的调节作用[22]。相关的机制研究显示,作为7次跨膜受体,结合外源信号后的GPER可变构激活表皮生长因子受体 (epidermal growth factor receptor,EGFR),进而激活下游的磷脂酰肌醇-3激酶 (PI3K),然后,磷脂酰肌醇3磷酸 (PIP3)在细胞膜上聚集并通过其PH结构域激活蛋白激酶B (PKB),最终催化NO的合成。NO进入VSMC并激活鸟苷酸环化酶 (GC),GC通过cGMP-PKG通路介导血管松弛[23]。
临床研究表明,由于Gper1参与了雌激素对血压的调节,绝经前女性的高血压发生率明显低于同龄男性。进一步的机制研究表明,Gper1可能抑制VSMC中Ca2+通道的开放,降低胞内Ca2+的浓度,从而抑制Ca2+-CaM复合物的形成,最终导致非内皮依赖性的血管舒张[24]。结合本课题的研究结果,笔者推断,在VSMC细胞中,MRAK048635_P1可能通过与miR-122-5p相互作用靶向Gper1,从而参与高血压疾病的发生。与预测结果相同,本实验结果初步揭示了一条MRAK048635_P1调控高血压疾病发生、发展的潜在分子通路,即MRAK048635_P1/miR-122-5/Gper1 mRNA轴 (图4)。当然,要揭示其中的具体机制仍需要大量的工作,这将是未来研究的重点。
本研究对差异表达miRNAs的靶基因进行KEGG富集。在生物体内,不同基因通过相互协调发挥其生物学功能,通过通路显著性富集能确定候选靶基因参与的最主要生化代谢途径和信号转导途径。KEGG可对miRNAs诸多靶基因所涉及信号通路进行整合分析。通路显著性富集分析以KEGG通路为单位,应用超几何检验,找出与整个基因组背景比较,在候选靶基因中显著性富集的通路[25]。本研究中的KEGG通路分析结果显示,MRAK048635_P1表达下调后差异表达的miRNAs功能显著富集于轴突导向、昼夜节律、N-糖基生物合成、内吞蛋白加工、内质网矿物吸收、鞘脂代谢和核糖体生物合成等相关通路 (P<0.05)。KEGG结果提示MRAK048635_P1不仅在高血压疾病中起着重要作用,而且可能参与多种疾病的发生与发展过程,其作用机制有待进一步研究。
综上所述,本研究通过生物信息学对VSMC中MRAK048635_P1下调后差异表达的miRNAs进行靶基因预测、GO分析和KEGG信号通路分析,结果显示MRAK048635_P1可能通过调控多种miRNAs参与信号通路的调节。另外,MRAK048635_P1/miR-122-5/Gper1 mRNA轴可能在高血压疾病中发挥着重要的作用,是一个颇有研究价值的生物学靶标。
