死亡黄牛脾肺组织中病原菌的分离与敏感药物筛选
2020-07-02刘亚欣郭桂英曾纪锋郑继平
刘亚欣,王 宇,杨 诺,郭桂英,李 迁,曾纪锋,郑继平*
(1. 海南大学 生命科学与药学院,海南 海口 570228;2. 海南大学教务处,海南 海口 570228;3.海南大学 网络与技术中心,海南 海口 570228;4. 海南大学 动物科技学院,海南 海口 570228)
阴沟肠杆菌(Enterobacter cloacae)在分类学上隶属肠杆菌目肠杆菌科肠杆菌属,其分布广泛,除了自然界,还存在于人和动物肠道[1],是医院内感染条件性致病菌之一,可引起宿主伤口感染、泌尿系统感染、肺炎及败血症等[2]。有大量文献报道了阴沟肠杆菌在医院临床的分离与耐药性分析,另有研究表明阴沟肠杆菌也是诱导人体发胖的主要病原之一[3]。但其对动物的感染却鲜有报道。也有研究表明阴沟肠杆菌可引起大熊猫、绵羊、蓝孔雀、鸡、亚洲黑熊出现呼吸道感染、肺炎、出雏率下降和死亡等症状[4-8]。
黄牛是中国固有的普通牛种。角短,皮毛黄褐色或黑色,用来耕地或拉车,皮可制革,其肉质鲜嫩,具有低脂肪高营养的特点,其饲养地区几乎遍布全国。作为我国的一种土著性物种,黄牛一般具有比进口奶牛等物种更强的免疫抗性[9],因此有关阴沟肠杆菌感染黄牛的报道十分罕见。本研究对2018 年5 月海口市昌盛村某养牛场一头明显营养不良死亡黄牛的脾肺组织样品经病原分离发现主要为阴沟肠杆菌感染。本研究为该地区黄牛养殖业相关疾病防控提供了参考。
1 材料与方法
1.1 实验动物、培养基及主要试剂 BALB/c 小鼠30 只,体质量20±2 g,雌雄各半,购自海南药物研究所。
脑心浸出液(BHI)培养基、药敏纸片,均购自杭州滨和微生物试剂有限公司;革兰氏染色试剂盒购自南京建成科技有限公司;细菌基因组DNA 提取试剂盒,购自北京华越洋生物科技有限公司;2×F8 Fast Long PCR Master mix、2×A8 Fast HiFi PCR Master Mix、PCR 产物纯化回收试剂盒、DL2000 DNA Mark⁃er,均购自北京艾德莱生物科技有限公司。
1.2 死亡黄牛组织病料样品采集及细菌分离培养无菌采集死亡黄牛的肺脏、脾脏,用无菌接种环采集死亡黄牛脾肺样品分别划线接种于BHI 琼脂平板上,37 ℃培养18 h,挑取单菌落划线接种于普通斜面培养基上进行纯培养,然后经革兰染色和镜检。
1.3 分离菌的生化特征鉴定 取纯培养后的分离菌,分别接种于糖发酵管、葡萄糖蛋白胨等培养基,37 ℃培养24 h~48 h 观察结果,依据《常见细菌系统鉴定手册》进行细菌生化鉴定。
1.4 分离菌16S rRNA 基因的扩增及其序列分析按照细菌基因组DNA 提取试剂盒说明书,提取分离菌基因组DNA,以其为模板,采用16S rRNA 通用引物(F1:5'-AGAGTTTGATCCTGGCTCAG-3'/F2: 5'-GG TTACCTTGTTACGACTT-3')进 行PCR 扩 增,PCR 产物由北京六合华大基因科技有限公司测序,测序结果与GenBank 中相关基因序列进行同源性分析,并利用MEGA7.0.26 构建该基因的系统发育树。
1.5 小鼠感染性试验 将BALB/c 小鼠随机分为6组,每组5 只,取细菌纯培养物接种液体培养基,37 ℃培养18 h,测定并调整细菌浓度到1×1010cfu/mL后,10倍倍比稀释成5个浓度(109cfu/mL~105cfu/mL),腹腔接种0.3 mL/只,对照组注射无菌PBS 0.3 mL/只。接种后连续观察7 d,每天记录小鼠死亡情况,计算分离菌对小鼠的半数致死量(LD50),同时剖检死亡小鼠,采集病变部位再次进行细菌分离。
1.6 分离菌的药敏试验 按照Kirby-Bauer(K-B)纸片扩散法进行药敏试验,统计实验菌株对12 种常用抗菌药物的敏感性。参照美国临床实验室标准委员会(NCCLS1994)推荐标准判断抑菌结果。
2 结果与讨论
2.1 病料样品的细菌分离结果 病死黄牛的脾脏、肺脏样品划线培养在BHI 培养板上37 ℃培养24 h后,可见两个样品在BHI 培养基上均生长有相同的圆形、边缘整齐、表面光滑湿润呈露珠状、中央隆起、乳白色,直径约为1.0 mm 的菌落(图1A),挑取单菌落进行革兰染色和镜检,可见呈单个或成簇排列的淡红色短杆菌(图1B),表明分离菌为革兰氏阴性杆菌。
2.2 分离菌的生化鉴定结果 随机挑取5 个单菌落进行纯培养,同时把菌株命名为CS01、CS02、CS03、CS04、CS05,对纯培养的细菌进行生化鉴定。结果显示,5 株菌均可分解利用葡萄糖、蔗糖、果糖、甘露醇等糖类(表1),表明该菌属于肠杆菌科。对照肠杆菌科生化鉴定手册初步判断其为阴沟肠杆菌。

图1 分离菌的形态(A)及染色镜检(B)结果(100×)Fig.1 Gram staining(A)and morphology(B)of the bacterial isolate(100×)
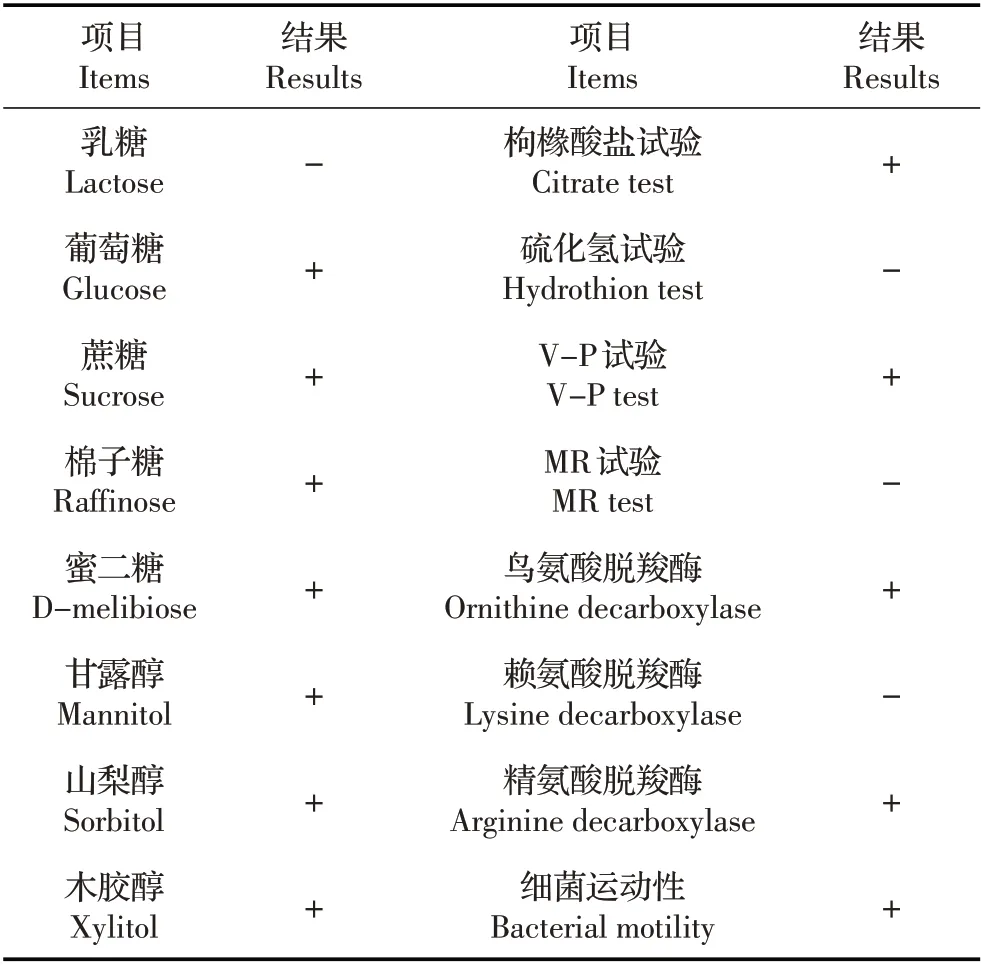
表1 分离菌生理生化鉴定结果Table 1 Physiological and biochemical test of the bacterial isolates
2.3 分离菌16S rRNA 基因的PCR 扩增及其序列分析结果 以提取的CS01 菌的基因组为模板,进行16S rRNA 基因的PCR 扩增,PCR 测序结果输入NCBI中进行核酸比对,结果显示分离菌CS01 与阴沟肠杆菌(Enterobacter cloacae)(KM401861.1)的 同 源 性 达100%;构建的16S rRNA 基因进化树显示,该菌与阴沟肠杆菌位于同一分支(图2)。上述结果进一步表明CS01 菌株为阴沟肠杆菌(Enterobacter cloacae)。
本研究首次在黄牛中发现阴沟肠杆菌感染。死亡黄牛的临床症状显示,该死亡黄牛极度消瘦且体色暗黄,呈明显的营养不良特征,表明引起该次黄牛阴沟肠杆菌感染的死亡与死亡黄牛的自身免疫力低下密切相关。同时也提示阴沟肠杆菌除了感染人、大熊猫、蓝孔雀、水产动物以外[10-12],在海南气候高温多湿,易于各种病原滋生的不良环境条件下,其对黄牛也会造成感染。

图2 分离菌株16S rRNA 基因遗传进化分析Fig.2 Cladogram based on the Enterobacter cloacae 16S rRNA sequence
2.4 小鼠感染性试验 将分离得到的阴沟肠杆菌CS01 株稀释成109cfu/mL~105cfu/mL 5 个不同浓度分别接种小鼠,依次是实验组1~实验组5,24 h 后,实验组1 和实验组2 的小鼠行动缓慢,震颤,饮水量和进食量减少,继续观察7 d,实验组1 小鼠死亡5 只,实验组2 小鼠死亡2 只,实验组3 和4 均死亡1 只,实验组5和对照组无死亡小鼠。按照Bliss 法计算,得出该阴沟肠杆菌对小鼠的LD50为9.60×107cfu/mL。
栗海军等从亚洲黑熊体内分离的阴沟肠杆菌对小鼠的LD50为7.94×108cfu/mL[7],相比较而言,本实验分离到了致病力更强的阴沟肠杆菌。剖检死亡小鼠,可见其肺脏充血肿大,脾脏出血。对死亡小鼠病变部位进行细菌分离,结果得到了与CS01 菌株形态、生理生化特征均一致的菌株,表明再次分离到了阴沟肠杆菌CS01 株。根据细菌分离鉴定和小鼠感染试验结果,确定导致该黄牛死亡的病原菌为阴沟肠杆菌。因此,加强对黄牛的饲养管理,增强黄牛体质是控制该菌感染的必要措施,同时应加强对该类条件致病菌的监测与防治。
2.5 药敏试验结果 结果显示,分离的阴沟杆菌对12 种抗菌药物均有不同程度的敏感性,按照其药物敏感性强弱排列依次为诺氟沙星、氧氟沙星、环丙沙星,林可霉素;对新霉素、四环素、阿莫西林、米诺环素、多黏菌素B、丁胺卡那霉素中度敏感,对青霉素和复方新诺明耐药(表略)。诺氟沙星、氧氟沙星、环丙沙星属于第三代氟喹诺酮类新药,对阴沟肠杆菌确实有显著的效果,但应注意合理使用,避免滥用药物导致耐药现象发生。但该结果不同于其他地区兽医类阴沟肠杆菌的耐药谱[7],分析原因可能是由于养殖区所处地域的不同和使用抗生素的习惯不同造成的。该药敏试验结果为该地区黄牛养殖业合理选用抗菌药物提供参考依据。
利用抗菌药物治疗有利有弊,有利的一面是见效快,使用方便;不利的一面是滥用抗菌药物会使病原菌对常用抗菌药物产生耐药。邓凯伟研究了不同中草药复方组合对阴沟肠杆菌的抑制作用,结果表明石榴皮提取物、白头翁提取物组合有较好的体外抑菌效果[13]。
由于本实验是从黄牛脾肺组织分离出阴沟肠杆菌,可能是由于该菌感染黄牛呼吸道所致,对于黄牛这种圈养动物,一方面可能是由于工作人员频繁出入饲养环境,不注意周围卫生,二是没有注意黄牛本身的营养,致使其免疫力低下,才导致阴沟杆菌的感染。因此,外部环境的清洁、规律的消毒、合理使用抗生素以及开发中药制剂是黄牛养殖业发展的关键因素。
