CVC1302 对O 型口蹄疫病毒细菌样颗粒疫苗的免疫增强作用
2020-07-02侯立婷于晓明乔绪稳张元鹏郑其升侯继波
侯立婷,陈 瑾,于晓明,乔绪稳,张元鹏,郑其升*,侯继波*
(1. 江苏省农业科学院 国家兽用生物制品工程技术研究中心,江苏 南京 210014;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
口蹄疫(Foot-and-mouth disease,FMD)是由口蹄疫病毒(Foot-and-mouse disease virus,FMDV)引起的偶蹄动物的急性、热性、高度接触性传染病。该病传播途径多、速度快,是危害畜牧业最严重的传染病之一[1]。该病曾多次在世界范围内发生大流行,国际兽医局将其列为必须通报的烈性传染病[2]。FMDV病毒粒子无囊膜,衣壳由VP1、VP2、VP3、VP4 4种结构蛋白组成,其中VP1 蛋白暴露在病毒粒子表面,含有可诱导感染动物产生中和抗体的主要抗原表位,是FMD 新型疫苗研究最多的结构蛋白[3-5]。研究发现O 型FMDV 的5 个抗原位点中有3 个位于VP1结构蛋白上,主要的B 细胞表位为aa141~aa160,其能够诱导机体产生体液免疫应答[6]。两个辅助性T细胞表位分别为T1(aa21~aa35)和T2(aa200~aa213),其能够增强Th 细胞的活性,并同时协同诱导机体产生抗病毒抗体[7]。本实验前期选取FMDV VP1 结构蛋白上的B、Th 细胞表位进行亚单位疫苗的设计,利用实验室可溶性表达平台进行蛋白的可溶表达,利用革兰氏阳性增强基质(GEM)表面展示系统对其进行纯化,构建了细菌样颗粒(Bacterial like parti⁃cles,BLP)疫苗GEM-B(T1BT2)4B[8]。GEM 表面展示系统由GEM 颗粒和蛋白锚钩(Protein anchor,PA)构成,研究证实,与PA 融合表达的目标蛋白可以展示在GEM 颗粒的表面,以GEM 为骨架形成BLP抗原。GEM 颗粒易于保存、稳定性好、可以刺激机体产生强烈的免疫应答,并且该系统操作简单[9-11]。
免疫增强剂CVC1302(ZL 201310042983.0)是由国家兽用生物制品工程技术研究中心免疫技术研究室自行研制,该增强剂经过大量实验证明,可以显著提高各类FMD 疫苗免疫效力,而且能够延长抗体的持续期[12]。本实验将免疫增强剂CVC1302 与GEM-B(T1BT2)4B 混合乳化制成疫苗,免疫小鼠和仔猪,通过评价其免疫效力,为FMD BLP 疫苗的研制提供参考依据。
1 材料与方法
1.1 主要实验材料 BLP 疫苗GEM-B(T1BT2)4B 及表达用载体pQZ-PA,由本实验室构建制备[8];MTT、PHA 购自南京生兴生物科技有限公司;4 周龄的ICR 小鼠购自扬州大学比较医学中心;45 日龄FMD 抗体阴性仔猪,由国家兽用生物制品工程技术研究中心试验猪场提供;FMDV VP1 ELISA 试剂盒购自上海优耐特生物医药有限公司;O 型FMD 液相阻断ELISA 抗体检测试剂盒购自中国农业科学院兰州兽医研究所;商品化FMD 合成肽疫苗[批号:(2014)090297522]由国家兽用生物制品工程技术研究中心提供;佐剂为实验室自购的白油、司本、吐温;免疫增强剂为CVC1302 由本实验室购买、配制。
1.2 动物分组与免疫
1.2.1 小鼠免疫实验 4周龄的ICR小鼠50只,随机划分为5 组,每组10 只,分别标记为A、B、C、D、E组。A 组 为GEM-B(T1BT2)4B 组;B 组 为GEM-B(T1BT2)4B与免疫增强剂CVC1302配合使用组;C组为pQZ-PA 转化的E. coli 对照组;D 组为PBS 空白对照组;E组为商品化FMD合成肽疫苗对照组。
免疫增强剂CVC1302(50 μg/只)先与GEM-B(T1BT2)4B 混合再与白油佐剂按1∶2 乳化制苗。以0.2 mL/只皮下多点注射进行免疫,免疫后21 d 加强免疫一次,分别于免疫后的21 d、35 d、42 d、49 d、56 d、63 d 采集血清用于FMDV VP1 结构蛋白抗体检测。
1.2.2 猪免疫实验 45 日龄FMD 抗体阴性仔猪50头仔猪随机划分为5 组,每组10 头,分别标记为I、II、III、IV、V 组。I 组 为GEM-B(T1BT2)4B组; II 组 为GEM-B(T1BT2)4B 与 免 疫 增 强 剂CVC1302 配合使用组;III 组为pQZ-PA 转化的E.coli对照组;IV 组为PBS 空白对照组;V 组为商品化FMD 合成肽疫苗对照组。
免疫增强剂CVC1302(1 mg/头)先与GEM-B(T1BT2)4B 混合后,再与白油佐剂按1∶2 混合乳化制苗。采用肌肉注射的方式进行免疫,免疫剂量为2 mL/头,免疫后28 d 加强免疫一次,分别于0、28 d、56 d 采集血清用于液相阻断抗体ELISA 检测。1.3 血清IgG 抗体检测 按照免疫程序采取小鼠及仔猪血清,分离后的血清按照FMDV VP1 结构蛋白抗体酶联免疫吸附试剂盒和O 型FMD 液相阻断抗体ELISA 检测试剂盒说明书测定其血清抗体。
1.4 小鼠淋巴细胞增殖检测 免疫后第35 d,每组随机取3 只免疫小鼠,采用断颈方式迫杀,先用0.5%新洁尔灭溶液对小鼠全身进行消毒,再用75%酒精消毒。无菌采取小鼠脾脏,分离淋巴细胞,用含10%(v/v)新生牛血清的RPMI-1640 完全培养液调整细胞浓度约为2×107个/mL,加入96 孔细胞板内,100 μL/孔,每个样品做3 个重复,向各孔内加入5 μg 人 工 合 成 的 猪O 型FMDV GH loop 表 位 多 肽(VP1 aa141~aa160 位AA)作为刺激抗原,同时设PHA 作为阳性对照组,2 μg/孔,置37 ℃、5%CO2培养箱中培养60 h,每孔加入5 μg/mL 的MTT 10 μL,继续培养4 h。测定OD490nm值,取3 个平均值计算刺激指数(SI),试验设不加FMD 抗原的营养液作为阴性对照。以SI 作为判断淋巴细胞转化程度的参数,SI=刺激孔OD492nm值/阴性对照孔OD492nm值。
1.5 小鼠细胞因子检测 免疫后第35 d,每组随机取3 只免疫小鼠,采用断颈方式迫杀,取相同质量的免疫小鼠脾脏研磨,反复冻融3 次,用TRIzol 裂解法提取RNA,利用一步反转试剂盒获得cDNA。根据GenBank 中登录的相关序列设计引物(表1),引物由南京金斯瑞生物科技有限公司合成,参考文献[13]的方法利用荧光定量PCR 检测小鼠脾脏中IL-4、IL-10、IFN-γ、TNF-α的基因转录水平。
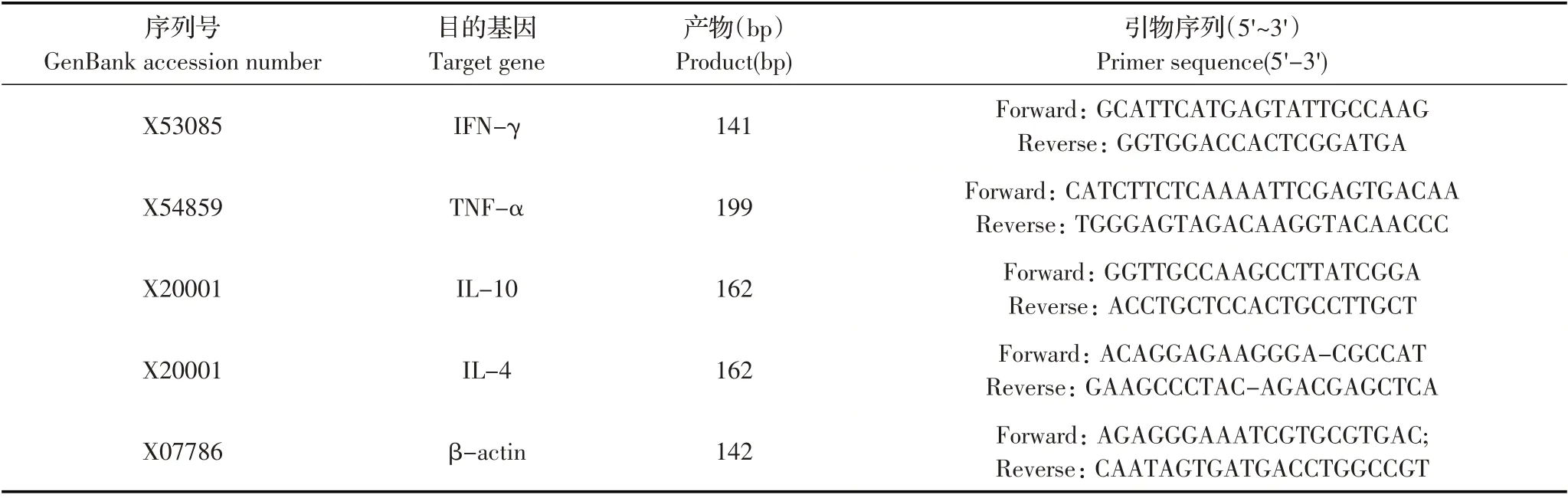
表1 实验用引物序列Table1 Primers used in this study
2 结 果
2.1 FMDV VP1 结构蛋白特异性抗体检测 利用FMDV VP1 结构蛋白抗体酶联免疫吸附试剂盒检测免疫增强剂CVC1032 的免疫增强作用。结果显示,小鼠首次免疫后21 d,GEM-B(T1BT2)4B+CVC1302组的IgG 抗体水平高于其他免疫组;GEM-B(T1BT2)4B+CVC1302 组与合成肽疫苗组在免后第42 d 抗体水平达到最高,第49 d开始小幅度下降,两组抗体水平差异不显著(p>0.05)。GEM-B(T1BT2)4B 组免后抗体水平上升缓慢,与GEM-B(T1BT2)4B+CVC1302 组相比,抗体水平差异显著(p<0.05)(图1)。表明免疫增强剂CVC1032 能够增强GEM-B(T1BT2)4B 诱导的小鼠免疫反应。
2.2 仔猪对疫苗的免疫应答反应 利用O 型FMD液相阻断ELISA 抗体检测试剂盒检测仔猪血清液相阻断抗体水平,根据OIE 制定的参考标准,血清抗体滴度>1∶64 判为阳性,<1∶40 判为阴性。结果显示,首免后56 d,GEM-B(T1BT2)4B+CVC1302 组与合成肽组能够产生高水平的液相阻断抗体。GEM-B(T1BT2)4B+CVC1302 组 的10 头 猪 的 抗 体 水 平 均在1∶128 以上,GEM-B(T1BT2)4B 组的抗体水平为1∶73.5。GEM-B(T1BT2)4B+CVC1302 组抗体水平显著高于B(T1BT2)4B 组(p<0.01),与合成肽免疫组抗体水平差异不显著(p>0.05)(图2)。表明CVC1302能够增强GEM-B(T1BT2)4B 的免疫原性,并且能够显著提高免疫猪的抗体水平。

图1 FMDV VP1 结构蛋白抗体检测结果Fig.1 Detection of antibodies against FMDV VP1 structural protein in mice using ELISA
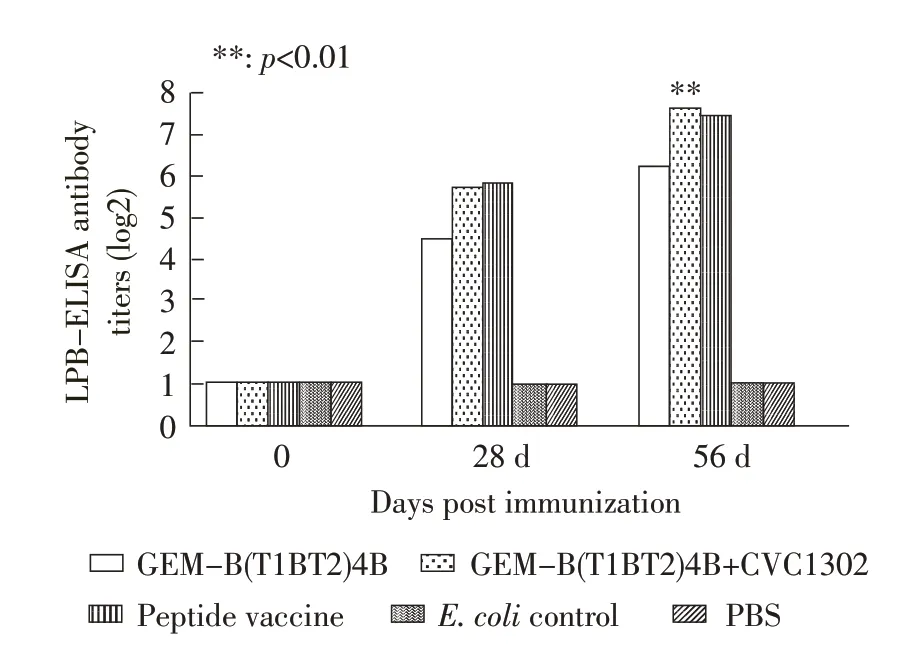
图2 猪血清液相阻断抗体滴度Fig.2 Antibody titers in swine detected with LPB ELISA kit
2.3 淋巴细胞增殖试验结果 采用MTT 法对小鼠脾脏淋巴细胞进行检测。结果显示,GEM-B(T1BT2)4B+CVC1302 组小鼠加强免疫后14 d 淋巴细胞增殖指数达到3.15±0.06,统计学分析结果显示,与商品化的人工合成肽疫苗所引发的T 细胞增殖反应差异不明显(p>0.05),与GEM-B(T1BT2)4B 组差异极显著(p<0.01)(图3)。表明免疫增强剂CVC1302能够引起特异性的淋巴细胞增殖反应。
2.4 细胞因子检测结果 分离免疫后35 d 的小鼠脾脏,提取RNA,参考文献[13]的方法采用荧光定量PCR 方法检测IL-4、IL-10、IFN-γ、TNF-α的表达水平。结果显示,GEM-B(T1BT2)4B+CVC1302 组小鼠的IFN-γ 与IL-4 的表达水平显著高于GEM-B(T1BT2)4B 组(p<0.01),与合成肽疫苗组差异不显著(p>0.05)。所有实验组IL-10、TNF-α水平变化均不显著(p>0.05)(图4),表明CVC1302 免疫增强剂能够诱导小鼠产生明显的Th1 型免疫反应。
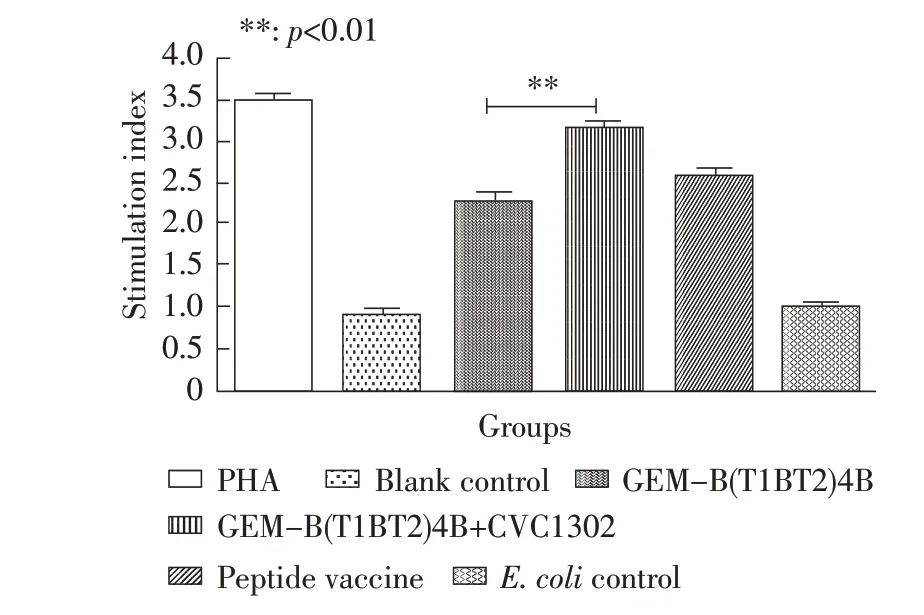
图3 疫苗免疫小鼠淋巴细胞增殖检测结果Fig.3 T-cell proliferation responses in the mice after BLP vaccine immunization
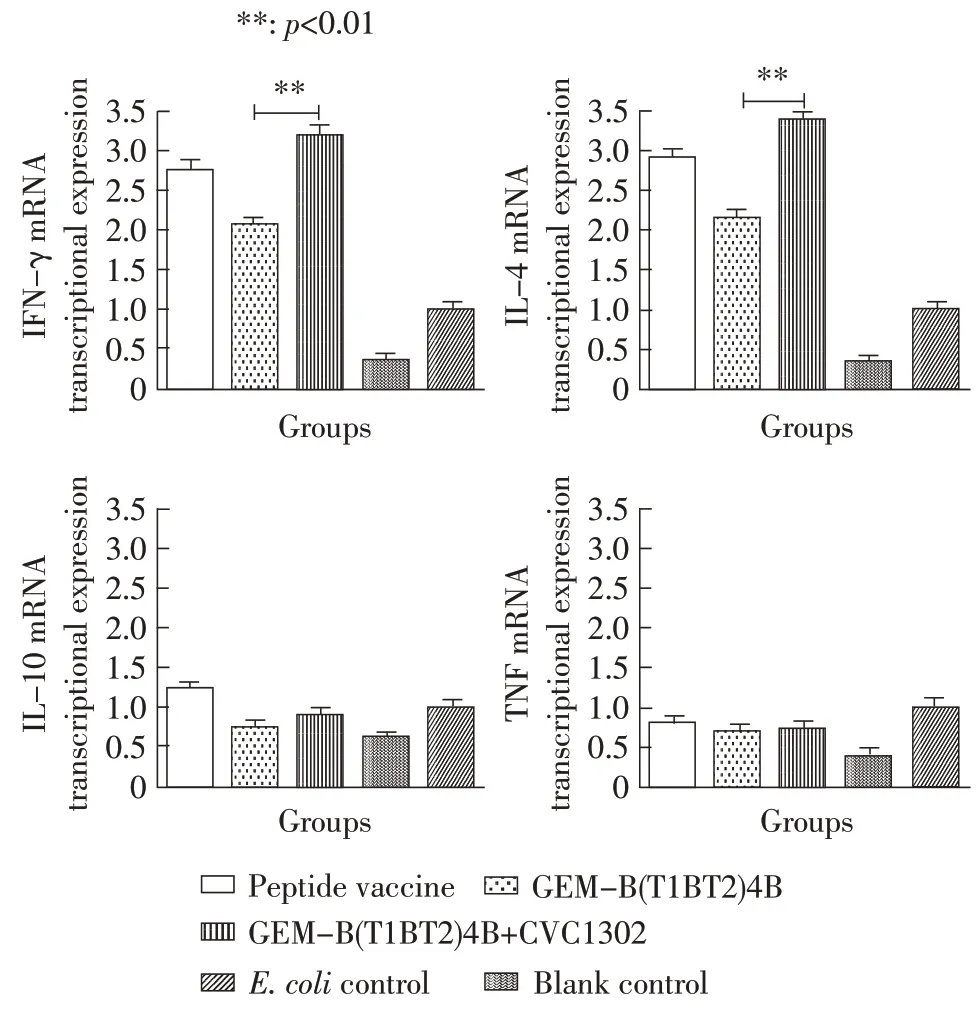
图4 免疫小鼠相关细胞因子检测结果Fig.4 Detection of cytokines for immunized mice at 35 days post primary vaccination
3 讨 论
疫苗接种是预防和控制FMD 的可靠手段。FMD液相阻断ELISA 抗体是公认的检测指标,且液相阻断ELISA 抗体水平与攻毒保护有一定的相关性,抗体滴度越高,保护率越高[14]。FMDV VP1 结构蛋白的aa141~aa160 和aa200~aa213 是FMDV 的 主 要 中 和表位,许多FMDV 表位疫苗的研究均含有这两个主要的抗原表位,并且均有较好的免疫效果[15-16]。王长怡将O 型FMDV VP1 蛋白aa141~aa160 位肽段和一个具有广谱性的辅助T 细胞表位进行化学合成,将其制备疫苗免疫猪后可以抵抗104.5TCID50FMDV 的强毒攻击[17],且已经形成商品化疫苗。但多肽的化学合成生产成本较高,本研究利用本实验室前期构建的O 型FMD BLP 疫苗配合免疫增强剂CVC1302 进行动物免疫试验,不仅能够提高VP1 结构蛋白特异性抗体,而且能够提高液相阻断ELISA 抗体的水平;且方法操作简便,生产成本低廉。
免疫增强剂CVC1302 含有多种TLR 受体的激动剂,能够显著提高机体的先天性免疫反应,提高并延长疫苗抗原的免疫效力[18]。研究表明,提高机体的细胞免疫水平对于预防FMDV 的感染具有重要的意义,高水平的细胞免疫反应对FMDV 感染初期降低FMD 发病率具有重要的意义[19-20]。添加免疫增强剂CVC1302 的BLP 疫苗能够显著提高IL-4、IFN-γ的表达水平,这可能将会对增强机体的抗病毒感染能力具有一定的作用。
传统的FMD 灭活疫苗在FMD 的防控中发挥了重要的作用。2012 年国务院办公厅发布实施的《国家中长期动物疫病防治规划》中将FMDV 的净化纳入了该规划,迫切需要能够代替传统灭活苗的安全有效的疫苗,而亚单位疫苗通常以重组纯化蛋白或多肽为基础,在生物安全方面明显优于传统疫苗,但免疫原性稍有不足。综上所述,免疫增强剂CVC1302和O型FMDVBLP 疫苗联合使用能够显著增强机体的体液和细胞免疫反应,为我国FMD 的清除提供新的思路,为FMD 亚单位疫苗的发展提供新的借鉴。
