昆虫细胞-杆状病毒系统分泌表达的猪瘟病毒E2 蛋白及其免疫原性研究
2020-07-02王遵宝李俊辉豆智华李森江
王遵宝,贺 笋,李俊辉,刘 宏,豆智华,郑 侃,李森江,寇 春
(天康生物股份有限公司,新疆 乌鲁木齐 830032)
猪瘟是由猪瘟病毒(Classical swine fever virus,CSFV)引起的猪的一种急性、热性、高度接触性烈性传染病,给中国和其他许多国家养猪业造成重大经济损失。虽然中国利用自行研制的猪瘟兔化弱毒疫苗进行强制免疫,有效控制了猪瘟的大规模流行,但猪瘟仍在中国部分地区呈散发、周期性流行。近年来的研究结果表明,CSFV 基因2 群已取代1 群,成为我国猪瘟流行的优势基因群,临床中以慢性、非典型性猪瘟为主要表现形式,对养猪业的健康发展造成极为严重的危害[1-4]。Luo 等报道在华东地区温和型猪瘟散发的猪场分离获得了2.1d 亚型CSFV,攻毒结果表明猪瘟活疫苗对该株病毒只能提供临床保护,经病理解剖及免疫组化分析证实免疫猪存在组织损伤,荧光定量PCR(RT-qPCR)结果显示免疫猪攻毒后存在排毒和带毒情况,提示猪瘟活疫苗不能完全抵抗2.1d 亚型CSFV 对猪的攻击[5]。 此外,由于猪瘟兔化弱毒疫苗在制造时易受BVDV、支原体、圆环病毒等血清外源病原污染,且在临床使用过程中受母源抗体干扰较大,无法克服免疫耐受等问题,而且使用猪瘟活疫苗免疫后,无法用血清学方法快速鉴别疫苗免疫和CSFV 野毒感染的猪,是我国猪瘟净化面临的关键科学难题[6-7]。因此有必要研制保护谱广、安全、可靠,不会与野毒发生重组变异、可进行鉴别诊断的新型标记猪瘟疫苗。研究表明,CSFV E2 蛋白位于病毒的囊膜表面,参与病毒的感染过程,是CSFV 的主要保护性抗原蛋白之一,能诱导机体产生中和抗体[8]。为研制、开发对不同亚群CSFV 均有保护力的猪瘟E2 亚单位疫苗,本研究以猪瘟兔化弱毒株(Hog cholera lapinized virus,HCLV)的E2 基因为基础,参考近年来国内CSFV 流行株的E2 基因序列,并根据昆虫细胞密码子偏嗜性、简并性对其进行优化,使其与CSFV 基因1、2群病毒株的E2 基因编码的氨基酸同源性最高,以提高E2 蛋白对不同亚群病毒株的交叉保护性。经基因合成、构建重组转移载体及穿梭载体,最终将E2 基因转染至杆状病毒中,获得了CSFV E2 重组蛋白(Bac-E2),并利用猪瘟抗体阴性猪评价了该蛋白的免疫原性及保护效力,为猪瘟亚单位疫苗的开发奠定了基础。
1 材料与方法
1.1 主要实验材料 优化的CSFV E2 基因序列由上海英骏生物技术有限公司合成;SF9 细胞、High Five 细胞、PK-15 细胞、HCLV 细胞适应株、猪瘟活疫苗(传代细胞源)等均由天康生物股份有限公司传代、保存和提供;CSFV 石门强毒株、猪瘟阳性血清购自中国兽医药品监察所菌毒种保存保藏中心。
pFastBac1 载 体、DH5s、DH10Bac 感 受 态 细 胞、Cellfectin 转染试剂盒等均购自美国Invitrogen 公司;Mini BEST Viral RNA/DNA Extraction Kit、ExTaq DNA聚合酶、PCR Mix、Xho I、EcoR I 内切酶等均购自宝生物(大连)工程有限公司;兔抗猪IgG-HRP、兔抗猪IgG-FITC 均购自Sigma 公司;His TrapTMHP 预装柱购自GE 公司;ISA 660VG 佐剂购自法国赛彼科公司。4 周龄~5 周龄CSFV 中和抗体阴性猪,购自新疆天康畜牧科技有限公司。
1.2 重组转移质粒pFast-E2 的构建及鉴定 以HCLV 为基础,同时参考近年来国内CSFV 流行株的E2 基因序列,根据昆虫细胞密码子偏嗜性对其进行优化和修饰,并在其N 端引入保护碱基、酶切位点、包含ATG 的Kozak 转录起始序列及6-His Tag后,由上海英俊生物技术有限公司合成。将人工合成的E2 基因序列经EcoR I、Xho I 双酶切后克隆至转移载体pFastBac1 中构建重组质粒pFast-E2,并经测序鉴定。将其进一步转化至含有穿梭杆粒的DHl0Bac 感受态细胞,经PCR 鉴定获得重组杆粒Bac⁃mid-E2。参考Cellfectin 转染试剂盒说明书,将其转染于生长状态良好的SF9 细胞,27 ℃恒温培养72 h~96 h 待细胞出现病变后,收集上清,提取核酸进行PCR 扩增并测序鉴定,将其作为第一代重组杆状病毒,记为P1,命名为:Rb-E2。以10%接种比例分别在SF9细胞中盲传、扩增,至P5代时收集上清用于后续试验及检测。重组病毒的PCR 鉴定引物序列如下:E2-F1:5'-CACCATGGCATTTCTCATCTGCTTGGT A-3'/E2-R1:5'-AAATTCTGCGAAGTAATCTGAGTG-3'
1.3 重组杆状病毒的间接免疫荧光试验(IFA)鉴定将1.2 收获的重组杆状病毒P5 代,10 倍倍比稀释后接种于96 孔板中生长状态良好的SF9 细胞,以不接种病毒的SF9 细胞作为阴性对照,7 d 后用4%甲醛固定,以猪瘟阳性血清(1∶500)为一抗,兔抗猪IgG-FITC(1∶5 000)为 二 抗 经IFA 鉴 定 重 组 病 毒Rb-E2 及检测重组E2 蛋白(Bac-E2)的表达,根据Reed-Muench 法计算重组病毒病毒含量[9]。
1.4 重组蛋白的western blot 鉴定重组病毒 将1.2收获的重组杆状病毒P5 代,根据病毒含量测定结果,以MOI 2 接种生长良好的High Five 悬浮细胞,27 ℃恒温培养,在接种病毒后60 h、72 h、84 h、96 h,分别取细胞上清样,进行SDS-PAGE 检测。以猪瘟阳性血清(1∶500)为一抗,兔抗猪IgG-HRP(1∶5 000)为二抗,经western blot 鉴定重组病毒及Bac-E2 蛋白的表达,通过SDS-PAGE 电泳后经灰光度值法测定表达的Bac-E2 蛋白的浓度。
1.5 重组Bac-E2 的免疫效力评价
1.5.1 动物实验设计 用摇瓶培养High Five 悬浮细胞,接种Rb-E2,大量制备抗原;接种病毒后96 h,离心取上清,用镍亲和层析法纯化Bac-E2 蛋白。将Bac-E2 蛋白与ISA 660VG 佐剂等质量混合后乳化免疫猪,以健康High Five 细胞上清液乳化制剂免疫的猪为阴性对照,同时以猪瘟活疫苗(HCLV,传代细胞源)免疫的猪作为阳性对照。参照《猪瘟活疫苗(兔源)质量标准》附注中“猪瘟病毒中和试验方法”筛选4 周龄~5 周龄猪瘟抗体阴性猪15 头,动物分组及免疫方案见表1[10]。
1.5.2 各组猪中和抗体的测定 首免后每周采血,连续5 次,无菌分离血清;将待测血清样品置56 ℃水浴槽中灭活30 min;用MEM 培养基连续2 倍倍比(1∶4~1∶4 096),取50 μL 加入96 孔板,每个浓度设8 个重复孔;在每孔中加入HCLV(200 TCID50/50 μL/孔),以MEM 培养基为阴性对照,猪瘟阳性血清作为阳性对照,37 ℃中和1 h。另取一个96 孔板进行病毒含量的回归滴定,每孔加入50 μL MEM,将稀释的HCLV(200 TCID50/50 μL)连续2 倍倍比(1∶4~1∶4 096),以MEM 培养基作为阴性对照。在以上两块96 孔板的每孔加入密度为105个/mL 的PK-15 细胞悬液100 μL,37 ℃、5%CO2培养3 d 后,用甲醛固定,以猪瘟阳性血清(1∶500)为一抗,兔抗猪IgG-FITC(1∶5 000)为二抗,在倒置荧光显微镜观察荧光,以Reed-Muench 法计算各组猪血清的中和抗体滴度和病毒含量。回归滴定的病毒含量在50 TCID50/50 μL~300 TCID50/50 μL 时所稀释的病毒符合检验要求,判定的血清中和抗体成立。
1.5.3 免疫效力试验 Bac-E2 组、HCLV 组和阴性对照组猪均在首免后35 d,经耳后颈部肌肉注射CSFV 石门强毒(105.0最小致死剂量/头,即105.0MLD/头),攻毒后连续观察16 d,每天测温、记录各组猪的发病和死亡情况,死亡猪剖检后观察各组织的病变情况,并计算免疫组的保护率。攻毒后每4 d 采集各组猪的咽拭子及肛拭子,冻存于-80 ℃冰箱,常规处理后提取病毒核酸,反转录成cDNA 后,采用RT-qPCR 检测各组猪排毒情况[11]。
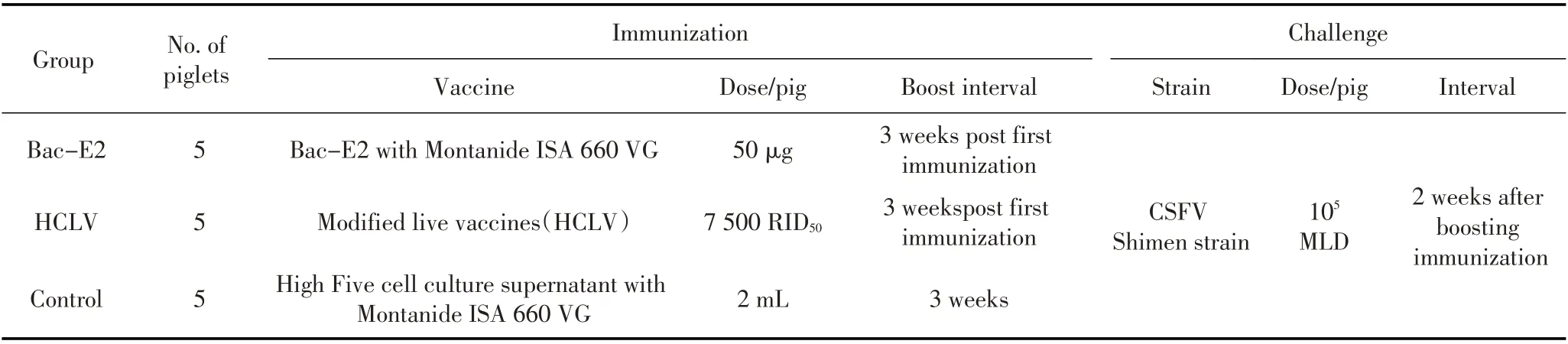
表1 实验设计Table 1 The experimental design
2 结 果
2.1 重组杆状病毒的PCR 鉴定结果 构建的重组质粒pFast-E2 经测序结果显示,该E2 基因与HCLV的亲缘关系较近,同源性达95.2%,同属于1.1 亚群。pFast-E2 转化至含有穿梭杆粒的DHl0Bac 感受态细胞,构建重组杆粒Bacmid-E2,经PCR 鉴定正确后转染SF9 细胞,96 h 后取病变细胞上清液,提取核酸后经PCR 鉴定,结果显示扩增得到约1 100 bp 的目的片段(图1),测序结果显示E2 基因序列正确。表明获得了携带E2 基因的重组杆状病毒将其命名为Rb-E2。
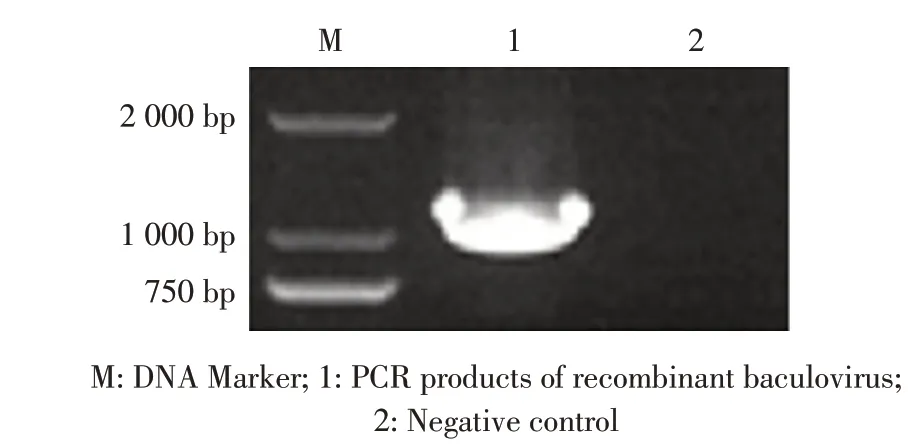
图1 重组杆状病毒的PCR 鉴定Fig.1 Amplification of E2 gene by PCR from recombinant baculovirus
2.2 重组杆状病毒的IFA 鉴定结果 将P5 代重组杆状病毒以10 倍倍比稀释后接种SF9 细胞,7 d 后进行IFA 鉴定。结果显示,感染病毒的细胞可观察到特异的绿色荧光,而阴性对照则未出现荧光(图2),表明获得了重组杆状病毒,且杆状病毒中的CSFV E2 基因能够在昆虫细胞中获得正确表达。根据Reed-Muench 方法计算重组杆状病毒滴度为107.8TCID50/mL。
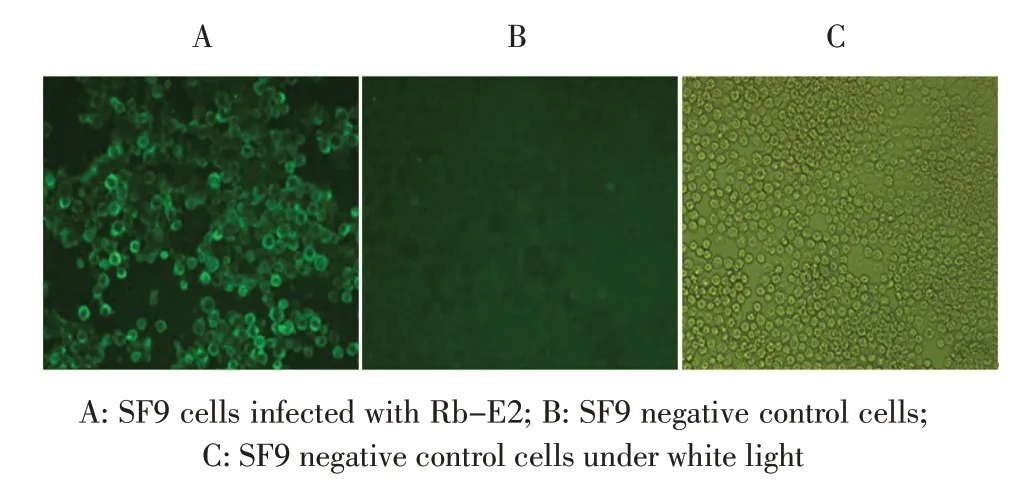
图2 重组杆状病毒Rb-E2 的IFA 鉴定结果(×200)Fig.2 Identification of Rb-E2 in SF9 cell by IFA(×200)
2.3 重组杆状病毒的western blot 鉴定结果 将P5代Rb-E2 接种生长良好的High Five 悬浮细胞,收获的上清液经western blot 鉴定。结果显示,经杆状病毒感染60 h 的细胞即可出现大小为52 ku 的目的蛋白条带;接种杆状病毒后96 h,上清液中Bac-E2 含量最高(图3),经SDS-PAGE 电泳后采用灰光度值法测定蛋白浓度可达50 μg/mL,表明获得了能够表达CSFV E2 蛋白的重组杆状病毒Rb-E2,表达的Bac-E2主要存在于细胞上清液中,且具有良好的反应原性。
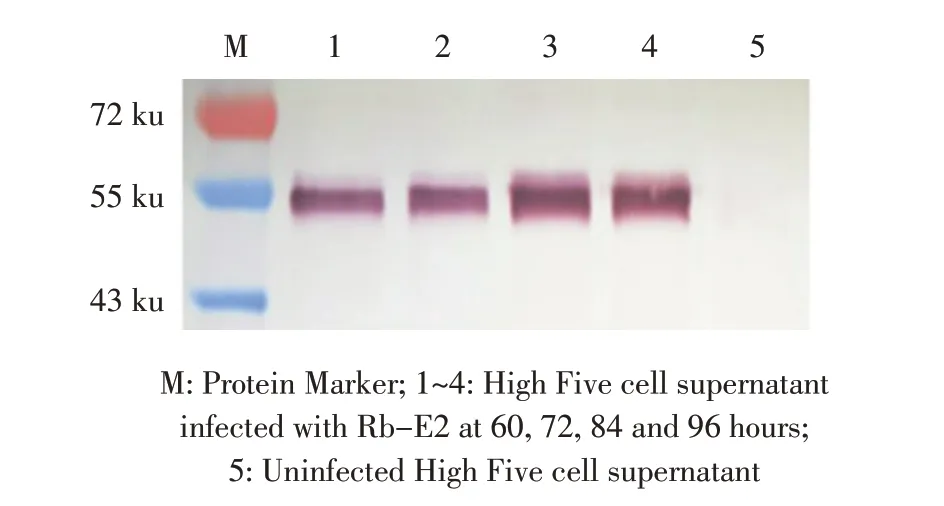
图3 重组杆状病毒E2 蛋白表达的western blot 鉴定结果Fig.3 Identification of the recombinant E2 protein by western blot in Rb-E2
2.4 Bac-E2 的免疫效力评价
2.4.1 各组猪中和抗体的测定结果 将重组蛋白Bac-E2 乳化后免疫猪,同时设阳性对照组和阴性对照组,首免后每周测定各组猪血清的中和抗体。结果显示,免疫前各组猪中和抗体效价均小于1∶4(以1∶4 统计),Bac-E2 组首免后2 周,5 头猪中3 头猪的中和抗体效价不低于1∶32,首免后3 周,5 头猪血清中和抗体效价均不低于1∶64,首免后5 周(加强免疫后2 周)该组猪中和抗体效价均不低于1∶1 024;HCLV 组猪首免后3 周中和抗体效价介于1∶11~1∶22,首免后5 周(加强免疫后2 周)中和抗体效价提高至1∶64~1∶128。采用t 检验比较了两个免疫组的抗体水平,首免后5 周两组猪中和抗体效价差异极显著(p<0.01);阴性对照组猪血清中和抗体效价始终小于1∶4(图4)。表明Bac-E2 能够诱导猪产生高水平的猪瘟中和抗体。
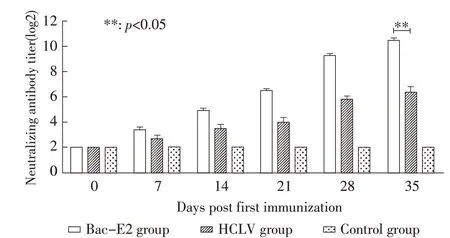
图4 各组猪血清中和抗体效价的测定结果Fig.4 The titers of neutralizing antibody against CSFV in immuned pigs
2.4.2 攻毒试验结果 首免后35 d 经CSFV 石门强毒攻击后,在16 d 的观察期内,Bac-E2 组、HCLV组猪的体温正常、无发病、无死亡,保护率为100%;阴性对照组猪呈高热稽留、畏寒怕冷,食欲不振最终废绝,便秘与腹泻交替发生,并伴有体表出血、结膜炎等典型猪瘟临床症状,在攻毒后12 d内全部发病死亡(图5),剖检可见扁桃体溃疡、脾脏边缘梗死、淋巴结切面呈大理石样花纹,肾脏表面有大量出血点,呈现典型“雀斑肾”病理变化。
各组猪攻毒后的拭子中CSFV 的排毒检测结果显示,Bac-E2组、HCLV组猪攻毒后0~16 d的咽拭子及肛拭子中均未检测到CSFV 核酸。对照组猪攻毒后第4 d即可在其咽拭子中检出CSFV 核酸,平均为2.31×103拷贝/μL,肛拭子中病毒核酸为3.25×103拷贝/μL,此后拭子中病毒核酸拷贝数逐渐升高,至攻毒后第12 d 时咽拭子中病毒核酸可达1.038×104拷贝/μL;肛拭子中病毒核酸可达1.15×104拷贝/μL(表2)。以上结果表明,Bac-E2 能够有效抵御CSFV 石门强毒的攻击,与HCLV 组免疫效力相当,可以作为猪瘟E2 亚单位疫苗的候选抗原蛋白。
图5 攻毒后各组猪的存活情况Fig.5 Survival curve of pigs at 0-16 days post challenge with CSFV Shimen strain
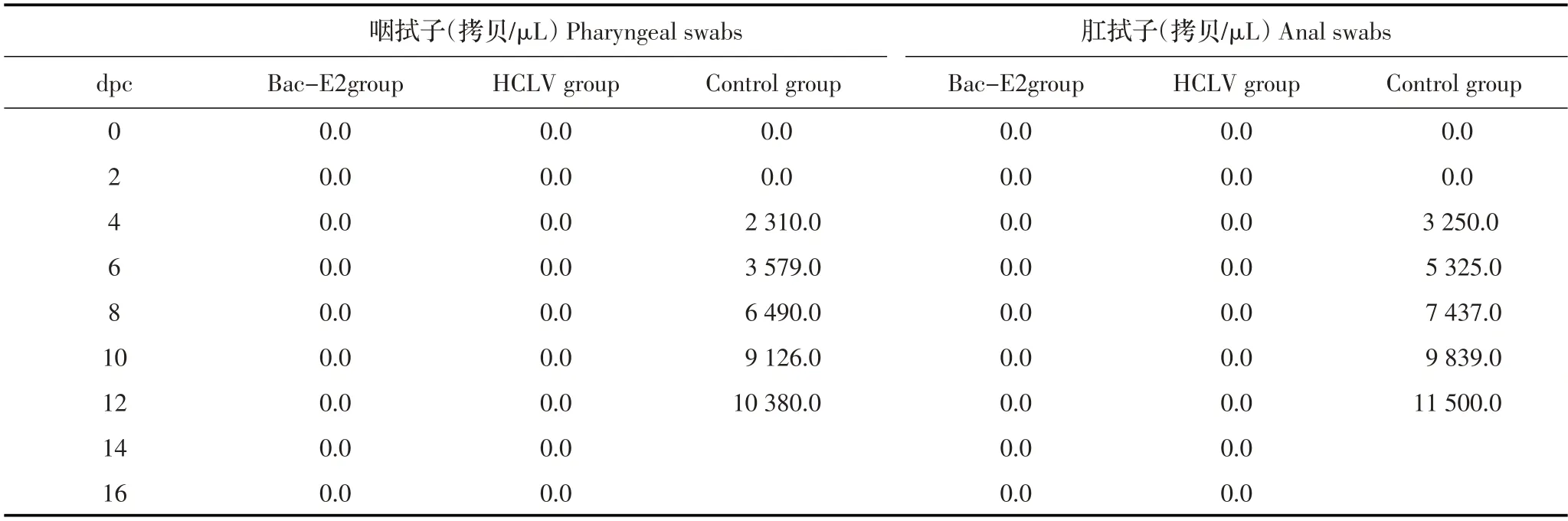
表2 攻毒后各组猪咽拭子、肛拭子排毒量检测结果(平均拷贝数/μL)Table 2 Viral loads of challenged swine in pharyngeal and anal swabs(Mean copies/μL)
3 讨 论
疫苗接种是控制猪瘟的重要手段,其包括灭活疫苗、亚单位疫苗和弱毒疫苗。我国长期坚持采用全面接种猪瘟兔化弱毒疫苗来防控猪瘟,但目前猪瘟在我国依然存在,而且流行株由基因1 群演变为基因2 群,流行特点也从以往的频发大面积流行转变为无规律区域性的散发,隐性持续性感染病例增多,大部分猪场不得不加强疫苗免疫剂量及次数、采用超前免疫的方式防控猪瘟。此外,猪瘟弱毒疫苗在制造时易受BVDV、支原体、圆环病毒等血清外源病原污染,而且在临床使用过程中受母源抗体干扰较大,无法克服免疫耐受、区分野毒感染与疫苗免疫等问题,阻碍了中国猪瘟的净化,因此市场上亟待能够更有效防控并净化猪瘟的疫苗产品。 昆虫细胞-杆状病毒表达系统可高效表达外源基因,并可对外源蛋白进行转录后糖基化、磷酸化等加工过程,最终获得与天然蛋白功能相似的可溶性重组蛋白,显著优于细菌、酵母表达体系[12]。季新成等将CSFV E2 基因克隆到杆状病毒中,经SDS-PAGE、western blot 等方法证明该基因在昆虫细胞中正确表达,能够与猪瘟阳性血清发生特异性反应,但表达量较低[13]。本研究所选的E2 基因去除了跨膜区,保留了信号肽序列,获得了在上清中正确表达的重组E2 蛋白,表达量显著提高。胡刚叶等构建了两株含HCLV E2 基因的重组杆状病毒,并在蚕蛹血淋巴中获得了重组E2 蛋白,但制备工艺不适合工业化放大生产,而且未见免疫原性研究报道[14]。本研究利用悬浮培养的High Five 昆虫细胞接种重组杆状病毒进行E2 蛋白表达,生产工艺易于放大,适合工业化生产。 孙元等用腺病毒表达了重组E2 蛋白,免疫家兔和猪后均能产生猪瘟特异性抗体,并进行了靶动物的攻毒试验,攻毒后rAdV-E2 免疫猪抗体迅速升高,除了一头猪短期体温升高外,未出现任何其它临床症状[15]。本研究制备获得的Bac-E2 蛋白免疫猪后,在攻毒前其中和抗体已不低于1∶1 024,利用CSFV 石门强毒攻毒后5 头猪体温均未升高,未见异常临床症状,表明Bac-E2 蛋白的免疫原性较好。
高莹以CSFV 石门强毒的E2 基因为基础构建了3 种重组杆状病毒,可诱导仔猪产生高水平中和抗体,但未见其对基因2 群病毒的交叉保护性研究的报道[16]。本研究根据昆虫细胞密码子偏嗜性、简并性对E2 基因序列进行优化,使其与CSFV 基因1、2群病毒的E2 基因编码的氨基酸同源性最高,以提高E2 蛋白对不同亚群病毒株的交叉保护性。本实验结果表明,BAC-E2 免疫动物后可以诱导猪产生高水平的猪瘟特异性中和抗体,能够有效抵御CSFV 石门强毒的攻击,后期将采用CSFV 基因2 群流行株进行免疫攻毒试验,确定该蛋白对CSFV 2.1b、2.1c、2.1d 等亚群的广谱保护力。本研究制备的Bac-E2 可以作为猪瘟E2 亚单位疫苗的候选抗原蛋白,为猪瘟E2 亚单位疫苗的研制提供了实验依据。为了稳定并进一步提升Bac-E2 蛋白产量,后期拟对重组杆状病毒进行连续传代稳定性测试,同时建立生物反应器全悬浮培养昆虫细胞的生产工艺,促进该产品向大生产转化。
