PIK3CG在大动脉粥样硬化型脑梗死患者体内表达及临床意义
2020-07-02殷桐丁希艳王朝辉
殷桐 丁希艳 王朝辉
(1北华大学,吉林 吉林 132013;2北华大学附属医院神经内科)
脑血管病在全球死因中居第二位〔1〕,近年在中国已跃升为首要死因〔2〕。缺血性脑卒中(即脑梗死)是脑卒中最常见的类型,占70%~80%。根据中国缺血性脑卒中亚型-CISS分型将脑梗死按病因的不同分为五型:大动脉粥样硬化、心源性脑卒中、穿支动脉疾病、其他病因、病因不确定。其中以大动脉粥样硬化型脑梗死为最常见的类型。动脉粥样硬化(AS)形成受到各种因素的影响,目前学说众多,包括血管内皮损伤学说,脂质学说、炎症学说、感染学说等等。而磷酸肌醇3-激酶(PI3K) 家族直接影响AS的发生发展〔3,4〕。PI3K催化亚基G肽(PIK3CG)基因编码属于pI3/pI4激酶家族的蛋白质。它是细胞外信号的重要调节剂,其在维持上皮细胞的结构和功能完整性中起重要作用〔5〕。PIK3CG在炎症反应的不同病理生理学背景中也有重要作用。Fougerat等〔6〕研究表明PIK3CG参与AS的形成,但目前尚无其与大动脉动脉硬化型脑梗死的相关性研究,因此本研究分析PIK3CG在大动脉粥样硬化型脑梗死患者体内的表达及其在诊断中的价值。
1 材料与方法
1.1临床资料 病例组:随机选取2018年10月至2019年12月就诊于北华大学附属医院神经内科并确诊为大动脉粥样硬化型脑梗死(符合2010年中国缺血性脑卒中亚型-CISS分型的诊断标准)患者180例;对照组:同期随机选取健康体检者129例。病例组与对照组性别、年龄、身高、体重指数、吸烟史、饮酒史均无统计学差异(P>0.05),见表1。
根据合并疾病情况将病例组分为4个亚组:单纯大动脉粥样硬化型脑梗死组(31例)、单纯合并糖尿病组(31例)、单纯合并高血压组(33例)、单纯合并高脂血症组(33例)。记录受检者性别、年龄、身高、体重指数、吸烟史、饮酒史、高血压病史、糖尿病病史、高脂血症病史及超声影像学等资料。排除标准:①可以引起急性多发梗死灶的其他病因如血管炎、血凝异常及肿瘤性栓塞的证据;②心源性脑卒中;③脑出血;④CT、磁共振成像(MRI)检查禁忌证的患者。
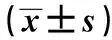
表1 两组一般资料比较
1.2仪器与试剂 PIK3CG酶联免疫试剂盒购自上海朗顿生物有限公司;标准规格酶标仪采用Tecan Austria GmbH 5082 Grödig,奥地利。
1.3检测方法 患者均从肘正中静脉抽取静脉血2 ml置于3.5 ml血清管(Z)中,室温下血液自然凝固10~20 min,离心2 500 r/min,20 min左右。将PIK3CG酶联免疫试剂盒从-20℃冰箱中取出在室温下平衡0.5 h。具体操作步骤如下:①空白孔不加样,只加显色剂 A,B 和终止液用于调零;②标准品孔:每孔加入稀释好的标准品50 μl,零孔加入标准品/样品稀释液50 μl,然后加入生物素抗原工作液50 μl; ③样品孔:加入样品50 μl,然后加入生物素抗原工作液50 μl;④轻轻摇晃,盖上封板膜,37℃培养箱中孵育30 min;⑤ 将25倍浓缩洗涤液用蒸馏水25倍稀释后备用;⑥第一次洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干;⑦ 加入50 μl亲和素-辣根过氧化物酶(HRP)到标准品孔和样品孔中,轻轻摇晃,盖上封板膜,37℃培养箱中孵育30 min;⑧第二次洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干;⑨显色:每孔先加入显色剂A 50 μl,再加入显色剂B 50 μl,轻轻震荡混匀,37℃避光显色10 min;⑩终止:每孔加终止液50 μl,终止反应;测定:以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值)。测定应在加终止液后10 min以内进行。
1.4统计学方法 采用SPSS20.0统计软件进行t检验、χ2检验及多因素Logistic回归分析。
2 结 果
2.1PIK3CG的体内表达水平 病例组与对照组PIK3CG值差异显著(P<0.001)。单纯合并糖尿病组、单纯合并高血压组、单纯合并高脂血症组分别与单纯大动脉粥样硬化型脑梗死组比较,PIK3CG值差异均具有显著性(P<0.05),见表2。
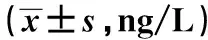
表2 各组PIK3CG体内表达水平
与对照组比较:1)P<0.001;与单纯大动脉粥样硬化型脑梗死组比较:2)P<0.05
2.2回归分析结果 与单纯大动脉粥样硬化型脑梗死组OR值比较,单纯合并糖尿病组是其2.48倍,单纯合并高血压组是其1.44倍,单纯合并高脂血症组是其1.54倍。提示合并糖尿病、高血压、高脂血症可增加正相关风险系数,尤以合并糖尿病风险系数较大,见表3。
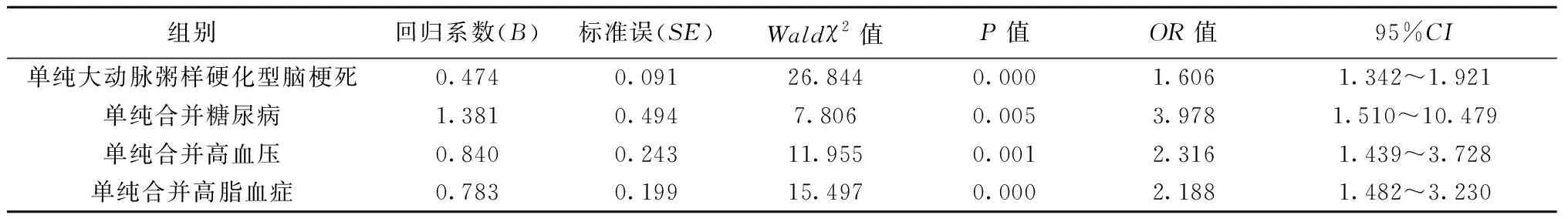
表3 回归分析结果
3 讨 论
AS形成的过程较为复杂,各种刺激因素(如机械性、高胆固醇血症、吸烟、毒素、病毒)均可造成不同程度的内皮细胞损伤,使其通透性增加、细胞变性坏死脱落;内皮细胞屏障受损,可使血浆脂蛋白过量地融入细胞壁,同时会引起血小板黏附、聚集、释放各种活性物质,进而加重内皮细胞损伤。血管内皮细胞损伤是AS公认的始动环节。而AS是脑梗死最主要的病理学基础。可见,内皮功能障碍在脑梗死发病机制中起重要作用〔7〕。AS也是一种慢性炎症性血管疾病。研究显示,氧化低密度脂蛋白(ox-LDL)通过调控核因子(NF)-κB/肿瘤坏死因子(TNF)-α信号通路等诱导的炎症反应是导致血管内皮损伤的重要机制〔7~9〕。可见,炎症因子也参与其中。
根据主要底物特异性的不同将PI3K分为3个类型,即Ⅰ型、Ⅱ型、Ⅲ型。Ⅰ型PI3K进一步分为亚型ⅠA和ⅠB。PIK3CG隶属于ⅠB型。PIK3CG是内膜增生形成的关键参与者。本文提示,PIK3CG通过血管损伤进而炎症刺激对血管内皮产生影响,从而使其在大动脉粥样硬化型脑梗死患者中呈高表达状态。
Jin等〔10〕研究结果首次直接证明PIK3CG在缺血/再灌注诱导的血脑屏障破坏和脑损伤中起重要作用。在Ⅰ型PI3K中,PIK3CG是炎症和氧化反应的关键调节剂,并且涉及许多炎性疾病,其中包括AS。人AS病变的组织学表征显示PIK3CG的表达使病变中渗入的免疫细胞增加,如巨噬细胞和T淋巴细胞。并且对PIK3CG有以下重要发现:免疫细胞中缺乏PIK3CG的表达可减少对AS斑块的浸润,减少病变大小并促进小鼠模型中斑块稳定。Fougerat等〔6〕用特异性PIK3CG抑制剂治疗小鼠免疫系统中PIK3CG的缺失,可以通过预防血管壁中发生的炎症过程来减少AS。并确定PIK3CG是新生内膜形成过程中急性炎症血管事件的重要介质。这些研究表明PIK3CG可能在内膜增生发展中起重要作用。Carnevale等〔11〕研究表明,PIK3CG抑制剂通过对阻力血管的平滑肌发挥松弛作用来降低动脉血压。抑制PIK3CG可能是调节血管平滑肌细胞内钙流入的新工具,从而放松阻力动脉和降低血压。这一机制被证明与抗高血压治疗的功效相关。Kächele等〔12〕研究指出,下丘脑-垂体-肾上腺轴的过度活化,PI3K抑制剂的使用可以恢复糖尿病相关损伤。编码PIK3CG对2型糖尿病风险增加的个体的炎症特征和炎症相关代谢特征有影响。另也有文章指出〔13〕,PIK3CG在饮食诱导的肥胖、脂肪肝、炎症和胰岛素抵抗中有重要作用。
综上,PIK3CG可能是大动脉粥样硬化型脑梗死发生的预警指标,有效控制糖尿病、高血压、高脂血症等合并疾病可能是降低PIK3CG表达的辅助因素。
