七氟烷对小胶质细胞线粒体自噬与活化的影响
2020-07-02何诗朗邓杰黄雪麟阮祥才
何诗朗 邓杰 黄雪麟 阮祥才,
1华南理工大学医学院附属第二医院(广州市第一人民医院)麻醉科(广州510180);2广州医科大学附属市第一人民医院麻醉科(广州510180)
七氟烷广泛运用在临床麻醉工作中,临床试验数据表明全麻药在儿科手术中对大脑发育不利,尤其是在脑发育的爆发[1-2]。2016年美国食品药品管理局(FDA)称3 岁以下的幼儿多次反复接触到麻醉药会诱发成年后的学习能力方面的风险[3-4]。七氟烷在临床上使用的范围广泛,其效价强度可用肺泡最低有效浓度(MAC)来衡。在临床试验中会使用1.0 MAC、1.3 MAC、1.6 MAC 的七氟烷进行全麻手术的麻醉[5]。在研究七氟烷这种常用麻醉剂在麻醉诱导和麻醉后恢复期是否会改变小鼠的运动中,会使用1 MAC、1.5 MAC、2 MAC 的七氟烷麻醉小鼠[6];在研究七氟烷导致发育期小鼠发生记忆障碍中,使用2.6%七氟烷或1.3%七氟烷处理C57BL/6 乳鼠[7];有研究表明浓度为1.1%即1 MAC 氟烷抑制了WDR 神经元对两种有害(热、机械)和非有害刺激的反应[8];在LU 等[9]处理细胞时,用4.1%即2 MAC 的七氟烷处理神经元或突触体;3.3%七氟烷处理小胶质细胞30 min 减少脂多糖(Lipopolysaccharides,LPS)诱导的小胶质细胞迁移,降低促炎细胞因子的产生,降低了小胶质细胞的活化[10]。对于非小细胞肺腺癌(A549)和肾细胞癌(RCC4)细胞选择暴露于3.6%七氟烷2 h 检测对不同肿瘤类型的转移潜能和化学敏感性[11]。在研究七氟烷突触后电流的影响时,1 MAC 浓度七氟烷处理时,多能干细胞的衰变时间显著延长,在1.5 MAC 当量时多能干细胞的振幅和频率下降[12]。根据前人研究,七氟烷在临床、动物以及细胞使用的浓度多为1 ~2 MAC 之间且结合临床上常用的七氟烷浓度即1.3 MAC,因此拟选择1.3 MAC 七氟烷浓度作为本研究中的七氟烷浓度是比较合适。
线粒体主要功能是产生三磷酸腺苷(ATP),线粒体自噬在很多疾病中都扮演了很重要的角色,有证据[13]显示线粒体损伤与大脑缺血/再灌注后的神经功能评分下降有关;有研究显示线粒体自噬通过抑制海马区NLRP3 炎性小体的激活来改善七氟烷诱导的术后认知障碍[14];THANGARAJ等[15]研究发现线粒体功能障碍和线粒体自噬缺陷诱发HIV-1 TaT 处理的小胶质细胞激活。若线粒体自噬功能不足,受损的线粒体累积可导致产生过量的ROS,参与小胶质细胞活化过程[16-17]。
大脑中小胶质细胞在大脑发育过程中起重要的作用[18],中枢神经系统中的小胶质细胞通常保持静止状态。七氟烷(2%vol)连续镇静大鼠12 h,检测细胞因子诱导的中性粒细胞趋化蛋白-1、单核细胞趋化蛋白-1、白介素-6(IL-6)等全身炎症标志物,用Iba-1 激活小胶质细胞,来评估大脑中的细胞反应,在脂多糖(LPS)诱导的炎症模型中,挥发性麻醉药七氟烷并没有使模型神经炎症的衰减[19]。中枢神经系统(CNS)中涉及小胶质细胞的神经炎症,LPS 诱导小胶质细胞产生炎症反应,增加促炎细胞因子的表达和分泌,如TNF-α、IL-1β、IL-6[20]。用2%七氟烷在妊娠15 d 处理孕鼠3 h,能诱导IL-6 mRNA 表达增加,其影响可能会对神经元发育产生长期影响[21]。但也有研究表示暴露于七氟烷麻醉8 h,不能激活小胶质细胞[22]。以往研究发现气体麻醉剂七氟烷通过下调海马中的PPAR-γ来加重小胶质细胞介导的神经炎症,从而加重慢性间歇性缺氧大鼠模型的认知功能下降[23]。七氟烷对小胶质细胞的作用,促进或抑制其活化,仍存在争议,小胶质细胞的激活在众多疾病包括神经炎症及学习记忆等认知功能障碍中扮演重要角色,临床上常用的七氟烷浓度能否使小胶质细胞激活以及小胶质细胞中的线粒体损伤在小儿手术中麻醉药的毒性作用很值得关注。笔者推测在七氟烷诱导颅内炎症中,特别是七氟烷在幼儿多次接触的过程中体现出的神经毒性作用,很有可能是因为小胶质细胞内线粒体自噬的缺陷引发损伤的线粒体清除不足而使小胶质激活,从而引起颅内炎症。本研究旨在观察在临床使用浓度范围内七氟烷对、小鼠小胶质细胞的线粒体状态以及自噬情况,揭示如幼儿麻醉出现神经毒性作用等临床问题的原因,从而为吸入麻醉药物的合理使用提供实验依据。
1 材料与方法
1.1 BV-2 小胶质细胞培养及分组小鼠来源的BV-2 小胶质细胞获赠于中山大学孙逸仙纪念医院麻醉科实验室。收集并计数处于对数生长期的BV-2 细胞后以1 × 104个/孔接种至6 孔板培养,在培养箱使用含10%胎牛血清及1%双抗的杜尔伯科改良伊格尔(DMEM)高糖培养基中培养孵育24 h,待细胞密度到85%左右时,分为不加七氟烷和七氟烷暴露组:按照预实验确定的给药浓度和时间,BV-2 小胶质细胞在2.6%~2.8%七氟烷中暴露4 h 为七氟烷组,不暴露在七氟烷中的BV-2 小胶质细胞为对照组。
1.2 原代小鼠小胶质细胞的提取按THANGARAJ等[15]的提取方法取出生第0-1 天的C57BL/6j 乳鼠的大脑,放在冰冷的磷酸缓冲盐溶液(PBS)溶液中剥除脑膜干净,把脑组织放到有3 mL DMEM 培养基中剪碎吹打至浑浊液,用40 μm 孔径的滤网过滤后接种到T75培养皿瓶。48 h后加入25 ng/mL粒细胞-巨噬细胞集落刺激因子(GM-CSF)刺激小胶质细胞增殖,第10 天即可收半贴壁且透亮的原代小鼠小胶质细胞。在第1次收获小胶质细胞后可每隔2天再收获1次,最多收获3次。每次收获细胞后直接进行细胞计数后按实验需求铺于孔板上。
1.3 实验方法
1.3.1 线粒体膜电位检测七氟烷对小胶质细胞线粒体膜电位的影响,使用JC-1线粒体膜电位测定试剂盒检测。把BV-2 小胶质细胞置于24 孔板中,密度为每孔1×105个细胞。计算并取出实验需要JC-1染色工作,在细胞经过或无七氟烷暴露实验处理完后吸除培养液,每孔加入JC-1 染色工作液250 μL,并使之充分混匀分布在待测孔中。37 ℃细胞培养箱中孵育20 min。在此孵育期间,计算并配制适量的JC-1 染色缓冲液,并放置于冰上或4 ℃冰箱。37 ℃孵育结束后,吸除工作液,用JC-1 染色缓冲液避光洗涤3次至干净。加入DMEM培养液用荧光酶标仪检测线粒体的荧光强度JC-1单体(激发光为485 nm;发射光为535 nm)和聚集体(激发光为550 nm;发射光为600 nm)。所有实验重复3次。
1.3.2 CCK-8 法细胞活力测试收集细胞计数后把小胶质细胞置于24 孔板中,密度为每个孔1 ×105个细胞。分别取100 μL 到96 孔板中培养,每组设3个复孔,培养过夜贴壁,在细胞经过或无七氟烷暴露实验处理完后吸净细胞上清液并用适量PBS洗涤2 次,CCK-8 和无血清DMEM 培养基按1∶10 体积比混合成检测液并混匀,取100 μL 加入待测孔中,37 ℃、5%CO2的培养箱孵育1 h;用酶标仪检测450 nm波长下的吸光度值并记录。实验重复3 次。
1.3.3 免疫荧光实验原代小鼠小胶质细胞接种第2 天后,待细胞在盖玻片上伸出伪足时,自培养箱中取出,多聚甲醛固定10 min,放置PBS(pH7.4)中在脱色摇床上晃动洗涤3 次,每次5 min,滴加BSA,封闭30 min 后滴加按一定比例配好的Iba1 一抗后放于湿盒内4 ℃冰箱孵育过夜,次日洗涤3次,稍甩干后滴加与一抗相应种属的555 标记二抗覆盖玻片,避光室温孵育50 min。DAPI 复染细胞核,避光室温孵育10 min 后洗涤,用抗荧光淬灭封片剂封片。于荧光显微镜下观察并采集图像。
1.3.4 ELISA 酶联免疫吸附测定用酶联免疫吸附测定七氟烷激活小胶质细胞,在酶标包被板上准确加七氟烷组和对照组组细胞上清液50 μL 后放置于37 ℃中温育30 min。弃去液体,每孔加满洗涤液,摇晃洗涤30 s 后弃去,重复5 次,拍干。每孔加入酶标试剂50 μL,后温育、洗涤。每孔加入显色液37 ℃避光显色15 min,加终止液终止反应。在酶标仪用450 nm 波长依序测量各孔的吸光度(OD值)。所有实验重复3 次。
1.3.5 透射电子显微镜将小胶质细胞暴露或不暴露在七氟烷中,处理后用PBS 洗涤细胞两次,迅速加电镜固定液用细胞刮轻轻刮下细胞收集到离心管内,离心收集细胞要肉眼可见细胞沉淀芝麻至绿豆大小,弃固定液后加新的电镜固定液室温固定2 h,再转移至4℃保存,直至送去透射电镜显微镜拍摄。
1.4 统计学方法应用GraphPad Prism8.0 软件,实验数据用独立样本t检验比较。以P<0.05 为差异有统计学意义
2 结果
2.1 BV-2 小胶质细胞细胞活力及细胞内线粒体膜电位比较CCK-8 法检测细胞活力,七氟烷组与对照组相比较细胞活力并无明显下降(图1),差异无统计学意义(n= 3,P= 0.891 3)。用JC-1 试剂盒检测BV-2 小胶质细胞线粒体膜电位时,七氟烷组检测发现红光比例较对照组少,细胞的膜电位相对对照组细胞而言有明显下降(图1),差异有统计学意义(n=3,P=0.001 0)。
2.2 BV-2 小胶质细胞炎症因子IL-6 分泌情况比较小胶质细胞激活时分泌炎症因子如IL-6 增多,酶联免疫吸附测定炎症因子IL-6 实验显示,七氟烷组BV-2 小胶质分泌的IL-6 水平比对照组上升(图1),差异有统计学意义(n=3,P=0.024 3)。
2.3 原代小鼠小胶质细胞鉴定免疫荧光染色对原代小鼠小胶质细胞鉴定见图2,DAPI 染细胞核呈现紫色,Iba1 标记的小胶质细胞呈红色。
2.4 原代小鼠小胶质细胞细胞活力及细胞内线粒体膜电位比较CCK-8 法检测细胞活力,加七氟烷组与对照组相比较细胞活力并无明显下降(n=3,P=0.185 2,图3A)。用JC-1 检测BV-2 小胶质细胞线粒体膜电位时,把BV-2 小胶质细胞暴露在1.3 MAC(2.6% ~2.7%)的七氟烷中4 h,结果显示在1.3 MAC(2.6%~2.7%)七氟烷的浓度暴露4 h 发现红光比例较对照组少,细胞的膜电位相对对照组细胞明显下降(图3B),差异有统计学意义(n= 3,P=0.040 9)。
2.5 原代小鼠小胶质细胞炎症因子IL-6 分泌情况比较小胶质细胞激活时分泌炎症因子如IL-6水平上升,酶联免疫吸附测定炎症因子IL-6 实验表示,七氟烷组原代小鼠小胶质分泌的IL-6 水平较对照组上升(图4),差异有统计学意义(n=3,P=0.046 3)。
2.6 BV-2 小胶质细胞受损线粒体及自噬小体数量比较在电镜下观察对照组及七氟烷组BV-2小胶质细胞(图5A),对照组细胞膜结构完整,并见较多伪足与突起,细胞核呈卵圆形,核膜清晰;少量线粒体轻微肿胀,自噬小体数量较多。七氟烷暴露组细胞整体呈重度水肿,细胞膜边缘局部小面积破损,膜周围可见少量微绒毛水肿,细胞核呈不规则形,局部轻微凹陷,核膜模糊;线粒体数量丰富,大部分呈明显肿胀,部分线粒体膜破损、嵴消失;自噬小体数量较多。七氟烷组BV-2 小胶质细胞与对照组对比,单个细胞内受损的线粒体数量增加(n= 3,P= 0.002 6,图5B),单个细胞内自噬小体数量减少,差异有统计学意义(n= 3,P=0.022 7,图5C)。
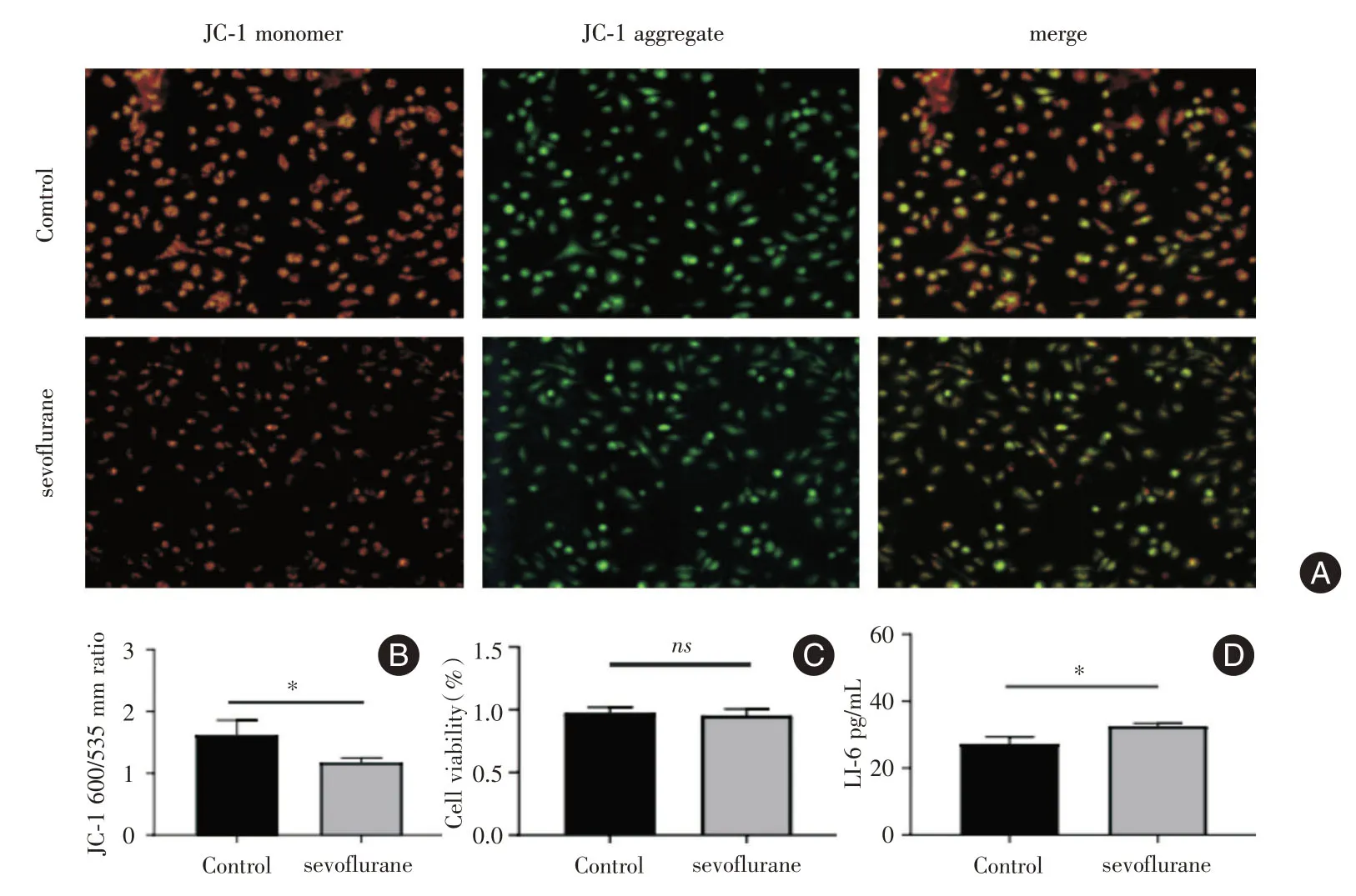
图1 JC-1 检测细胞内线粒体膜电位,ELISA 检测炎症因子IL-6 分泌水平。Fig.1 JC-1 detects the intracellular mitochondrial membrane potential,and the ELISA detects level of inflammatory factor IL6
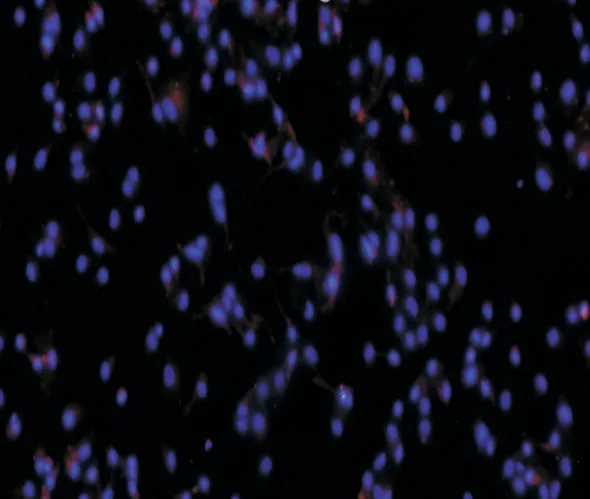
图2 原代小鼠小胶质细胞免疫荧光染色鉴定Fig.2 Immunofluorescence staining identification of primary mouse microglial cells
2.7 原代小鼠小胶质细胞受损线粒体及自噬小体数量比较在电镜下观察对照组及七氟烷组原代小鼠小胶质细胞,七氟烷组BV-2 小胶质细胞中,单个细胞内受损的线粒体数量有下降趋势但差异无统计学意义(n= 3,P= 0.666 1,图6A),单个细胞内自噬小体数量减少差异有统计学意义(n=3,P=0.031 2,图6B)。
2.8 加入线粒体自噬诱导剂鱼藤酮后原代小鼠小胶质细胞的炎症因子分泌情况比较酶联免疫吸附测定炎症因子IL-6实验表示,在分别给原代小鼠小胶质细胞对照组和七氟烷组加入线粒体自噬诱导剂鱼藤酮(1 μmol/L)处理24 h后,鱼藤酮-七氟烷组小胶质细胞分泌的IL-6 水平与鱼藤酮-对照组小胶质细胞比较(图7),差异无统计学意义(n=3,P=0.912 6)。

图3 原代小鼠小胶质细胞活力及细胞内线粒体膜电位Fig.3 Cell viability and mitochondrial membrane potential of primary mouse microglia
3 讨论
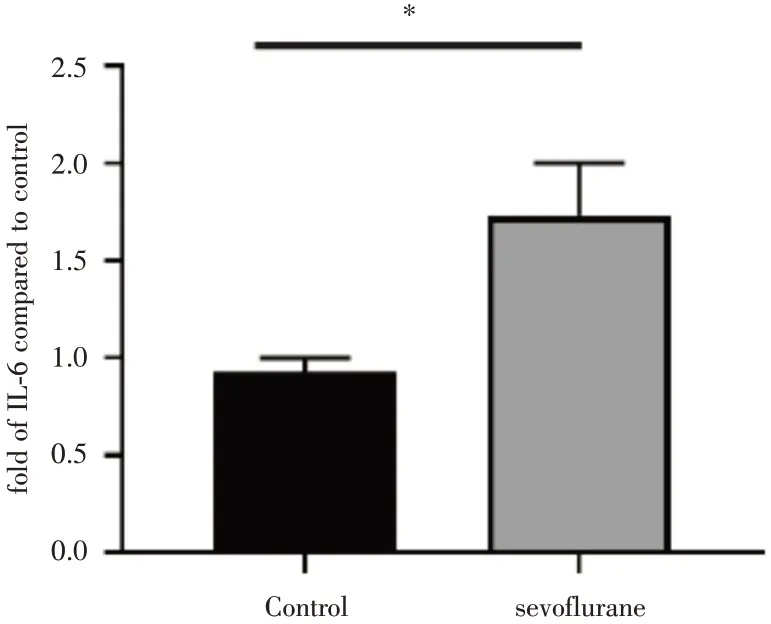
图4 ELISA 检测原代小鼠小胶质细胞炎症因子IL-6 分泌水平Fig.4 ELISA for detecting the level of inflammatory factor IL-6 in primary mouse microglia
目前临床上七氟烷适用于各种年龄、各部位的大小手术,在临床上使用七氟烷的浓度范围为1 ~1.5 MAC。既往研究显示,使用七氟烷多次麻醉可导致新生幼鼠广泛性神经细胞凋亡影响中枢可塑性及神经递质,损伤幼鼠的学习记忆能力[24-25];大脑中IL-6 等炎症因子的水平增高,颅内炎症的产生对认知功能产生损害[26],而这可能与小胶质细胞被七氟烷激活,分泌大量如IL-6 等炎症因子[27]有极大关系;有研究表明,七氟烷处理小胶质细胞降低炎症因子的产生,降低了小胶质细胞的活化[10]。为探讨临床相关浓度的吸入麻醉药七氟烷对小鼠来源的BV-2 细胞系和原代小鼠小胶质细胞活化的作用。在本研究中根据前期研究发现七氟烷在临床、动物以及细胞使用的浓度多为1 MAC到2 MAC 之间且结合临床上常用的七氟烷浓度即1.3 MAC,采用小胶质细胞在1.3 MAC(2.6%~2.7%)的七氟烷浓度中暴露4 h,观察小胶质细胞的活化。本研究中,暴露在七氟烷中的小胶质细胞明显出现IL-6 等炎症因子的分泌增多,即七氟烷激活小胶质细胞。胶质细胞是大脑中很重要的一类细胞,正常情况下对大脑有保护作用,但过度激活的小胶质细胞则会引起中枢炎症[28]。在本实验中,七氟烷激活小胶质细胞可能导致颅内神经炎症的发生[21,26]。

图5 电镜下观察两组BV-2 小胶质细胞内部结构Fig.5 Internal structures of two groups of BV-2 microglia were observed with electron microscopy
线粒体是是细胞进行有氧呼吸产生ATP 为细胞提供能量的场所,膜电位是线粒体合成ATP 的动力,膜电位下降导致细胞不能合成足够的ATP而无法完成正常必要的生命活动[29]。本研究结果显示,在1.3 MAC(2.6% ~2.7%)的七氟烷浓度中暴露4 h,原代小鼠小胶质细胞或者BV2 小胶质细胞系的细胞活力维持不变,线粒体膜电位下降,提示七氟烷损伤小胶质细胞的线粒体。

图6 电镜下观察两组原代小鼠小胶质细胞内部结构Fig.6 The internal structure of two groups of primary mouse microglia cells was observed under electron microscope
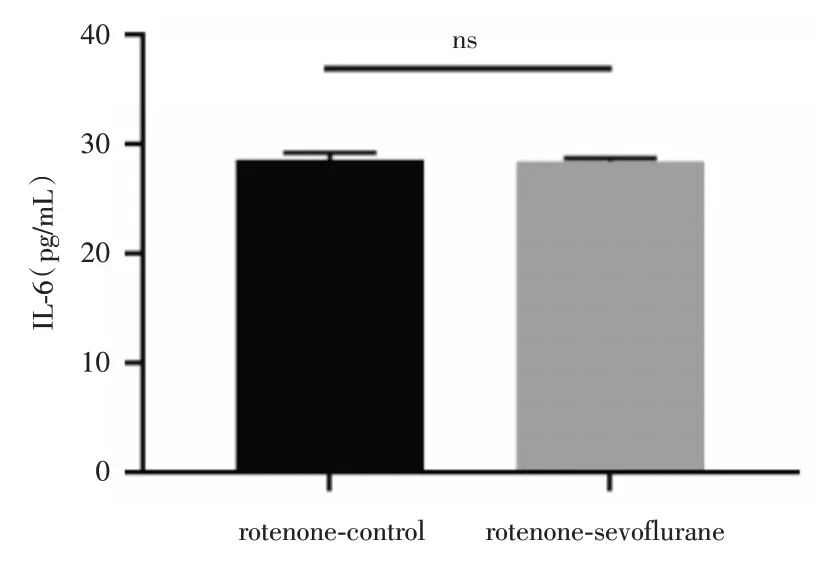
图7 ELISA 检测加入鱼藤酮后原代小鼠小胶质细胞炎症因子IL-6 分泌水平Fig.7 ELISA for detecting the level of inflammatory factor IL-6 in primary mouse microglia treated with rotenone
线粒体自噬是细胞自噬的一种,也是线粒体质量控制的重要机制,其可选择性地清除受损或功能不完整的线粒体[30-31]。研究表明,线粒体自噬在线粒体质量控制中起着重要的作用[31],对顺铂相关神经毒性具有保护作用[32]。自噬可以分为三大步骤,双层分隔膜的形成,自噬体的延伸过程,自噬溶酶体的形成与裂解阶段。通过电镜能从形态学的角度辨别出自噬小体以及受损的线粒体。在本实验中通过电镜观察细胞内结果,原代小鼠小胶质细胞或者BV2 小胶质细胞系中七氟烷组与对照组相比,七氟烷组小胶质细胞中损伤的线粒体数量比较多,七氟烷组小胶质细胞中自噬小体的数量明显减少,即在暴露在七氟烷的小胶质细胞对损伤的线粒体清除能力不足,过往的研究发现受损的线粒体大量增多,除了对细胞供能产生影响还会让ROS 积累损伤细胞使小胶质细胞激活[33-34],抑制ROS 信号防止小胶质细胞激活及炎症产生[34],提示七氟烷使线粒体自噬过程受到抑制,自噬小体的减少,小胶质细胞被激活分泌IL-6 增加,促进神经毒性和神经退行性疾病[35]。
鱼藤酮作为线粒体自噬诱导剂,在CHU等[36]的研究中诱导原代皮层神经元和SH-SY5Y神经母细胞瘤细胞中线粒体自噬的增加;在THANGARAJ 等[15]研究中,鱼藤酮在小胶质细胞也引起线粒体自噬的增多。本研究根据THANGARAJ等[15]研究中的鱼藤酮剂量以及作用时长作为参考处理小胶质细胞,加入线粒体自噬激动剂鱼藤酮后,鱼藤酮-七氟烷组与鱼藤酮-对照组小胶质细胞分泌的炎症因子IL-6 水平无明显差别,即线粒体自噬诱导剂抑制了七氟烷对小胶质的激活作用,结合上文结果更能反映自噬小体的减少与小胶质细胞的激活有关。
综上,由已有的文献资料及本研究结果可推断小胶质暴露在1.3 MAC(2.6% ~2.7%)即临床使用浓度的七氟烷中,线粒体自噬途径被抑制,小胶质细胞激活。本研究仍有不足,未能进一步探讨七氟烷如何使小胶质细胞的线粒体损伤从而激活小胶质细胞的即线粒体自噬引起小胶质细胞激活的具体通路,且本文未能明确七氟烷抑制线粒体自噬过程的哪一具体环节,拟下一步在进行更深入的体外实验进行探讨。
