调控Sonic Hedgehog信号通路对急性脑缺血大鼠血管再生影响的实验研究*
2020-07-02朱美霖白宏英
朱美霖,白宏英
1.山东省济宁市第一人民医院老年医学科(济宁 272000);2.郑州大学第二附属医院神经内科(郑州450000)
脑缺血后的血管再生可有效改善缺血半暗带的血液供应,增加营养物质及氧气的输送,为新生神经元提供营养支持,并促进脑缺血恢复。脑缺血发生后虽可以代偿性生成新生血管,建立侧枝循环,仍不能完全代偿脑缺血损伤[1]。因此脑缺血后尽快恢复血供,可以明显改善预后。Kusano等[2]研究表明Sonic Hedgehog(SHH)信号通路可诱导血管内皮生长因子(Vascular endothelial growth factor VEGF)、血管生长素(Angiogenin,ANG)合成促进血管再生。Renault 等[3]发现SHH信号通路可促进毛细血管形态的发生,诱导血管内皮细胞迁移。在大鼠脑缺血模型中可观察到SHH信号通路的激活,另外有研究表明在糖尿病外周神经病变的大鼠模型中加入外源性SHH蛋白可促进血管再生[4]。为进一步研究SHH信号通路与血管再生的影响,本次研究采用Purmorphamine作为SHH信号通路的激活剂,Cyclopamine作为SHH信号的抑制剂来调控SHH信号通路,以了解SHH信号通路对脑缺血大鼠血管新生的影响。
材料与方法
1 材 料 Purmorphamine粉剂购于上海凯试公司,Cyclopamine购于美国Sigma公司,VEGF抗体、碱性成纤维细胞生长因子(FGF)兔抗鼠多克隆抗体购于美国SANTA CRUZ公司,免疫组化相关试剂盒及PCR相关试剂盒购于德国QIAGEN公司。
2 实验动物及分组 选取健康清洁级成年SD雄性大鼠120只,体重约为260~320 g,该实验动物由河南省实验动物中心提供。将选中的大鼠随机分为假手术组(n=30)、模型组(n=30)、激动剂组(PM组,n=30)、抑制剂组(CYC组,n=30)。其中模型组、激动剂组、抑制剂组按时间点再分成三个亚组,每个亚组10只大鼠。模型组、激动剂组于术后腹腔注射Purmorphamine溶液,抑制剂组于术后腹腔注射Cyclopamine溶液,剩余分组给予同等剂量的DMF溶液腹腔注射。
3 试剂配备 Purmorphamine粉剂使用前先给予二甲基亚砜(DMSO)溶液溶解,粉剂全部溶解后加入PBS溶液进行稀释。Cyclopamine粉剂使用前给予DMSO溶剂溶解,然后给予PBS溶液进行稀释。将配备好的溶液冰箱储存,使用前提前拿出进行复温。
4 模型制备 采用改良线栓法制作SD大鼠永久性脑缺血模型[2]。各组大鼠给予水合氯醛腹腔注射麻醉,室温保持 37 ℃。模型组及给药组给予分离颈总动脉及颈内动脉,夹闭颈总动脉,距离分叉处4 mm插入制备好的线栓,将线栓插入大脑中动脉,固定线栓,缝合。术中大鼠体温保持37 ℃,术后大鼠单笼饲养。参照Zea longa评分标准于大鼠清醒后6 h、24 h、72 h对造模大鼠进行神经功能缺损评分。其中1~3分且无蛛网膜下腔出血视为造模成功。不符合评分标准剔除,取同批次补足,以保证每个亚组10只大鼠。
5 免疫组化法和微血管密度 于造模给药结束后按照既定的时间点腹腔注射10%水合氯醛麻醉,4%甲醛快速心脏灌洗,断头取脑固定24 h备用,经过石蜡包埋后,切成4 μm厚度的切片。每只大鼠冰冻切片随机抽取5张,严格按照说明书进行免疫组化染色、DAB显色和封片。采用图像测量分析软件测定VEGF、成纤维细胞生长因子(Fibroblast growth factor,FGF)表达的平均光密度(MOD)。根据Longa等[5]改良血管计数法,染色棕黄且与周围周围细胞分界清楚作为一个计数单位,计算CD34微血管密度、微血管数。
6 PCR测定缺血半暗带区域胶质瘤相关癌基因1(GLI1)mRNA的表达情况 10%水合氯醛麻醉,取出脑组织,液氮冷藏后放置于-80℃冰箱。取皮层脑组织100 mg,按照说明书提取总RNA,将RNA逆转录合成相互补的cDNA,以cDNA为模板进行扩增建立PCR反应体系。GLI1上游引物为:5’-TATGTTCTGGCTGCTGCTGTTG-3’下游引物为5’-TGACGCATTGCTGAATCTAA-3’。其中扩增条件为:94 ℃预变性2 min,1个循环;94 ℃变形30 s,55 ℃退火30 s,72 ℃延伸2 min,共35个循环,72 ℃延伸6 min。将扩增好的产物及Maker进行电泳,使用图像分析系统进行半定量分析,试验中以β-actin为内参,GLI1的扩增片段长度为170 bp,计算GLI1相对表达量。
结 果
1 大脑皮质半暗带区CD34新生微血管密度 CD34阳性细胞大部分分布在缺血半暗带区。PM组新生血管密度较模型组、CYC组明显增多,三组差异具有统计学意义(P<0.05)。CYC组新生血管密度较模型组、CYC组明显减少(P<0.05)。见表1。
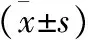
表1 大鼠脑组织新生血管密度表达
2 缺血皮层区VEGF的表达 胞质中沉着棕黄色颗粒即为VEGF阳性表达,VEGF表达主要集中在损伤皮层及缺血周围。模型组6 h可见VGFE表达升高,72 h最多。PM组VEGF的表达量较模型组、CYC组明显增多,比较差异具有统计学意义(P<0.05)。CYC组VEGF的表达量较PM组、模型组明显减少,比较差异具有统计学意义(P<0.05)。见表2(图1)。
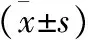
表2 大鼠脑组织VEGF的表达
3 FGF的表达 FGF阳性细胞常见于血管内皮细胞、神经细胞、胶质细胞等,模型组6 h FGF弱表达,72 h表达最多。PM组FGF的表达量较模型组、CYC组明显增多,比较差异具有统计学意义(P<0.05)。且CYC组FGF的表达量较PM组、模型组明显减少,比较差异具有统计学意义(P<0.05)。见表3(图2)。
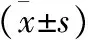
表3 大鼠脑组织FGF的表达
4 PCT检测GLI1的表达 与模型组相比较,PM组各时间点GLI1的表达量较前明显增多(P<0.05),与模型组相比较,CYC组各时间点GLI1的表达量较前明显减少。见表4。
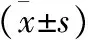
表4 大鼠脑组织 GLI1的表达
注:A:假手术组;B:模型组;C:PM组;D:CYC组
讨 论
在脑缺血性疾病中,神经血管单元因为缺氧缺血出现坏死凋亡,影响神经功能恢复,因此及时恢复血供,促进血管新生成为研究治疗的热点。早期研究表明SHH信号通路与胚胎发育有关,近期研究表明SHH信号通路在血管再生起着重要作用[6]。Kusano 等[4]发现 SHH信号通路诱导局部缺血组织血管再生,且诱导血管新生的能力强于VEGF。在参与血管再生的过程中,SHH信号通路可以通过依赖GLI的通路、PI-3激酶通路进行调控[7]。SHH信号通路中通过smo蛋白与ptch结合激活下游基因GLI转录因子,诱导目的基因的表达。GLI锌指家族转录因子包含GLI1、GLI2、GLI3,其中GLI1的表达在SHH信号通路中扮演了启始开关的角色。GLI1是目前发现的最能反映 SHH信号通路激活的指标[8]。因此本次研究选取测定GLI1的表达反映通路是否被激活。
Purmorphamine作为SHH信号通路的激活,是一种小分子的嘌呤物,可以透过血脑屏障。Purmorphamine与SMO蛋白结合改变其空间构象从而激活SHH信号通路。本研究显示PM组在脑缺血6 h后GLI1的表达量较假手术组、模型组有明显升高,24 h达高峰,72 h仍维持在较高水平,这就表明腹腔注射Purmorphamine可以外源性激活SHH信号通路。Cyclopamine是SHH信号通路的抑制剂,作用位点为SMO蛋白,可改变SMO蛋白构象使SMO蛋白失活,抑制SHH信号通路。有研究表明SHH信号通路在脑缺血急性期可被激活,阻断内源性激活的SHH信号通路可加重脑缺血。本次研究中模型组6 h后GLI的表达开始升高,表明在脑缺血急性期存在内源性激活。腹腔注射Cyclopamine后该组GLI1的表达量与模型组、PM组相比较有明显降低,说明激活的SHH信号通路被Cyclopamine抑制,从而阻断下游基因的表达。
内皮血管生长因子VEGF是目前发现的最强的血管通透性因子,可以诱导其毛细血管新生,并且特异性地作用于血管内皮细胞,从而促进细胞分裂、促进血管新生、侧支循环的建立。有研究表明VEGF基因治疗缺血性疾病可促进缺血组织器官的血管重建,改善缺血组织供血,为缺血性疾病的治疗开辟了一条崭新的途径[9]。ANG是新生血管构建过程中重要的组成成分,在构建新生血管过程中发挥着关键的作用[10-11]。SHH信号通路可诱导 VECs 分化、增殖和迁移,促进毛细血管管腔形成[12],VEGF被认为是SHH信号通路的下游靶基因。碱性成纤维因子FGF可以促进血管基底细胞及间质细胞分裂,还能通过分泌胶原酶降解细胞外基质和血管基底膜,从而促进血管再生[13]。SHH信号通路可通过诱导 FGF 表达,促进血小板衍生生长因子及ANG的表 达,间 接 诱 导 血 管 新 生[14-15]。本研究中模型组、PM组的各时间点VEGF、FGF的表达量较前假手术组、CYC组明显增多,说明不管内源性激活SHH信号通路,还是外源性激活SHH信号通路,均可上调VEGF、FGF的表达促进血管再生。并且PM组新生血管密度、VEGF、FGF的表达量较其余组明显增多,而CYC组的新生血管密度、VEGF、FGF的表达量较其他组减少,这就说明腹腔注射Purmorphamine可激活SHH信号通路上调VEGF、FGF的表达促进血管再生。腹腔注射Cyclopamine后可抑制SHH信号通路下调VEGF、FGF的表达抑制血管再生。
总之通过本实验研究表明激动SHH信号通路可上调VEGF、FGF的表达促进血管再生,反之抑制SHH信号通路下调VEGF、FGF的表达抑制血管再生,SHH信号通路调控脑缺血后血管再生中起着重要作用。但是SHH信号通路对血管再生的作用机制、外源性激活SHH信号通路持续效应如何以及与其他通路是否有交叉作用等问题仍需要进一步研究。
