RORα在脂多糖所致小鼠巨噬细胞炎症反应中的表达变化与作用实验研究*
2020-07-02孟卫荣李珍珍韩军涛
孟卫荣,李珍珍,韩军涛
空军军医大学第一附属医院烧伤与皮肤外科(西安 710032)
巨噬细胞是机体重要的固有免疫细胞,是释放炎症介质的固有免疫主力军,因此在调控炎症反应中起到了核心作用[1-2]。在脓毒症初期,该细胞被激活,释放大量炎症相关因子,从而引发炎症级联放大反应,最终导致全身性炎症反应[2-5],因此,巨噬细胞的异常活化在机体失控性炎症反应,以及引发的多脏器功能衰竭甚至脓毒症等病理过程中发挥着至关重要的作用。由此,控制巨噬细胞炎症反应尤为重要。核受体(Nuclear receptors,NRs)是配体调控的转录因子,在机体中主要起调节代谢、发育和免疫等作用[6-7]。其中“视黄酸相关孤核受体”(Retinoid-related orphan receptors,RORs)属于NR超家族,有研究表明,RORs亚家族RORα在免疫细胞尤其是巨噬细胞中高表达[6,8]。RORα敲除小鼠中,脂多糖(Lipopolysaccharide,LPS)诱发的炎症介质释放水平明显高于野生鼠,同时,敲除鼠中腹腔内巨噬细胞在LPS刺激下,其炎症因子的表达量是野生小鼠巨噬细胞的5~10倍[9-10]。由此看来,RORα对机体免疫系统以及巨噬细胞炎症反应具有潜在的调控作用。然而,RORα在LPS诱发巨噬细胞炎症反应中的表达变化,以及对炎症反应的调控作用尚不明确。本研究通过分离小鼠骨髓来源的巨噬细胞(Bone marrow derived macrophages,BMDMs),观察LPS在不同时间点刺激巨噬细胞发生炎症反应条件下,RORα的转录和蛋白表达水平变化,以及RORα激动剂和抑制剂分别预处理后,对LPS诱发炎症因子释放的影响,初步验证RORα对脂多糖所致小鼠巨噬细胞炎症反应具有缓解作用。
材料与方法
1 材 料
1.1 动物:实验动物选取健康的6~8周雄性C57BL/C6小鼠,体重(25±5)g,饲养条件为昼夜节律12 h/12 h,自由饮水摄食。所有实验动物均由空军军医大学实验动物中心提供,实验中动物操作及处理均符合空军军医大学动物伦理委员会定制的原则及操作规范。
1.2 细胞培养与分组:小鼠骨髓来源巨噬细胞(BMDMs)取自6~8周雄性C57BL/C6小鼠,小鼠颈椎脱臼处死后,取双侧股骨与胫骨,移至超净工作台,使用1 ml注射器冲洗骨髓并收集,1000 r/min离心5 min,使用含有10% 胎牛血清的RPMI 1640培养基重悬后,在37℃,5% CO2孵箱中培养过夜,去除贴壁较快的杂细胞,收集未贴壁细胞铺于细胞培养皿中,加入20 ng/ml巨噬细胞集落刺激因子,培养5 d后,对细胞进行分组处理。荧光定量PCR(qRT-PCR)法检测100 ng/ml LPS处理不同时间点:0 h、1 h、2 h、6 h、12 h和24 h的白细胞介素-1β(Interleukin1β,IL-1β)和RORα转录水平的变化。不同处理组血清中炎症因子的含量:①正常组:1∶1000 DMSO;②LPS组:100 ng/ml LPS;③5 μmol/L SR1078+100 ng/ml LPS;④10 μmol/L SR3335+100 ng/ml LPS。SR1078/SR3335作用24 h后,加入LPS处理2 h后取样观察,每种条件重复5次,本试验至少可以获得3次可重复结果。
1.3 主要试剂:RPMI 1640培养基和胎牛血清购自美国Gibco公司;巨噬细胞集落刺激因子购自美国PeproTech公司;LPS购自美国Sigma公司;SR1078和SR3335购自美国MCE公司;Trizol裂解液购自美国Invitrogen公司;RORα和GAPDH一抗购自中国Proteintech公司;ELISA试剂盒购自中国欣博盛生物公司。
2 实验方法
2.1 qRT-PCR法检测细胞中蛋白转录水平:BMDMs分别加入100 ng/ml LPS处理不同时间点:0 h、1 h、2 h、6 h、12 h和24 h后,使用Trizol裂解法提取RNA,步骤严格按照Invitrogen公司的实验步骤进行,每组进行5个重复。得到的RNA用分光光度计读取OD260/OD280比值及RNA浓度。反转录试剂盒将mRNA反转录为cDNA后,利用TB Green试剂盒进行荧光定量PCR,分别以小鼠IL-1β,肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)和RORα为引物,IL-1β上游引物 5’-CAACCAACAAGTGATATTCT
CCATG-3’,下游引物5’-GATCCACACTCTCCAGC
TGCA-3’, TNF-α上游引物5’-TATGGCCCAGACCCTCACA-3’,下游引物5’-GGAGTAGACAAGGTACAACCCATC-3’, RORα上游引物5’-TCAGCAGAGCAATGCCACCTAC-3’,下游引物5’-TGGACATCCGACCAAACTTGAC-3’;以小鼠GAPDH作为内参,上游引物5’-TGTGTCCGTCGTGGATCTGA-3’,下游引物5’-TTGCTGTTGAAGTC
GCAGGAG-3’,反应体系为20 μl,利用2ΔΔCT法计算分析。
2.2 免疫印迹法(Western blot)检测细胞中RORα蛋白水平:BMDMs分别加入100 ng/ml LPS处理不同时间点:0 h、1 h、2 h、6 h、12 h和24 h后,加入RIPA细胞裂解液收集细胞蛋白,BCA蛋白定量试剂盒检测浓度后,加入上样缓冲液Loading buffer,100 ℃处理5 min。取20 μg蛋白样品加样到10% SDS-PAGE胶中,电泳约2 h后,100 V恒压转膜60 min。5%脱脂奶粉室温封闭2 h后,孵育相应一抗4 ℃过夜,RORα一抗(1∶1000)和GAPDH一抗(1∶2000)。二抗(1∶4000)室温孵育2 h后,ECL 方法显影成像,并用Image J软件对条带进行灰度分析。
2.3 ELISA法检测细胞培养液上清中炎症因子IL-1β,TNF-α和白介素6(Interleukin-6,IL-6)的含量:各组细胞SR1078/SR3335作用24 h后,加入LPS处理2 h后取出细胞上清液,1000 r/min离心5 min后收集上清。步骤严格按照欣博盛生物公司的ELISA试剂盒说明进行,每个样做5个复孔,按照步骤加入各种反应试剂,根据样品在波长450 nm的酶标仪中读取OD值,与同时制作的标准曲线进行对比,计算细胞上清液中炎症因子的浓度。
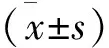
结 果
1 BMDMs在LPS处理不同时间点蛋白转录水平的表达 BMDMs在LPS处理0 h、1 h、2 h、 6 h、12 h和24 h后,对其进行炎症因子IL-1β和TNF-α转录水平的检测,结果显示,LPS处理后,IL-1β和TNF-α的转录水平均出现了显著升高(P<0.01 vs 0 h),且在2 h左右出现了峰值,与0 h相比,IL-1β值为(204.98±42.04),TNF-α值为(23.77±3.37),提示LPS处理致使BMDMs释放炎症因子,出现炎症反应。同时检测RORα转录水平变化,结果发现,与处理0 h相比,RORα表达水平在1-12 h均出现了明显降低(P<0.01),且在2 h左右最为显著,说明在BMDMs炎症反应过程中,RORα表达受到抑制,且与炎症因子IL-1β和TNF-α表达成负相关,初步提示RORα可能参与了巨噬细胞炎症反应过程,见表1。
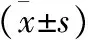
表1 BMDMs在LPS处理不同时间点蛋白转录水平的表达
注:与0 h相比,*P<0.01
2 BMDMs在LPS处理不同时间点RORα蛋白水平的表达 为了进一步验证RORα在BMDMs炎症反应中的表达变化,我们通过Western blot法检测其蛋白水平,结果显示,与LPS处理0 h相比,RORα蛋白表达水平在处理1 h、2 h、6 h和24 h均出现了显著的降低(P<0.05,P<0.01),且与转录水平变化相似,进一步提示RORα在LPS刺激下表达水平受到显著抑制(图1)。
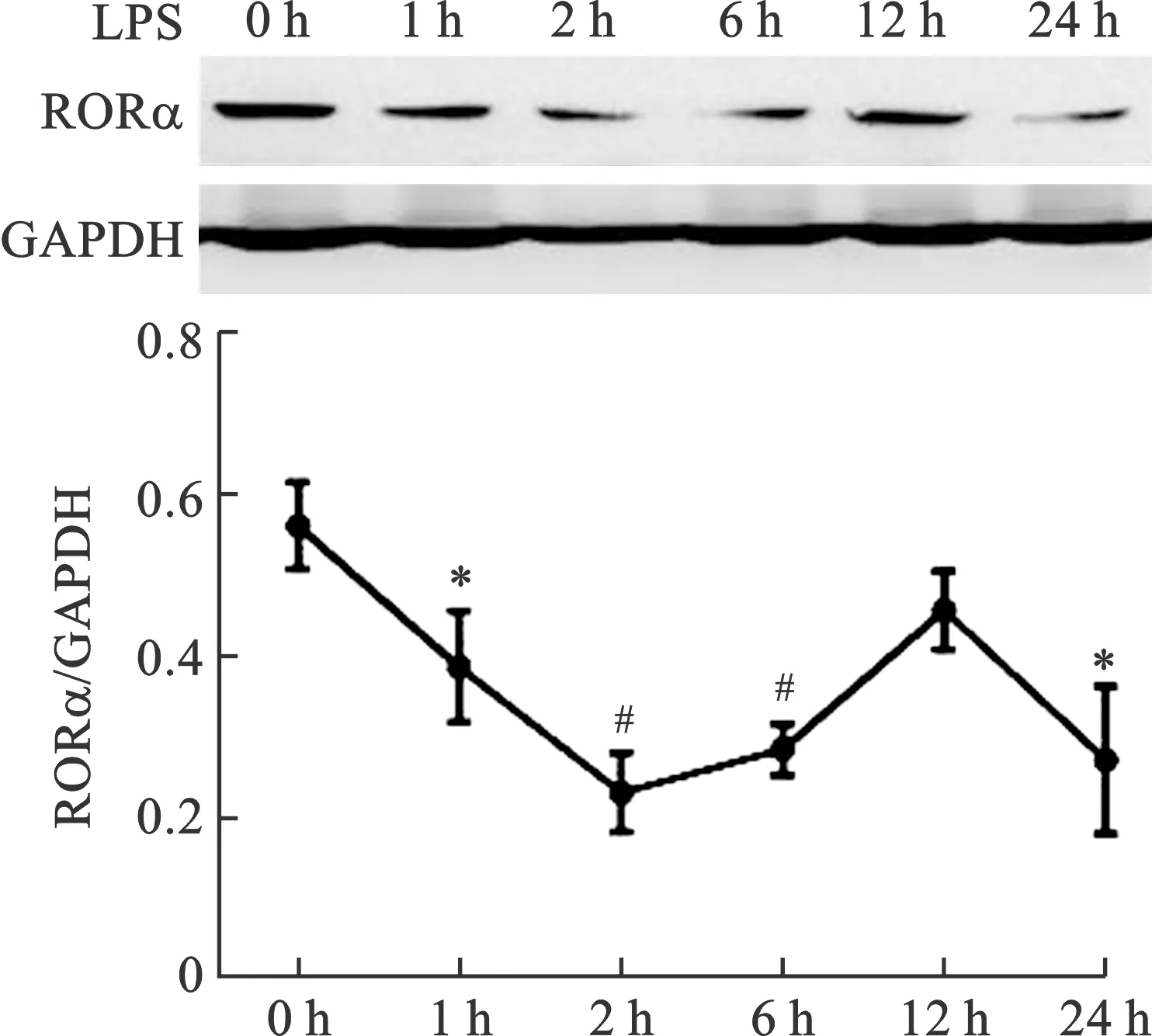
注:与0 h相比,*P<0.05,#P<0.01
3 RORα对LPS所致巨噬细胞炎症因子释放的影响 对BMDMs进行预处理,一组加入RORα激动剂5 μmol/L SR1078,一组加入RORα拮抗剂10 μmol/L SR3335,处理24 h后,加入LPS处理,2 h后,利用ELISA法检测各组细胞培养液上清中炎症因子IL-1β,TNF-α和IL-6的含量,结果显示,LPS组中,IL-1β,TNF-α和IL-6的含量均出现显著上调(P<0.01),而在SR1078预处理组中,与LPS组相比,IL-1β,TNF-α和IL-6含量均出现显著降低(P<0.05,P<0.01),同时,SR3335与处理组中,得到了相反结果,即与LPS组相比,IL-1β,TNF-α和IL-6含量均明显升高(P<0.05)。以上结果提示,RORα能够显著抑制LPS所致的巨噬细胞炎症因子的释放。见表2。
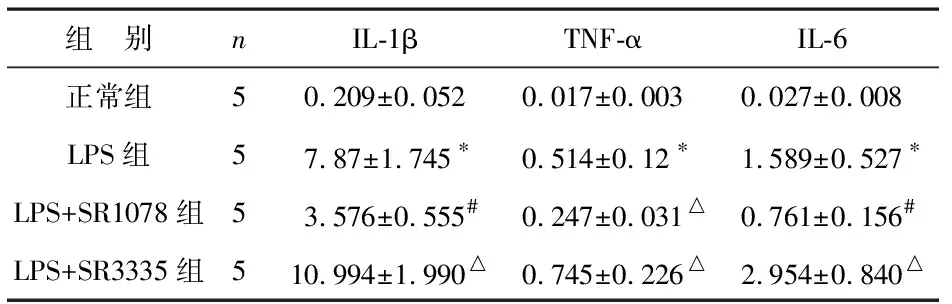
表2 BMDMs细胞炎症因子含量的表达(pg/ml)
注:与正常组相比,*P<0.01;与LPS组相比,#P<0.05,△P<0.01
讨 论
巨噬细胞作为重要的固有免疫细胞,是机体在血液和组织器官循环中抵御疾病的第一道防线,当机体受到外界病菌侵入时,巨噬细胞通过吞噬和降解作用清除抗原和细菌的同时,释放IL-1β和TNF-α等炎性介质导致炎症反应[1,11-12],在炎症反应过程中,巨噬细胞既是启动细胞,也是效应细胞,炎症因子的释放可进一步激活巨噬细胞,导致炎症的级联瀑布效应,从而导致全身的炎症反应综合征,最终引发脓毒症休克、多脏器损伤等症状[4,13-14],因此,巨噬细胞的异常活化在炎症反应中发挥着重要作用。临床上由细菌感染引发的脓毒症占到了95%以上,而细菌感染引起的内毒素LPS的释放是导致脓毒症的主要因素[5,15-16],因此,本研究采用LPS刺激BMDMs,观察对其炎症因子表达的影响,结果发现,LPS在1~24 h不同时间点处理下,炎症因子IL-1β和TNF-α的转录水平均出现了显著的升高,提示LPS可诱发巨噬细胞发生炎症反应。
RORα在各个组织中广泛表达,且在免疫系统,尤其是巨噬细胞中高表达[9,17]。研究表明,RORα在巨噬细胞中的表达受到严格控制,在静息状态下,RORα高表达,而Toll样受体被激活时,其表达水平显著受到抑制[9-10],提示RORα可能具有控制巨噬细胞炎症反应的作用。本研究在LPS激活BMDMs发生炎症反应时,发现RORα转录和蛋白水平均受到显著下调,尤其在1~6 h,且2 h时最为显著,与炎症因子的表达水平呈负相关,这与前期研究结果相符,提示RORα可能参与了炎症因子的释放。在RORα基因敲除鼠中,LPS诱发的炎症因子的释放水平明显高于野生鼠,同时,敲除鼠中腹腔内巨噬细胞在LPS刺激下,其炎症因子的表达量是野生小鼠巨噬细胞的5~10倍[17- 18]。提示RORα对巨噬细胞炎症反应具有潜在的调控作用。本研究通过采用RORα激动剂SR1078和拮抗剂SR3335预处理巨噬细胞,使其在细胞中高表达或抑制表达,进而观察LPS刺激下,巨噬细胞的炎症介质释放情况,发现在SR1078预处理的细胞中,LPS刺激下,其炎症因子的释放受到了显著的抑制作用,而拮抗剂SR3335的作用正好相反,进一步活化了巨噬细胞炎症因子的释放,该结果说明RORα能够显著抑制LPS诱发的巨噬细胞炎症因子的释放,进而缓解炎症反应。
综上所述,本研究通过LPS激活BMDMs释放炎症因子,诱发炎症反应的同时,RORα转录水平和蛋白水平均受到显著的抑制作用,而当诱导RORα表达上调或者下调后,LPS对巨噬细胞炎症介质的释放具有显著的抑制或促进作用,提示RORα在巨噬细胞调控炎症反应中发挥着重要的作用,这为减轻失控性炎症反应提供新的理论基础和治疗靶点。
