国内外卫生技术评估方法学指南的系统评价
2020-07-01徐佩佩李汶睿曾力楠刘丹张扬米雪黄宗瑶宋好鑫张伶俐
徐佩佩 李汶睿 曾力楠 刘丹 张扬 米雪 黄宗瑶 宋好鑫 张伶俐

中圖分类号 R197 文献标志码 A 文章编号 1001-0408(2020)12-1500-06
DOI 10.6039/j.issn.1001-0408.2020.12.17
摘 要 目的:系统评价国内外卫生技术评估(HTA)方法学指南,为我国HTA方法学指南的科学制订提供参考和借鉴。方法:计算机检索PubMed、Embase、国际指南网络以及26个国家的政府及学术组织的83个官方网站,收集HTA方法学指南,检索时限均为建库起至2020年4月。由两位研究者独立筛选文献、提取资料,包括指南的基本特征、涉及内容以及评估内容,对HTA方法学指南的基本情况进行描述性分析。结果与结论:共纳入指南19篇。纳入的19篇指南均发表于2001-2018年,其中有7篇指南(占36.8%)发表于2015年以后;除1篇指南来自世界卫生组织以外,有14篇指南(占73.7%)来自欧洲,有2篇指南(占10.5%)来自北美洲,各有1篇指南(各占5.3%)来自南美洲和亚洲;有11篇指南(占57.9%)的制订机构为学术组织,8篇(占42.1%)指南的指定机构为卫生行政部门;有11篇(占57.9%)为循证指南,8篇(42.1%)为非循证指南;19篇指南均明确了评估目的、评估内容和评估客体,18篇指南明确了其评估方法(占94.7%),16篇指南(占84.2%)明确了其评估主体,14篇指南(占73.7%)明确了HTA评估流程,12篇指南(占63.2%)提及了HTA评价中的利益冲突问题,7篇指南(占36.8%)提及了关于评估结果的应用问题。国外HTA指南制订方法及内容稍有差异,但核心内容大体一致。我国目前尚缺乏HTA方法学指南,可参考国外指南,建立符合我国国情且适用性较强的HTA方法学指南,为开展HTA研究提供科学指导。
关键词 卫生技术评估;指南;系统评价
Systematic Review of Methodological Guidelines for Health Technology Assessment at Home and Abroad
XU Peipei1,2,3,LI Wenrui1,2,ZENG Linan1,2,LIU Dan1,2,ZHANG Yang1,2,MI Xue1,2,HUANG Zongyao1,2,SONG Haoxin1,2,ZHANG Lingli1,2,3,4(1. Dept. of Pharmacy/Evidence-Based Pharmacy Center, West China Second University Hospital, Sichuan University, Chengdu 610041, China; 2. Key Laboratory of Birth Defects and Related Diseases of Women and Children, Ministry of Education, Chengdu 610041, China;3. West China School of Medicine, Sichuan University,Chengdu 610041, China; 4. West China School of Pharmacy, Sichuan University,Chengdu 610041, China)
ABSTRACT OBJECTIVE: To evaluate guidelines for health technology assessment (HTA) at home and abroad, and to provide reference for scientific formulation of HTA guidelines in China. METHODS: Databases including PubMed, Embase, Guidenlines International Network and 83 official websites from 26 countries governments and academic organizations were searched to collect HTA guidelines from inception to April 2020. Two reviewers independently screened literature and extracted data, including basic characteristics, content of guideline and assessment content. Then a descriptive analysis was conducted. RESULTS & CONCLUSIONS: A total of 19 guidelines published during 2001 to 2018 were included, 7 guidelines (36.8%) were published in 2015-2020; in addition to 1 guideline from WHO, 14 guidelines (73.7%) were published in Europeand, 2 guidelines (10.5%) in North America and 1 guideline each from South America and Asia (5.3%). There were 11 guidelines (57.9%) developed by academic organizations and 8 guidelines(42.1%) by health administration; 11 guidelines (57.9%)were evidence-based, while the others werent evidence- based (42.1%). The purpose,content and object of assessment are demonstrated in 19 guidelines; 18 guidelines specified the assessment method (94.7%), and 16 guidelines (84.2%)defined the subject of assessment; 14 guidelines (73.7%) specified the HTA assessment process; 12 guidelines (63.3%) mentioned the conflict of interest in HTA assessment process; 7 guidelines (36.8%) mentioned the application of assessment results. There are some differences in the formulation methods and contents of HTA guidelines in foreign countries, but the core contents are basically the same. At present, there is a lack of HTA guidelines in China. We can refer to foreign guidelines, and establish applicable HTA guidelines which are suitable for national conditions, so as to provide scientific guidance for HTA research.
KEYWORDS Health technology assessment;Guideline;Systematic review
卫生技术评估(Health technology assessment,HTA)是指对卫生技术(Health technology,HT)性质及影响进行的系统评估,通过了解卫生干预或HT对社会、经济、组织和伦理所产生的影响来辅助相关决策的产生[1]。HT是指用于卫生保健和医疗服务系统的特定知识体系,包括药物、医疗器械、服务提供模式等。经过几十年的发展,HTA已形成了较完善的科学评估体系,广泛应用于新医药技术准入、医疗保险支付范围确定、HT价格制定等方面。其中,药品的HTA不仅广泛应用于宏观管理层面,如新药审批、药品定价、药品目录的制订等,同时也应用于使用层面,如医院新药遴选、临床用药决策等。自2013年国务院提出支持发展第三方医疗服务评价以来,无论在学术领域还是政策层面对HTA的关注均急剧增加[2]。因起步较晚,虽已制定了针对某些HT的HTA指南(如《罕见病药物卫生技术评估专家共识(2019)》[3]等),但我国尚无适用于所有HTA的宏观管理性指南,且目前国内外尚未见采用系统评价的方法评价国内外相关HTA指南的研究报道。为此,本研究采用系统评价的方法对国内外HTA指南进行描述性分析,以期为我国HTA指南的科学制订提供参考和借鉴。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入标准 ①对象:HTA指南;②指南内容:涉及HTA 5项评估内容(技术特性、有效性、安全性、经济性及社会和伦理适应性)中2项以上的具体实施细节;③制订机构:国际级或国家级的指南制订机构、学术组织。
1.1.2 排除标准 ①针对具体技术的HTA指南(如《奥马珠单抗治疗先前治疗过的慢性自发性荨麻疹的卫生技术评估指南》);②HTA的质量评价指南;③针对技术特性的HTA指南(如《医疗器械经济学评估指南》);④HTA的国家体系建设指南;⑤最新指南的既往版本;⑥无法获取全文者。
1.2 检索策略
计算机检索PubMed、Embase、国际指南网络(Guidelines International Network,GIN)、政府和学术组织的相关网站,搜集HTA的相关指南。根据2015年世界卫生组织(WHO)对全球HTA的调查结果[4],检索已制订HTA指南的26个国家的政府及学术组织共83个官方网站,同时使用Google、百度等搜索引擎进行扩展检索。检索时限均为建库起至2020年4月。检索词包括“Health technology assessment”“Biomedical technology assessment”“Technology assessment”“HTA”“Guideline”“Handbook”。
1.3 文献筛选及资料提取
由两位研究者独立筛选文献并提取资料,然后交叉核对,若意见不一致则讨论,并请第三方协助判断。资料提取内容包括:①指南的基本特征,如指南题目、发表年份、国家或地区、制订机构、制订方法;②涉及内容,包括评估目的、评估主体、评估客体、评估流程、评估方法、評估内容、评估结果的应用、利益冲突等。
1.4 分析方法
采用描述性分析方法,比较并分析纳入指南的基本特征、涉及内容以及评估内容。采用Excel 2016软件进行数据处理及数量分布图绘制。
2 结果
2.1 文献检索结果
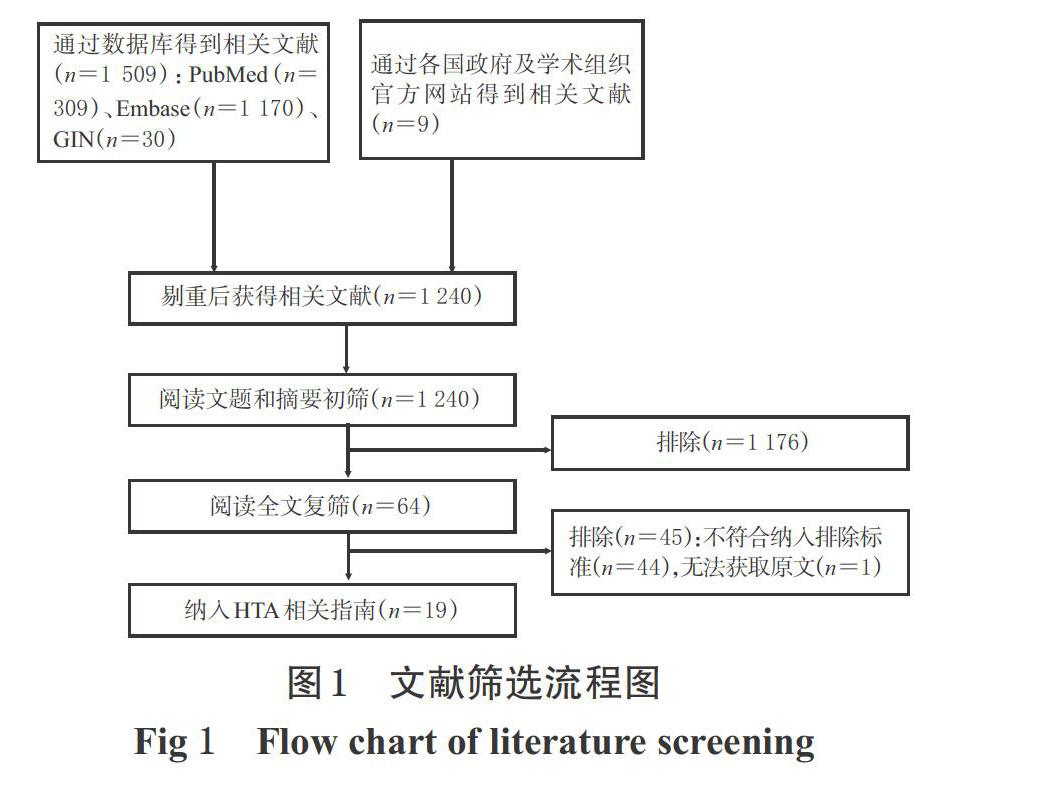
初检得到相关文献共1 518篇,去除重复文献后获得文献1 240篇,通过阅读文献题目、摘要和全文后,最终纳入符合标准的HTA指南19篇[5-23]。文献筛选流程见图1。
2.2 纳入指南的基本特征
纳入的19篇指南均发表于2001-2018年,其中有7篇指南[9,13-14,18-21]发表于2015年以后,占所有纳入指南的36.8%;除1篇指南[23]来自WHO以外,有14篇指南[5-12,14,16-18,20-21](占73.7%)来自欧洲,有2篇指南[19,22](占10.5%)来自北美洲,各有1篇指南(各占5.3%),来自南美洲[15]和亚洲[13];有11篇指南[6-10,14,16-19,22](占57.9%)的制订机构为学术组织,有8篇指南[5,11-13,15,20-21,23](占42.1%)的制订机构为卫生行政部门;有11篇[6-9,11,14-15,19-20,22-23](占57.9%)为循证指南,8篇[5,10,12-13,16-18,21] (42.1%)为非循证指南,详见表1。
2.3 指南涉及内容
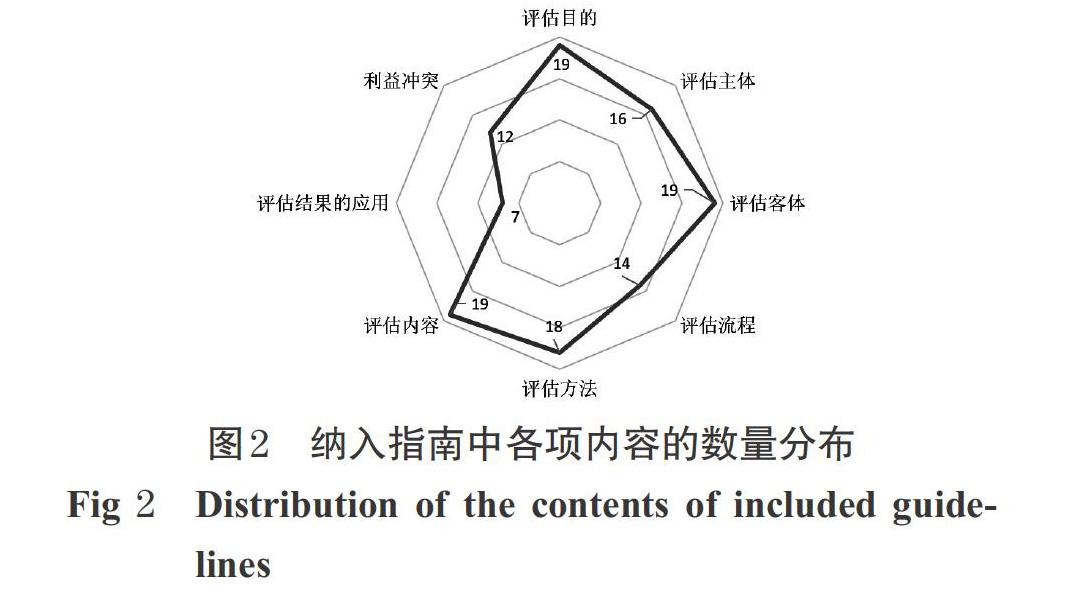
指南主要涉及8方面内容:评估目的、评估主体、评估客体、评估流程、评估内容、评估方法、评估结果的应用、利益冲突。其中,19篇指南均明确了其评估目的、评估内容和评估客体,18篇指南[5-11,13-23]明确了其评估方法(占94.7%),有16篇指南[5-12,15-19,21-23]明确了其评估主体(占84.2%),上述内容是实施HTA的关键点;其次,有14篇指南[5-11,13,15-16,18-19,21-22](占73.7%)明确了HTA评估流程,有12篇指南[6-7,9-10,13-15,18-22](占63.2%)提交了HTA评价中的利益冲突问题,而仅有7篇指南[5,13-14,18-19,21-22](占36.8%)提及关于评估结果的应用问题。纳入指南中各项内容的数量分布见图2。
2.3.1 评估目的
HTA的目的是为了得到有关HT的获益、成本-效益和潜在影响的最佳证据[22]。HT的利益相关者众多,不同评估主体开展HTA的目的不同。例如,印度尼西亚的HTA指南从卫生部、政府机构、保险公司、专业组织、教育机构、医疗机构、卫生服务专业技术人员、药品和医疗设备生产商多方面分析了开展HTA的目的,如对于卫生服务专业技术人员,该指南认为开展HTA将有助于该类人员获得是否可以使用某HT的证据[13]。
2.3.2 评估主体
由于各国的经济、政治、文化、法律和卫生体制等各不相同,各国HTA评估主体也不同。本研究纳入的19篇指南中的评估主体可分为如下3类:
(1)政府设立的评价机构。在一些发达国家,政府对医疗技术的监督管理力度较强,由政府设立评价机构对HT实施统一的评估和监督管理,通过设立国家级的HTA机构统一开展HTA,如CADTH[22]、OHTAC[19]、NICE[18]、瑞典卫生技术评估委员会[20]和德国卫生保健质量与效率研究所[14]等。
(2)政府委托组建的学术机构与研究团队。为了更高效地解决相关问题,同时规避由于非公共经费造成的研究偏性,逐步形成了由政府委托组建的学术机构开展评估的运作模式,如法国卫生高级权利机构[11]。
(3)独立的学术机构与研究团队。由医疗卫生研究机构、大学、研究机构等社会组织内部研究人员自发地针对特定的HT形成一定的项目团队,进行HTA的相关研究[24]。
2.3.3 评估客体
HTA的评估客体即HT。WHO将HT定义为:用于卫生保健和医疗服务系统的特定知识体系,包括药物、医疗器械、外科手术、服务提供模式、公共卫生干预措施、卫生材料、医疗方案、技术程序、后勤支持系统和行政管理组织,或泛指一切用于疾病预防、筛查、治疗和康复及促进健康、提高生存质量和生存期的技术手段[25]。本文纳入的19篇指南中,有13篇指南[5,9-15,17-18,20-22]评价对象为所有HT(占68.4%),2篇指南[6,16]评价对象为诊断技术、2篇指南[19,23]评价对象为医疗器械(各占10.5%),1篇指南[7]评价对象为药物和手术干预、1篇指南[8]为筛查技术、1篇指南[19]为医疗服务(各占5.3%)。
2.3.4 评估流程
HTA的评估流程主要包括3个主要环节:议题设定、专业评估和专家委员会审议及推荐,可细分为9个步骤:确定评估主题、确定评估的具体问题、确定评估方法、收集资料、评价证据、合成资料、得出结论及提出建议、宣传普及和后效评价[10,20,22],详见图3。
2.3.5 评估内容及方法
HTA的评估内容包括技术特性、有效性、安全性、经济性、社会和伦理适应性[16]。纳入的19篇指南中,所有指南的评估内容均包括了经济性,有18篇指南[5-19,21-23](占94.7%)包括了有效性,各有15篇指南包括了安全性[5-15,17,19,21,23]以及社会和伦理适应性[6-15,18-21,23](均占78.9%),有8篇指南[5-8,12-13,16,22]包括了技术特性(占42.1%)。纳入的HTA指南中各项评估内容的数量分布见图4。
(1)技术特性评估。技术特性指HT的操作特性及符合该技术在设计、组成、加工、耐受性、可靠性、易使用性和维护性等方面的规范,其评价方法尚未明确统一[13]。
(2)有效性和安全性评估。有效性指HT在实践应用过程中改善患者健康的能力;安全性是指在应用HT时,可能存在的风险(不良反应的发生率及其严重程度等)。其评估方法一般是系统评价或Meta分析等[13-14,17]。
(3)经济性评估。经济性评估包括微观经济性评估和宏观经济性评估。其中,微观经济性指某一HT的成本、价格、付费情况和支付水平等;宏观经济性指某一新技术对国家卫生总费用的影响,对卫生资源在健康领域中分配的影响及对门诊和住院患者的影响[14]。其评估方法包括:卫生经济学分析(如成本-效果分析、成本-效益分析、成本-效用分析和最小成本分析等)、产业经济分析、预算影响分析等[5,13,18]。
(4)社会和伦理适应性评估。HT的使用显然会影响人们生活的其他方面,包括社会、法律、道德等。社会性强调HT和社会环境之间的相互影响,例如社会的资源分配、技术的可获得性、患者的偏好、社会规范和价值观等。社会性常用以下方法进行审查或探索性评估:清单(Checklists)、文献综述(Leterature reviews)、参与式途径(Participatory approaches)和实证研究(Empirical research)[14]。而某些HT,如遗传学研究、辅助生殖技术、器官移植等,均涉及法律条例和社会规范,蕴含社会伦理问题,有必要对其社会和伦理适应性进行评估[22]。本研究纳入的19篇指南中伦理性评估没有统一的方法,但大都使用定性和定量方法在生物学、医学和其他领域进行基于证据的分析[9-11,15,19,21]。
2.3.6 评估结果的应用
HTA结果主要应用于3个方面:政策、决策和实践[23]。评估结果的应用与评估目的紧密结合,如国家层面的循证决策、医院的技术引进和临床诊疗技术的合理选择等。
2.3.7 利益冲突
虽有12篇指南[6-7,9-10,13-15,18-22]明确在开展HTA时应对利益冲突问题进行申明,但均未对如何管理和解决利益冲突问题进行阐述。在目前开展HTA的国家中,主要采用利益冲突申明和结果公开化的方式对评估过程进行监管。
3 讨论
HTA起源于20世纪70年代的美国,经过近50年的发展,现已成为全球广泛认可的评价方法[26]。作为较完善的科学评估体系,我国已探索将其應用于新医药技术准入、医疗保险支付范围确定、卫生技术管理等方面[27-29]。2014年第67届世界卫生大会(WHA)67.23决议中强调在卫生干预和技术评估领域,应酌情考虑制订国家方法和程序指南以及监测系统[30]。相关评估和研究的透明度、质量、政策适用性及HTA研究的科学开展均有赖于HTA指南的规范指导。本研究纳入的19篇指南,大多来自HTA发展较成熟的欧洲和北美洲国家,未检索到我国制订的HTA方法学指南。因此,借鉴国外高质量HTA指南的制订标准,结合我国人种、疾病负担及卫生资源条件,制订高质量证据支持的本土化指南是我国HTA方法学指南的发展方向[31]。
指南的制訂方法主要分为基于专家共识和基于循证医学证据两大类[32]。其中,循证临床指南是针对特定临床问题,依据现有的证据,经过系统研究后所发布的指导性文件,制订过程更加科学和严谨,故基于循证医学证据制订指南已逐渐成为指南制订的主要方法[33]。但本研究纳入的19篇指南中,有42.1%为非循证指南,说明循证方法在未来HTA方法学指南制订中的应用有待加强。
利益冲突是指南制订过程中潜在的重要偏倚来源,可能影响指南编写小组提出推荐意见的独立性[34]。评估结果的应用是HTA的最终目的和导向,是将HTA从理论运用于实际工作的必要指导。本研究纳入的19篇指南中较少涉及这两部分内容,提示我国在制订HTA方法学指南时应特别注意这两点。
此外值得一提的是,指南的推广使用与指南制订的方法同等重要。本研究纳入的19篇指南均未提及指南的推广使用,这将是未来指南制订时需重点考虑的内容之一。便捷的指南获取平台是指南推广使用的第一步,我国可适当增加现有的指南获取途径,并做好指南的宣传普及工作,如通过建立指南数据库以有效提高指南的可及性及利用率[35]。
4 结语
系统地使用证据来指导医疗保健决策,尤其是HTA,已获得越来越多的认可(如药品的宏观管理和临床用药决策等)。尽管目前各国在评估领域和具体流程等其他一些关键方面已开发出许多方法(如欧盟的HTA core model[9]),但HTA的使用和HTA开展的能力建设及决策方法等仍需要通过制订国家方法和程序指南进行规范。我国目前尚缺乏HTA方法学指南,可参考国外指南,建立符合我国国情且适用性较强的HTA方法学指南,为开展HTA研究提供科学指导。
参考文献
[ 1 ] WHO. Health technology assessment[EB/OL]. [2020-04-
08]. https://www.who.int/medical_devices/assessment/en/.
[ 2 ] 国务院.国务院关于促进健康服务业发展的若干意见[EB/OL].(2013-09-28)[2020-04-08]. http://www.gov.cn/xxgk/pub/govpublic/mrlm/201310/t20131018_66502.html.
[ 3 ] 2019年中国罕见病大会上发布《罕见病药物卫生技术评估专家共识(2019)》 [J].上海医药,2019,40(21):37.
[ 4 ] WHO. 2015 Global survey on health technology assessment by national authorities [EB/OL].(2015-10)[2020-
04-08]. https://www.who.int/health-technology-assessment/MD_HTA_oct2015_final_web2.pdf.
[ 5 ] Danish Centre for Health Technology Assessment(DACEHTA). Health technology assessment handbook[EB/OL].(2001)[2020-04-08]. https://www.sst.dk/~/media/ECAAC5AA1D6943BEAC96907E03023E22.ashx.
[ 6 ] European Network for Health Technology Assessment(EUnetHTA). HTA core model? for diagnostic technologies:version 1.0[EB/OL].(2008-12)[2020-04-08]. https://www.eunethta.eu/hta-core-model-for-diagnostic- technologies-1-0r/.
[ 7 ] European Network for Health Technology Assessment(EUnetHTA). HTA core model? for medical and surgical interventions:version 1.0 [EB/OL].(2008-12)[2020-04-
08]. https://5026.makemeweb.net/outputs/hta-coremodel-
medical-and-surgical-interventions-10r.
[ 8 ] European Network for Health Technology Assessment(EUnetHTA). HTA core model? for screening technologies:version 1.0 [EB/OL].(2011-09)[2020-04-08]. https://www.eunethta.eu/wp-content/uploads/2018/01/EUnetHTA-Core-Model-for-screening-technologies_first- draft-2011-sep.pdf.
[ 9 ] European Network for Health Technology Assessment(EUnetHTA). Joint action on HTA 2012-2015:HTA core model:version 3.0[EB/OL].(2016-01-25)[2020-04-08]. https://eunethta.eu/wp-content/uploads/2018/03/HTACoreModel3.0-1.pdf.
[10] European Observatory on Health Care Systems. Best practice in undertaking and reporting health technology assessments[EB/OL].(2002-02)[2020-04-08]. http://www.inahta.org/wp-content/themes/inahta/img/AboutHTA_Best_ Practice_in_Undertaking_and_Reporting_HTAs.pdf.
[11] Haute Autorité de Santé. General method for assessing health technologies[EB/OL].(2007-06)[2020-04-08]. https://www.has-sante.fr/plugins/ModuleXitiKLEE/types/
FileDocument/doXiti.jsp?id=c_541194.
[12] Health Information and Quality Authority(HIQA). Guidelines for stakeholder engagement in health technology assessment in Ireland [EB/OL].(2014-02-11)[2020-04-08].
https://www.hiqa.ie/sites/default/files/2017-01/HTA-Gui-
delines-Stakeholder-Engagement.pdf.
[13] Indonesian Health Technology Assessment Committee(INAHTAC). Health technology assessment(HTA)guideline[EB/OL].(2017)[2020-04-08]. http://adphealth.org/upload/resource/FINAL_HTA_ENG_-1.pdf.
[14] Institute for Quality and Efficiency in Health Care(IQWIG). General methods 5.0:benefit assessment[EB/OL].(2017-07)[2020-04-08]. https://www.iqwig.de/en/methods/methods-paper.3020.html.
[15] Ministry of Health of Brazil. Methodological guidelines:health technology assessment appraisals[EB/OL].(2009)
[2020-04-08]. http://bvsms.saude.gov.br/bvs/publicacoes/methodological_guidelines_technology_assessment_appraisals.pdf.
[16] National Institute for Health and Care Excellence(NICE). Diagnostics assessment programme manual[EB/OL].(2011-
12)[2020-04-08]. https://www.nice.org.uk/Media/Default/About/what-we-do/NICE-guidance/NICE-diagnostics-gui- dance/Diagnostics-assessment-programme-manual.pdf.
[17] National Institute for Health and Care Excellence(NICE). Guide to the methods of technology appraisal:2013[EB/OL].(2013-04-04)[2020-04-08]. https://www.nice.org.uk/process/pmg9/chapter/introduction.
[18] National Institute for Health and Care Excellence(NICE). Guide to the processes of technology appraisal[EB/OL].(2018-04)[2020-04-08]. https://www.nice.org.uk/Media/Default/About/what-we-do/NICE-guidance/NICE-tech- nology-appraisals/technology-appraisal-processes-guide- apr-2018.pdf.
[19] Ontario Health Technology Advisory Committee(OHTAC). Health technology assessments:methods and process gui- de:version 2.0[EB/OL].(2018-03)[2020-04-08]. https://www.hqontario.ca/Portals/0/documents/evidence/reports/hta-methods-and-process-guide-en.pdf.
[20] Swedish Agency for Health Technology Assessment and Assessment of Social Services. Assessment of methods in health care and social services:a handbook[EB/OL].(2018-04)[2020-04-08]. https://www.sbu.se/contentassets/76adf07e270c48efaf67e3b560b7c59c/eng_metodbok- en.pdf.
[21] The Agency for Health Technology Assessment and Tariff System. Health technology assessment guidelines:version 3.0[EB/OL].(2016-08)[2020-04-08]. https://www.aotm.gov.pl/www/wp-content/uploads/wytyczne_hta/2016/2016- 1104_HTA_Guidelines_AOTMiT.pdf.
[22] The Canadian Agency for Drugs and Technologies In Hea- lth(CADTH). Guidelines for authors of CADTH health technology assessment reports[EB/OL].(2003-05)[2020-
04-08]. https://www.cadth.ca/guidelines-authors-cadth-
health-technology-assessment-reports-0.
[23] World Health Organization (WHO). Health technology assessment of medical devices[EB/OL]. (2011-06) [2020-
04-08]. https://apps.who.int/iris/bitstream/handle/10665/44564/9789241501361_eng.pdf;jsessionid=0138BC99- FDD28021B00A005750B60A45?sequence=1.
[24] 唐檬,耿劲松,刘文彬,等.全球卫生技术评估发展的历史与经验[J].中国医院管理,2014,34(4):6-9.
[25] WHO. What is a health technology? [EB/OL]. [2020-04-
08]. https://www.who.int/health-technology-assessment/about/healthtechnology/en/.
[26] 王海银,何达,王贤吉,等.国内外卫生技术评估应用进展及建议[J].中国卫生政策研究,2014,7(8):19-23.
[27] 吕兰婷,王虎峰.我国药品支付价格形成及谈判定价中引入卫生技术评估的路径探讨[J].中国药房,2015,26(15):2020-2023.
[28] 彭雪莲.医院卫生技术评估在医用耗材管理中的应用探索[J].管理观察,2019(21):191-192.
[29] 赵紫楠,吕俊玲,李超,等.乙酰左卡尼汀预防和治疗糖尿病周围神经病变的快速卫生技术评估[J].临床药物治疗杂志,2019,17(6):11-13、45.
[30] WHO.为支持全民健康覆盖开展卫生干预和技术评估[EB/OL].(2014-05-24)[2020-04-08]. https://apps.who.int/gb/ebwha/pdf_files/WHA67/A67_R23-ch.pdf?ua=1.
[31] 张伶俐,李幼平,张川,等.中国儿童临床指南现状分析及循证临床指南评价[J].中国循证医学杂志,2011,11(9):991-999.
[32] Scottish Intercollegiate Guidelines Network(SIGN). SIGN 50:a guideline developers handbook[EB/OL].(2019)
[2020-04-08]. https://www.sign.ac.uk/assets/sign50_2019.
pdf.
[33] Institute of Medicine. Clinical practice guidelines we can trust[M]. Washington:National Academies Press (US),2011:109-137.
[34] 王洋洋,陳耀龙,王小琴,等.中医(中西医结合)临床实践指南制修订方法:利益冲突声明与管理[J].中华中医药杂志,2016,31(9):3613-3616.
[35] 龙囿霖,张永刚,李幼平,等.全球临床指南数据库功能特点及技术参数的比较研究[J].中国循证医学杂志,2018,18(3):254-262.
(收稿日期:2019-10-08 修回日期:2020-05-13)
(编辑:孙 冰)
