产ESBL高毒力肺炎克雷伯菌的耐药机制及分子流行病学分析
2020-07-01谢斌云刘媛张伟刘洋
谢斌云 ,刘媛 ,张伟 ,刘洋
(江西省南昌市第一医院,1.创伤急救中心EICU;2.儿科NICU;南昌大学第一附属医院,3.呼吸内科;4.检验中心,南昌330000)
肺炎克雷伯菌 (Klebsiella pneumoniae,KP)是临床常见肠杆菌科细菌之一依据细菌毒力和致病特点,可将肺炎克雷伯菌分为普通肺炎克雷伯菌(classic Klebsiella pneumoniae,cKP)和高毒力肺炎克雷伯菌 (hypervirulent Klebsiella pneumoniae,hvKP)。hvKP侵袭的宿主大部分为年轻健康的患者,且容易并发脓毒血症,导致坏死性筋膜炎、骨髓炎、化脓性肝脓肿、眼内炎等严重的侵袭性疾病[1]。同时多脏器感染也因其可继发迁徙性播散而存在,临床致残率及致死率高,预后差,近年来一直成为研究的热点[2]。随着头孢类抗生素的大量应用及滥用,产超广谱β-内酰胺酶(ESBL)也相继出现增多的情况,导致产ESBL的耐药菌谱出现交叉耐药问题。细菌耐药引发的医院感染爆发流行,感染性疾病治疗效果不佳,住院费用高,治疗时间长,严重影响了人类健康,已经成为21世纪我们不得不面临的公共卫生问题。而集毒力高、耐药性强于一身的产ESBL高毒力肺炎克雷伯菌或将成为下一个“超级细菌”。本研究对南昌大学第一附属医院2016年6月-2017年12月分离的产ESBL高毒力肺炎克雷伯菌进行分析,探讨耐药机制及分子流行病学等,旨在为抗感染治疗合理选用抗生素,预防和控制产ESBL耐药菌的出现和播散,研制新型、高效的β-内酰胺类抗生素以及流行病学研究提供实验依据和指导。
1 材料与方法
1.1 一般材料 收集2016年6月-2017年12月南昌大学一附医院就诊患者分离的KP,若同一位患者多次分离出相同的菌株,只留取首次分离的菌株为标准。采用VITEK-2生物分析仪自动鉴定菌株和药敏试验。使用拉丝试验确定高黏液表型特征,使用纸片法试验确认ESBL表型。按l:1的比例各收集产ESBL酶hvKP、非产ESBL酶hvKP感染的患者的病历资料,将上述45例产ESBL酶hvKP感染的患者记为病例组A组。对照组B组为随机抽取的45例非产ESBL酶hvKP感染的患者。质控菌株为肺炎克雷伯菌ATCC700603和大肠埃希菌ATCC25922,均购买于卫生部临床检验中心。
1.2 黏液丝试验 将细菌接种在5%绵羊血平板上,37℃培养16h后,用细菌接种环轻柔向上挑起平板上的肺炎克雷伯菌菌落,重复牵拉两次或两次以上,如果挑起的黏液丝长度大于或等于5 mm,判为黏液丝试验阳性,反之则结果判读为黏液丝试验阴性。
1.3 产ESBL肺炎克雷伯菌进行表型确证试验 推荐的纸片进行ESBL确证试验,选取对三代头孢菌素(头孢曲松、头孢噻肟)耐药作为ESBL初筛标准,并记录 ESBL阳性菌株分离率。将受试菌配成 0.5麦氏浊度菌液,用无菌棉棒挑取涂于MH琼脂上,贴上头孢他啶,头孢他啶/克拉维酸,头孢噻肟,头孢噻肟/克拉维酸纸片在有待测菌的琼脂培养基上,置于 35℃,16-18h后观察结果,两组中任何一组药物,加克拉维酸与不加克拉维酸的抑菌圈相比,增加5 mm以上者,即判断为ESBL菌株。
1.4 药敏试验 采用Vitek 2 Compact全自动微生物鉴定及药敏系统检测,采用纸片扩散法测定试验菌株对抗菌药物的敏感性,抗菌药物纸片分别为:头孢噻肟(CTX)、头孢吡肟(FEP)、头孢西丁(FOX)、亚胺培南(IPM)、头孢他啶(CAZ)、氨曲南(ATM)、美罗培南(MEM)和厄他培南(ERT)及ESBL表型鉴定纸片头孢噻肟/克拉维酸(CTX/CA)、头孢他啶/克拉维酸(CAZ/CA)。参照CLSI标准进行实验操作和结果判断。
1.5 模板提取及PCR扩增条件 使用煮沸法提取临床各种标本中分离出的肺炎克雷伯菌菌株DNA,PCR 的反应体系为 25μl: 正反引物各 0.5μl,DNA模板 3μl,mix 反应液 12.5μl,加蒸馏水使反应总体积为25μl,用无菌去离子水作为阴性对照。反应条件 : 预 变 性 95℃ 5min;95℃ 45s,56℃ 90s,72℃90s,30 个循环;延伸 72℃ 10min。
1.6 产ESBL的高毒力肺炎克雷伯菌PCR鉴定将得到的PCR模板 (高毒力肺炎克雷伯菌DNA)进行扩增,12.5μl扩增体系:Taq Mix:6.25μl, 上游引物:0.25μl,下游引物:0.25μl,模板:1.5μl,ddH20:4.25μl;PCR 的反应条件:95℃预变性 5min,后 94℃变性 40s,52℃退火复性 30s,72℃延伸 1min 进行30个循环,最后72℃延伸10min。移液枪吸取6.5μlPCR扩增产物后加入1%琼脂糖凝胶上样孔中,120 V,电泳25 min,电泳液为 1×TAE缓冲液,电泳结束后在凝胶成像仪上观察结果,记录结果。
1.7多位点序列分析 (MLST)引物设计与合成:从PUBMLST 网站(http://pubmlst.org/koxytoca/info/K_oxytoca_primers.pdf)上查询肺炎克雷伯菌多位点序列分型7对管家基因,引物参照相关文献[3],引物由上海生工公司合成。
1.8 脉冲场凝胶电泳 (PFGE)用低熔点琼脂糖包埋细菌,做成琼脂糖胶块;用细胞裂解液和蛋白酶K消化,使得 DNA被释放到细胞外;大片段的DNA用限制性内切酶消化;制备好的样品按照设计好的程序电泳;电泳的结果通过染色后被读取,通过相关软件进行数据的分析。
2 结果
2.1 药敏实验结果 结果显示:所有菌株对氨苄西林天然耐药,产ESBL酶hvKP菌对头孢他啶、头孢噻肟、头孢西丁、哌拉西林/他唑巴坦、头孢吡肟、厄他培南、亚胺培南、美罗培南、左氧氟沙星、环丙沙星、氨苄西林/舒巴坦的耐药率显著高于不产ESBL酶hvKP菌株(P<0.05),然而在阿米卡星、庆大霉素、妥布霉素的耐药率上差异无显著意义 (P>0.05),见表 1。
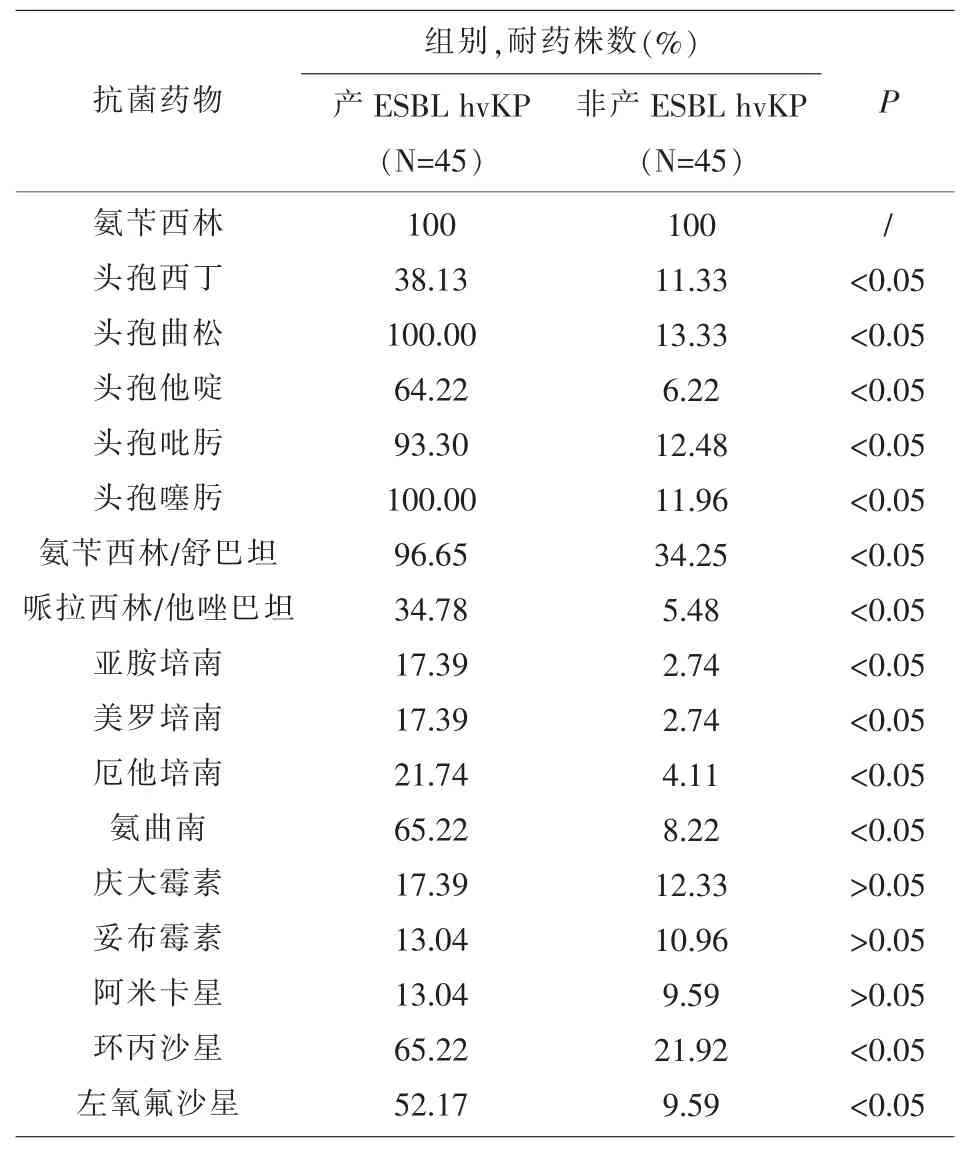
表1 产ESBL hvKP菌株和非产ESBL hvKP菌株对抗菌药物的耐药率的比较
2.2 ESBL的高毒力肺炎克雷伯菌普通PCR鉴定结果 从临床分离的1263株肺炎克雷伯菌中筛出高毒力肺炎克雷伯菌株124株,其中K1荚膜血清型阳性85株,K2荚膜血清型阳性39株。在124株高毒力肺炎克雷伯菌中,表型试验显示45株为ESBL阳性hvKP菌株,79株为ESBL阴性hvKP菌株。经过表型试验确定出的产ESBL高毒力肺炎克雷伯菌株45株均携带ESBL基因,其中 blaTEM基因阳性22株,占48.9%;blaSHV基因阳性13株,占28.9%,其中7株为blaSHV-1型,6株为blaSHV-12型,其中一株同时携带blaSHV-1型和blaSHV-12型ESBL基因。bla CTX‐M基因阳性10株,占22.2%,见表 2。

表2 产ESBL高毒力肺炎克雷伯菌PCR扩增相关基因引物
此外,我们还发现部分ESBL相关基因可共存于同一菌株中,如表2.5所示,我们发现blaCTXM-1和blaTEM共存于一株K1型菌株中,另外还发 现 blaSHV-12+blaCTX-M-2、blaCTX-M-8+blaSHV-1+blaTEM、blaCTX-M-2+blaSHV-1+blaTEM、blaCTX-M-9+blaSHV-12+blaTEM、blaCTX-M-2+blaSHV-1+blaSHV-12共存的菌株各一株,且均为K2荚膜血清分型,这或表明K2型hvKP菌在获得性耐药上更具优势。
2.3 MLST分型结果 产ESBL酶hvKP菌株共45株,其中K1荚膜血清型阳性28株,K2荚膜血清型阳性17株。K1荚膜血清型阳性菌株均为ST23型,而17株K2型产ESBL酶hvKP菌株中10株为ST65型,5株ST86型,2株ST14型。而携带ESBL基因的产ESBL酶hvKP则主要为ST23型、ST65型,见表3。
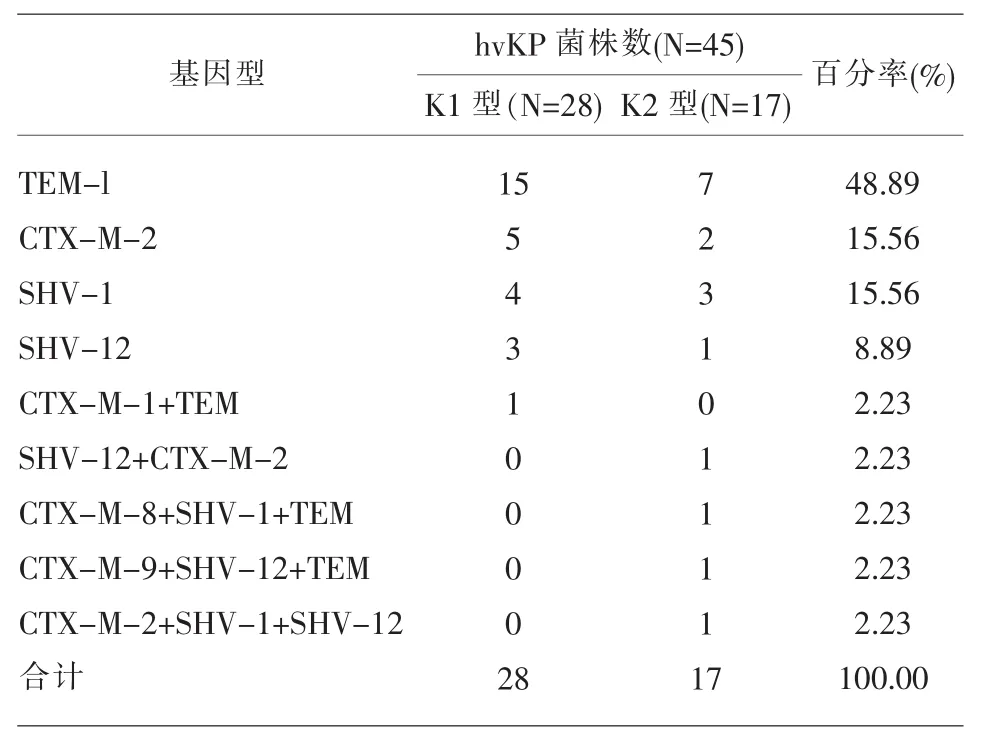
表3 ESBL阳性hvKP菌株ESBL相关基因的基因型分布
2.4 PFGE结果 45株产ESBL酶hvKP菌株经PFGE得到电泳图谱。将具有85%以上相同条带(相关系数>0.85)的菌株归入同一带型,45株产ESBL酶hvKP菌株被分为6个型别:A型[71.1%(32/45)]、C 型[20.0%(9/45)],B 型、D 型、E 型、F 型各1株。A型、C型为主要型别。其中A型进一步分为 3个亚型,A1型 [31.1%(14/45)]、A2型[35.6%(16/45)]A3 型[4.5%(2/39)]。
3 讨论
肺炎克雷伯菌 (Klebsiella pneumoniae,KP)广泛存在于自然界及机体中。人体的皮肤、呼吸道和消化道等部位均寄存着该细菌,当人体抵抗力下降时,免疫力低下,常引起机体出现多种感染,如肺炎、肝脓肿、败血症等等。在血琼脂平板上生长,hvKP菌株可表现出高黏液性,研究[4-6]发现,hvKP表现为高毒力主要是携带有黏液表型调节基因和气杆菌素。依据细菌抗原性不同以及荚膜多糖结构的异常,肺炎克雷伯菌可分为至少82个荚膜血清型[6],其中,Kl、K2、K5、K20、K57 和 K54 血清型与人类及动物的各种侵袭性感染密切相关,为高毒力荚膜血清型肺炎克雷伯菌[7-9]。因新的抗生素的大量应用甚至滥用,耐药问题也随之凸现,产ESBLs是细菌产生多重耐药的常见表型机制,具体耐药根因可以从基因层面分析。这其中肺炎克雷伯菌是最常见的产ESBL菌株,常引起医院感染暴发流行,给医院管理及疾病诊治带来非常棘手的困难。现阶段,无论是人类还是动物界,抗生素的使用过于频繁,抗生素耐药性问题越发严重。特别是头孢类抗生素的大量应用及滥用,产超广谱β-内酰胺酶(ESBL)也相继出现增多的情况,导致产ESBL的耐药菌谱出现交叉耐药问题。
高毒力肺炎克雷伯菌的出现给临床感染带来了新的挑战,其改变了对经典肺炎克雷伯菌感染的诊治及流行。然而高毒力肺炎克雷伯菌在体外常表现出对除了氨苄西林外的其他抗生素高度敏感,故仍对其有相应的治疗对策[10]。但随着耐药的广泛流行,尤其是在各种抗生素滥用的情况下,抗生素耐药已经成为影响临床感染治疗效果的重要因素。而此时,高毒力肺炎克雷伯菌也无法幸免。超广谱β内酰胺酶是肠杆菌科细菌最常见的β内酰胺酶,其常常是导致肠杆菌科细菌β内酰胺类抗生素耐药的重要原因。超广谱β内酰胺酶根据同源性可分为TEM型、SHV型和CTX-M型等,其中前两型最多见,世界范围流行,我国以CTX-M型为主,而在本试验中,我们却发现hvKP菌株中主要为TEM和SHV型ESBL,这与以往的经典肺炎克雷伯菌报道不一致,或许与高毒力肺炎克雷伯菌独特的耐药发展特点有关。此外我们还发现hvKP菌株中同常常存在多种β内酰胺酶共存的情况,且多集中在K2型高毒力肺炎克雷伯菌中,这或许与K2型菌株的毒力相对较低有关[11],这也表明K2型高毒力肺炎克雷伯菌或将成为高毒力肺炎克雷伯菌发展多重耐药的重要突破口,也为我们监测高毒力高耐药肺炎克雷伯菌形成和发展提供了重要依据。由此可见,产ESBL酶的hvKP菌株的出现或给我们敲响了对高毒力肺炎克雷伯菌滥用抗生素治疗警钟,其中部分ESBL基因可通过质粒介导传播、且集中在流行的克隆株上,也给我们的院感控制敲响了警钟。加强对产ESBL酶hvKP菌株监测及相关研究,为未来控制高毒力高耐药肺炎克雷伯菌这一“超级细菌”的传播提供理论依据。
与之前的研究文献观点有一致性[12-15],本研究中K1血清学肺炎克雷伯菌的MLST分型主要以ST23型为主,K2血清学肺炎克雷伯菌主要以ST65型为主,在分子流行病学上,我们也发现虽然hvKP菌株的流行相对集中,以MLST分型结果看,K1型hvKP菌株主要集中在ST23型,但也存在少部分ST700型。相反,K2型hvKP菌株则略显多态性,主要包括ST65型、ST86型及ST14型。而在耐药基因携带上,我们发现所有ESBL基因阳性菌株主要集中在ST23型、ST65型及ST14型。本研究结果显示本院分离出的产ESBL酶hvKP菌株的PFGE带型相似性表现的比较明显,提示本院各科室间产ESBL酶hvKP菌株或存在同类细菌的相关性传播,鉴于此类现象,加强医院感染预防措施和严格控制感染源及切断传播途径意义重大,按无菌操作流程、接触感染患者前后加强手卫生、强化消毒隔离制度等等措施应严格执行,最终将医院感染的发生率降到最低。
