布鲁氏菌S2、M5 及A19 疫苗免疫羊抗体消长规律研究
2020-07-01孙晶晶吴锦艳曹小安尹双辉周建华李学瑞刘永生尚佑军
孙晶晶,吴锦艳,曹小安,陈 妍,尹双辉,周建华,兰 喜,李学瑞,刘永生,尚佑军
(中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室/农业部畜禽病毒学重点开放实验室,甘肃 兰州 730046)
布鲁氏菌病(Brucellosis)是由布鲁氏菌(Brucella)引起的以家畜为主的多种动物互为传染源的一种严重的人畜共患传染病[1]。临床特征是生殖系统受到严重侵害,在雌性动物中常导致流产和繁殖生育力下降,在雄性动物中会导致睾丸炎和附睾炎并常发展为不育症。在家畜中羊、牛和猪最易感染发生布鲁氏菌病,其中羊种的致病力最强。对人也具有高度感染性和致病性,患病症状常表现为持续性感染、间歇性流感样症状,称作“波状热”,严重者失去劳动力[2]。人感染该病还表现为长期发热、多汗、关节痛、神经痛及肝脏、脾脏肿大等症状,严重威胁着人的生命健康[3]。OIE 将其列为B 类动物疫病,该病流行范围广泛,遍及世界各地。据报道家畜中存在该病的国家和地区有170 多个,其中123 个国家和地区的人有该病感染发生,布鲁氏菌病是一种世界各地广泛流行的人兽共患慢性细菌传染病[4]。近年来,我国布鲁氏菌病疫情强势走高,患病人数逐年上升,每年约有50 万人受到感染,严重危害人类健康[5]。近年我国动物布鲁氏菌病出现新的流行趋势,即疫区从牧区向农区及城市蔓延,以点状散发或点状暴发流行[6],因此加强该病的防控势在必行。
我国常用的布鲁氏菌疫苗主要有3 种,分别是猪种S2、牛种A19 和羊种M5 疫苗。牛种A19 疫苗在国外使用广泛并取得良好的免疫效果,如免疫保护率达65%~75%且菌株稳定、病原性低、免疫原性较高和不易引起怀孕母牛流产等优点。羊种M5 疫苗的免疫原性好,气雾免疫是其免疫的最佳选择方式,免疫保护期可达一年,但该疫苗是我国目前使用的疫苗中毒力最强的毒株,易引起动物体内毒力过高,造成怀孕动物大批流产而导致严重的经济损失[7]。猪种布鲁氏菌S2 株是目前已知毒力最弱的光滑型布鲁氏菌疫苗株,其LPS 中的O 抗原刺激机体产生的抗体会干扰常规血清学诊断,无法鉴别疫苗接种动物和自然野毒感染动物[8],只能通过疫苗存续时间来鉴别。由于其毒力较弱,可以通过口服和肌肉注射等方式进行免疫,且不会导致母畜流产,因此S2疫苗在我国使用比较广泛[9]。目前,我国牛羊布鲁氏菌病防控工作不容乐观,疫苗在使用过程中存在各种问题,防控工作难以顺利实施。此外,缺少成熟的定性检测方法鉴别疫苗免疫动物和自然感染动物,当前仅可通过疫苗免疫动物和感染强毒菌动物抗体的存续时间进行鉴别,关于疫苗免疫绵羊后的抗体消长规律缺乏系统的数据支撑。因此,本实验通过对这3 种商品化布鲁氏菌疫苗和不同免疫方式对羊群产生的免疫效果进行了初步研究,为布鲁氏菌病防控寻找一种免疫效果稳定、方法简便、经济成本低的合理的疫苗免疫程序提供科学依据。通过对羊免疫后的抗体进行系统全面检测,不仅可以全面分析不同疫苗免疫机体后的抗体消长规律,还可以更清晰的反映出布鲁氏菌病防控工作中存在的问题及现有工作中起突出作用的防控措施,为未来制定布鲁氏菌病防控策略和综合防控措施提供参考依据。
1 材料与方法
1.1 疫苗、血清及主要试剂 S2 冻干活疫苗购自金宇保灵生物药品有限公司(批号4393039);A19 冻干活疫苗购自重庆澳龙生物制品有限公司(批号20141001);M5 冻干活疫苗购自青海生物药品厂(批号YW201503);均在有效期内使用。布鲁氏菌SAT抗原及标准阴、阳性血清购自中国兽医药品监察所(批号201501);布鲁氏菌RBPT 抗原购自中国兽医药品监察所(批号201503);布鲁氏菌IgM 抗体ELISA检测试剂盒、布鲁氏菌IgG 抗体ELISA 检测试剂盒和布鲁氏菌总抗体ELISA 检测试剂盒由中国农业科学院兰州兽医研究所提供,由于目前,国内没有针对布鲁氏菌IgM 和IgG 抗体的ELISA 检测试剂盒,所以使用本实验室研发的布鲁氏菌IgM 和IgG 抗体定量检测ELISA 试剂盒。
1.2 实验动物 小尾寒羊是由内蒙古临河区某羊场提供,选取3 月龄~6 月龄隔离饲养身体健康的羔羊,在免疫前采血分离血清经虎红平板凝集试验(RBPT)和试管凝集试验(SAT)检测结果均为阴性。实验羊群除接种本实验中所需的疫苗外,不接种其它任何疫苗。
1.3 实验设计 将270 只小尾寒羊羔羊随机分为5个组,分别是M5 疫苗皮下注射组(70 只)、M5 疫苗口服组(70 只)、S2 疫苗口服组(70 只)、A19 疫苗皮下注射组(30 只)和对照组(30 只)。设计A19 疫苗皮下注射组是因为A19 疫苗通常用于牛布鲁氏菌病的预防,通过采用皮下注射途径免疫,本实验采用皮下注射A19 疫苗免疫羊,研究该免疫方式对预防羊布鲁氏菌病的可行性。设计S2 疫苗口服组是因为该疫苗的说明书介绍对小尾寒羊不能采用注射方式免疫,因此本实验采用口服S2 疫苗免疫羊,研究该免疫方式对预防羊布鲁氏菌病的免疫效果。本实验组疫苗免疫的剂量严格按照说明书进行操作,对照组采用相同剂量的生理盐水进行免疫。实验羊免疫程序见表1。

表1 实验设计Table 1 Experimental design
1.4 疫苗免疫后IgM抗体消长规律测定 对羔羊采用不同的疫苗免疫接种,分别在免疫后0、7 d、14 d、21 d、28 d、45 d 和60 d 采血分离血清,并置于-20 ℃冰箱保存备用。实验结束后采用夹心ELISA 方法[10]同时检测所有血清样品中IgM 抗体水平并绘制其抗体消长曲线。
1.5 疫苗免疫后IgG 抗体消长规律测定 按照实验设计表1 的免疫程序,在免疫羔羊后0、7 d、14 d、21 d、28 d、45 d和60 d采血分离血清,并置于-20 ℃冰箱保存备用。实验结束后采用竞争ELISA 方法[11]同时检测所有血清样品中IgG 抗体水平并绘制其抗体消长曲线。
1.6 疫苗免疫后抗体持续期测定 将4 组实验组于免疫羔羊后0、7 d、14 d、21 d、28 d、45 d、60 d、75 d、90 d、110 d 和150 d 采血分离血清,并置于-20 ℃冰箱保存备用。实验结束后采用RBPT 和阻断ELISA 方法[12]同时检测所有血清样品中抗体转阳率并绘制其变化曲线。
1.7 数据统计 采用SPSS17.0 软件进行分析和处理数据,对各组间平均IgM 和IgG 抗体水平采用非参数检验法(Nonparametric tests)进行显著性差异分析。
2 结 果
2.1 疫苗免疫后IgM 抗体消长规律 羔羊接种疫苗前检测不到相应IgM 抗体。不同疫苗免疫羔羊经夹心ELISA 方法检测后4 组实验组IgM 抗体水平呈逐渐上升的趋势,但各组之间IgM 抗体水平上升速度与峰值之间存在显著差异(p<0.01)。A19 皮下注射组和M5 皮下注射组在免疫7 d 时IgM 抗体水平均达到峰值后逐渐下降,S2 口服组和M5 口服组则在免疫14 d 时IgM 抗体水平均达到峰值后逐渐下降,A19 皮下注射组在60 d 时还可以检测IgM 抗体,而M5 皮下注射组、S2 口服组和M5 口服组则在60 d 时已经检测不到IgM 抗体(图1)。统计学分析结果显示,疫苗免疫后,M5 皮下注射组、A19 皮下注射组、S2 口服组与对照组间抗体水平差异显著(p<0.05),但M5 口服组与对照组间差异不显著(p>0.05)。M5 皮下注射组与M5 口服组间抗体含量差异显著(p<0.05),M5 皮下注射组、A19 皮下注射组和S2 口服组间差异不显著(p>0.05)。表明IgM 抗体水平最高的是A19 皮下注射组,其次是M5 皮下注射组,M5 口服组抗体水平最低。
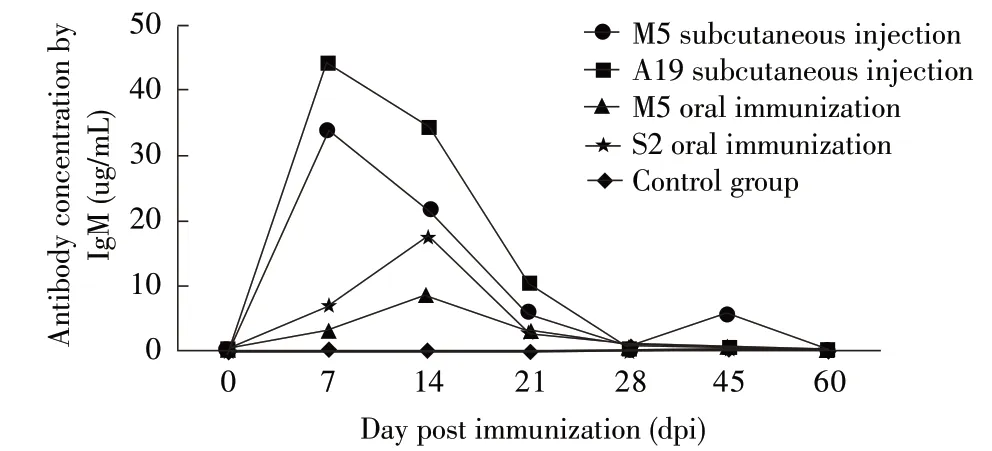
图1 不同组羔羊疫苗免疫后布鲁氏菌IgM 抗体消长规律检测结果Fig.1 Growth and decline of IgM antibody agains Brucella after immunization with different groups of lamb vaccines
2.2 疫苗免疫后IgG 抗体消长规律 羔羊接种疫苗前测不到相应IgG 抗体。不同疫苗免疫羔羊后经竞争ELISA 方法检测结果显示,实验组IgG 抗体水平呈逐渐上升的趋势,但各组之间IgG 抗体水平上升速度与峰值之间存在显著差异(p<0.01)。M5 皮下注射组和S2 口服组在免疫7 d 时IgG 抗体水平均达到峰值,且M5 疫苗产生IgG 抗体水平高于S2 疫苗,在28 d 时M5 疫苗产生IgG 抗体水平又逐渐上升,S2疫苗产生的IgG 抗体则持续降低。A19 皮下注射组于免疫14 d 时IgG 抗体水平达到峰值约800 μg/mL,之后IgG 抗体水平逐渐下降,在免疫21 d 时A19 皮下注射组IgG 抗体水平又逐渐上升,在28 d 时达到高峰约700 μg/mL,然后逐渐下降。M5 口服组疫苗免疫后IgG 抗体水平逐渐上升,在28 d 时达到峰值约370 μg/mL,然后IgG 抗体水平逐渐下降,在60 d时IgG 抗体水平下降到约100 μg/mL(图2)。统计学分析结果显示,疫苗免疫后,M5 皮下注射组、M5口服组、A19 皮下注射组、S2 口服组与对照组间抗体含量差异显著(p<0.05),M5 皮下注射组、A19 皮下注射组、S2 口服组与M5 口服组间抗体含量差异显著(p<0.05),但M5 皮下注射组、A19 皮下注射组和S2 口服组间差异不显著(p>0.05)。表明IgG 抗体水平最高的是M5 皮下注射组,其次是S2 口服组,M5 口服组抗体水平最低。

图2 不同组羔羊疫苗免疫后布鲁氏菌IgG 抗体消长规律检测结果Fig.2 Growth and decline of IgG antibody against Brucella after immunization with different groups of lamb vaccines
2.3 疫苗免疫后抗体持续期试验结果 不同疫苗免疫羔羊后经RBPT 和阻断ELISA 方法检测结果显示,不同疫苗免疫组抗体转阳率逐渐升高后,随时间延长抗体转阳率呈逐渐下降的趋势。M5 皮下注射组采用RBPT 检测则在免疫14 d 时抗体转阳率达到峰值为67%,采用阻断ELISA 方法检测在免疫7 d 时抗体转阳率达到峰值为71%(图3A),而M5口服组采用RBPT 检测则在免疫14 d 时抗体转阳率达到峰值为41%,采用阻断ELISA 方法检测在免疫21 d 时抗体转阳率达到峰值为37%(图3C),表明M5 疫苗皮下注射抗体转阳率高于M5 口服组。A19 皮下注射组在免疫14 d 时经RBPT 和阻断ELISA方法检测抗体转阳率达到峰值均为56%(图3B),A19 皮下注射组在免疫14 d~60 d 内抗体都维持在较高的水平,表明A19 疫苗可以用于预防羊布鲁氏菌病。S2 口服组在免疫14 d 时经RBPT 和阻断ELISA 方法检测抗体转阳率均达到峰值分别为45%和38%(图3D),表明S2 口服组抗体转阳率明显高于M5 口服组。M5 皮下注射组、M5 口服组、A19 皮下注射组和S2 口服组在免疫150 d 时部分个体还可以检测抗体水平,则表明4 组实验组抗体水平持续期大约为150 d。

图3 不同组羔羊疫苗免疫后布鲁氏菌抗体转阳率变化检测结果Fig.3 Changes of the transformation rate of Brucella antibodies after immunization with different groups of lamb vaccines
3 讨 论
布鲁氏菌是革兰氏阴性菌兼性细胞内寄生的细菌,具有独特的细胞内生存和免疫的机制,是一种自然疫源性疾病。根据免疫学理论,布鲁氏菌自然感染或人工免疫后,在动物体内首先产生IgM 抗体,随后IgG 抗体水平逐步升高达到较高的水平并维持整个感染的过程。
已有研究证实,RBPT 主要检测IgG 类抗体,具有较高的敏感性,适用于大规模普查。SAT 是以检测IgM 类抗体为主,对IgG 类抗体几乎不敏感,因此可以作为早期诊断[13],羊在感染布鲁氏菌后,会刺激机体产生免疫应答反应,从而激发体液免疫和细胞免疫。体液免疫是机体适应性免疫应答中的重要组成部分,在防御外来病原入侵方面发挥着重要的作用,而细胞免疫对于胞内寄生菌的清除起着主要作用[14]。目前认为,在布鲁氏菌疫苗免疫预防中,疫苗接种后通过特异性抗体检测评价免疫效果,但是布鲁氏菌病的免疫保护主要体现在细胞免疫水平,免疫抗体水平的检测只是对疫苗是否免疫成功的一个反应指标,因此抗体水平与畜群机体保护力不呈正相关[15]。弄清不同布鲁氏菌疫苗其抗体的消长规律及疫苗本身特性,可为制定合理的免疫程序提供重要依据,也为疫苗生产以及致病机制研究提供参考依据。
本研究采用不同的布鲁氏菌疫苗对小尾寒羊进行免疫试验,通过分析免疫抗体水平表明,羔羊皮下注射法免疫M5 疫苗后产生IgM 抗体、IgG 抗体及抗体转阳率明显高于口服法,其抗体维持时间明显长于口服法,发现M5 疫苗皮下注射比口服要更早产生IgM 和IgG 抗体,刺激机体更早产生免疫应答,表现出良好的抗原性和免疫效果。与鲁志平等报道羊经M5 疫苗口服免疫后,在第7 d 平均效价达到最高并达到峰值的研究成果有所差异。这可能与羊的品种和地域不同有关,需要进一步验证。本实验采用皮下注射A19 疫苗免疫羊,研究该免疫方式对预防羊布鲁氏菌病的可行性。根据对羔羊使用A19 疫苗的免疫效果监测分析表明,A19 疫苗在免疫7 d~14 d 时IgM 和IgG 抗体水平快速达到峰值,其抗体转阳率在免疫14 d~60 d 内都维持在较高的水平,可以刺激机体更早产生免疫应答,可以广泛用于羊的布鲁氏菌病免疫预防。这与冯宇研究A19 疫苗注射奶牛后在免疫15 d 时IgM 和IgG 抗体水平达到峰值的研究结果相似。羔羊口服免疫S2 疫苗后产生IgM 抗体、IgG 抗体及抗体转阳率明显高于口服M5 疫苗,其对小尾寒羊的抗体持续期约为5 个月,发现口服S2 疫苗比口服M5 疫苗要更早产生IgM 和IgG 抗体,刺激机体更早产生免疫应答,表现出良好的抗原性和免疫效果。本研究结果中,S2 疫苗免疫羊后在14 d 血清抗体水平达到峰值。根据抗体水平初步证明,A19 疫苗可以用于羊布鲁氏菌病的免疫,皮下注射M5 疫苗的免疫效果最好,口服S2 疫苗免疫效果优于口服M5 疫苗。结果提示在临床免疫工作中应根据疫苗本身的特性及流行特点,选择具有良好免疫原性的疫苗及合适的免疫途径。从检测方法来看,RBPT 和ELISA 方法检测抗体阳性率曲线基本一致,但ELISA 检出的阳性数高于RBPT。原因可能与ELISA 是以检测血清抗体总抗体为主,而RBPT 则以IgG 抗体为主有关。因此,建议在大量样本检测时首先使用RBPT 进行初检,对疑似阳性的用ELISA 进行复检以保证检测结果准确可靠。
综上所述,A19 疫苗能够有效刺激机体产生较高的抗体,M5 疫苗皮下注射免疫效果明显优于口服免疫,S2 株疫苗因免疫方式的局限,所以抗体水平明显低于前两者,但因其适用宿主广泛、毒力弱,所以在我国预防动物布鲁氏菌病时广泛使用的布鲁氏菌疫苗主要为S2 株。由于活疫苗主要产生细胞免疫,口服免疫主要产生黏膜免疫和细胞免疫,血清抗体水平不是判断疫苗保护效率的唯一因素,所以肌肉注射的实际免疫效果是否优于口服免疫尚不确定。而3 种疫苗单次免疫虽然抗体产生很快,但抗体存续时间较短,须经过加强免疫才能达到较好的免疫保护力。在布鲁氏菌病控制和防控工作中,选择具备良好免疫原性的疫苗接种易感动物,根据疫苗的特性及本研究中不同种疫苗接种动物后的抗体消长情况制定合理的免疫程序,推广快速、敏感、简便的检测方法,对于尽快控制布鲁氏菌病的流行,减少因布鲁氏菌病对畜牧业、旅游业及贸易中导致的经济损失,降低对人类的感染风险起至关重要的作用。
