一种基于VP0 蛋白检测DHAV(1 型和3 型)血清抗体的间接ELISA 的建立及应用
2020-07-01戚海惠张文晶陈浩田张雪莲张桂红王君伟
马 波,戚海惠,张文晶,陈浩田,张 琪,常 蕊,刘 悦,张雪莲,张桂红,王君伟
(1.东北农业大学 动物医学学院,黑龙江 哈尔滨 150030;2.华南农业大学 兽医学院,广东 广州 510642)
鸭病毒性肝炎(Duck viral hepatitis,DVH)是由鸭甲肝病毒(Duck hepatitis A virus,DHAV)和鸭星状病毒(Duck astrovirus,DAstV)引起雏鸭的一种传播迅速、高度致死的病毒性疾病[1]。DHAV属于小RNA病毒科禽肝病毒属成员,其成员按照基因型分为A、B、C型,分别对应传统的DHV-I、台湾新型DHAV 和韩国新型DHAV,该3 型 也 分 别 称 为DHAV-1、DHAV-2 和DHAV-3,各型间无交叉保护或弱交叉保护[2-4]。我国DVH 主要由DHAV-1 和DHAV-3 引起,且生产实践中常发生DHAV-1 和DHAV-3 的混合感染[5-7],因此对DVH 的防控重点就是控制DHAV-1 和DHAV-3 的流行,而血清抗体的检/监测对于了解疫病的流行情况和制定合理的免疫程序尤为重要。
ELISA 是血清抗体检测简单而准确的方法,目前建立了多种以DHAV 重组结构蛋白或纯化的全病毒为包被抗原的ELISA 抗体检测方法。DHAV 含有VP0、VP1、VP3 3 种结构蛋白,且均具有抗原性,其中VP1 是主要保护性抗原,同时VP1 也是DHAV不同病毒株间高度变异的区域[4,8],而VP0 和VP3 则相对保守[2]。鉴于以上特点以重组VP1 蛋白为检测抗原的ELISA 方法相对较多,Liu Ming[9]、张蕾[10]、卿莉[11]、银凤桂[12]、马秀丽[13]等分别建立了以DHAV-1 VP1 为诊断抗原的检测其同型抗体的ELISA方法及cELISA方法,杨发龙建立了以DHAV-3 VP1为诊断抗原的检测其同型抗体的ELISA 方法,但该方法与DHAV-1 抗体存在交叉反应,其可能作为检测DHAV-1 和DHAV-3 抗体的通用型ELISA 方法[14];沈友林[15]及董剑梅[16]等均建立了以DHAV-3 重组VP3为检测抗原检测其同型抗体的ELISA 方法,其中沈友林所建方法与DHAV-1 抗体存在交叉反应,其可能成为同时检测DHAV-1 和DHAV-3 感染的通用方法;陈敏[17]、齐晓燕[18]及刘帅帅[19]分别建立了以DHAV-1 重组VP0 和截短VP0 为检测抗原的同型抗体检测方法,其中刘帅帅的研究表明截短VP0 比截短VP1 更易表达,且截短VP0 的反应性及敏感性均优于截短VP1 蛋白;张玉瑶将DHAV-1 VP3 和DHAV-3 VP1 串联原核表达产物作为检测抗原,建立了可检测DHAV-1 和DHAV-3 二价阳性血清的ELISA 方法[20];曹莹莹[21]及何玲[22]分别建立了以DHAV-1 和DHAV-3 的VP2、VP4 为检测抗原的检测同型抗体的ELISA 方法,结果表明以VP2 为检测抗原优于以VP4 为检测抗原的检测效果;刘伟[23]、张怡泽[24]建立了以全病毒为检测抗原的检测同型抗体的ELISA 方法。
综上所述,目前尚未见成熟的可同时检测DHAV-1 及DHAV-3 抗体的通用型ELISA 方法,因此本研究比较DHAV-1 和DHAV-3 3 种结构蛋白免疫反应性差异,并筛选出适合作为通用检测抗原的结构蛋白,利用该蛋白为检测抗原建立可检测DHAV-1 和DHAV-3 血清抗体的通用ELISA 方法,为我国当前DVH 的有效防控提供技术支持。
1 材料与方法
1.1 病毒、血清及实验动物 DHAV-1 E53 株和DHAV-3 GD 株病毒尿囊液、118 份鸭阴性血清、用于符合率试验的46 份鸭血清及鸭源GPV 阳性血清、DEV 阳性血清均由东北农业大学微生物学与免疫学实验室保存;H9N2 AIV 阳性血清及DTMUV 阳性血清由中国农业科学院哈尔滨兽医研究所提供;20 只未免疫DHAV 疫苗的成年鸭购自黑龙江省哈尔滨市阿城养鸭场。
1.2 质粒及主要试剂 重组菌pET30a-DHAV-1-VP0(VP3)/Rosetta、pET30a-DHAV-3-VP0(VP3)/Rosetta、pET-32a-DHAV-1-VP1/Rosetta、pET-32a-DHAV-3-VP1/Rosetta 由东北农业大学微生物学与免疫学实验室构建;Ni-NTA 亲和层析纯化试剂盒购自Gen-Script 公司;山羊抗鸭HRP-IgG(H+L)购自美国KPL生物有限公司;DHAV 抗体(DHAV-Ab)ELISA 检测试剂盒购自上海雅吉生物科技有限公司;DNA Marker 和蛋白Marker 购自TaKaRa 公司;ECL 显色液购自碧云天生物工程公司;脱脂奶粉购自BD 公司;IPTG 购自Sigma 公司。
1.3 DHAV-1 和DHAV-3 鸭抗血清的制备与检测采用胸肌注射的方式, 将DHAV-1 E53 株和DHAV-3 GD 株病毒尿囊液分别免疫7 只成年鸭,另设6 只鸭不做任何处理作为阴性对照,免疫前均采血;首免剂量为2×104.3ELD50/羽份,首免2 周后第二次免疫,免疫方式同前,免疫剂量为首免的2倍,二免后每隔7 d 采血一次;二免12 周后第三次免疫,免疫方式同前,免疫剂量为首免的2倍,三免后每隔7 d采血一次;共采血19 次,采血的方式为翅下静脉采血,分离血清后冻存备用。采用1.4 所述western blot方法检测收集的免疫鸭血清抗体,并区分强阳性、弱阳性免疫血清,用于后续相应的研究。
1.4 DHAV-1/-3 VP0、VP1、VP3 重组蛋白的制备及免疫反应性的检测 将重组菌pET30a-DHAV-1-VP0(VP3)/Rosetta、pET30a-DHAV-3-VP0(VP3)/Rosetta、pET-32a-DHAV1-VP1/Rosetta、pET-32a-DHAV-3-VP1/Rosetta 经常规方法诱导DHAV-1/-3 VP0、VP1、VP3 蛋白表达[11]。目的蛋白通过Ni2+-NTA 琼脂糖凝胶柱纯化[12]后,以1∶1 000 稀释的DHAV-1/-3二免后第6 周的鸭阳性血清为一抗,以1∶2 000 稀释山羊抗鸭HRP-IgG 为二抗,进行重组目的蛋白的western blot 检测。
以纯化的重组DHAV-1/-3 VP0、VP1、VP3 蛋白1 μg/mL 包被ELISA 反应板,100 μL/孔,以1∶100稀释的DHAV-1/-3 二免后第6 周的鸭阳性血清为一抗,1∶400 稀释的山羊抗鸭HRP-IgG 为二抗,进行ELISA 检测,分析各重组蛋白对DHAV-1/-3 二免后第6 周的同型血清抗体和异型血清抗体的免疫反应性。
1.5 间接ELISA 方法的建立
1.5.1 间接ELISA 最佳反应条件的优化 通过棋盘滴定方法,分别将纯化的DHAV-1/-3 VP0 重组蛋白稀释为2 μg/mL、1 μg/mL、0.5 μg/mL、0.25 μg/mL后,分别以100 μL/孔包被ELISA 板,将阴阳性血清以1∶20、1∶50、1∶100、1∶500 和1∶1 000 倍 稀 释后,以100 μL/孔加入ELISA 板,测定OD450nm值,并比较P/N 值以筛选出最佳通用型检测抗原;在抗原和血清抗体的最佳反应剂量确定的基础上,进一步对抗原包被时间(37 ℃2 h、4 ℃过夜、37 ℃1 h 后4 ℃过夜、37 ℃2 h 后4 ℃过夜)、5%脱脂乳封闭时间(30 min、60 min、90 min 和120 min)、血清最佳作用时间(30 min、60 min、90 min 和120 min)、山羊抗鸭HRP-IgG 稀释度(1∶100、1∶200、1∶400、1∶800和1∶1 600)及作用时间(30 min、60 min、90 min和120 min)、TMB 底物显色时间(5 min、10 min、15 min 和20 min)等条件进行优化。
1.5.2 阴阳性临界值的确定 将收集的118 份鸭阴性血清,在最佳的反应条件下进行间接ELISA 测定,以确定鸭血清在无DHAV-1/-3 感染时其OD450nm值,并对其进行统计学分析,计算平均值()及标准差(SD)。根据统计学原理判定血清样本的OD450nm≥±3 SD 为阳性,OD450nm±2 SD 为阴性,±2 SD≤≤±3 SD 为可疑。
1.6 特异性试验 利用1.5 建立的间接ELISA 方法分别检测鸭源GPV、DEV、H9N2 AIV 和DTMUV 阳性血清,并设DHAV-1/-3 阳性血清对照及阴性血清对照(未作任何免疫的鸭血清),每个样品重复2次,进行该方法的特异性检测。
1.7 敏感性试验 从1.3 分别免疫DHAV-1/-3 获得的不同抗体水平的鸭血清中,选择强阳性、弱阳性及阴性血清各3 份,将各血清2 倍倍比稀释(1∶20~1∶2 560)后,按最佳反应条件进行间接ELISA 方法的敏感性检测。
1.8 重复性试验 批内重复试验:采用同一批次以DHAV-1 VP0 包被的酶标板,利用1.5 建立的间接ELISA 方法,于不同时间对1.3 获得的6 份不同抗体水平的DHAV-1/-3 鸭血清样品进行检测,每份做6个重复;批间重复试验:采用不同批次以DHAV-1 VP0 包被的 酶标板,对1.3 获得的6 份不同抗体水平的DHAV-1/-3 鸭血清样品进行检测,每份做6 个重复;同时设立阴性对照,对批内重复和批间重复试验的结果进行统计学分析,计算变异系数(CV=S/-X×100%,S:标准差,-X:算术平均值)。
1.9 符合率试验 利用本研究建立的间接ELISA方法和DHAV-Ab ELISA 检测试剂盒同时检测46 份鸭血清样本,比较两种方法的检测结果并计算二者的符合率。
1.10 临床样本的检测 利用本研究建立的间接ELISA 方法,对1.3 免疫后不同时间获得的的全部鸭血清样品进行抗体消长规律的测定。
2 结 果
2.1 DHAV-1/-3 VP0、VP1、VP3 重组蛋白的免疫反应性鉴定 将纯化后的DHAV-1/-3 VP0、VP1、VP3 6段重组蛋白进行western blot检测,结果显示重组VP0、VP1 蛋白可同时与DHAV-1/-3 的血清抗体发生反应,但重组DHAV-1 VP3 蛋白仅与DHAV-1 的血清抗体反应,DHAV-3 VP3 蛋白仅与DHAV-3 的血清抗体反应(图1)。表明重组VP0 和VP1 均具有交叉免疫反应性,可作为DHAV抗体检测的通用型诊断抗原。
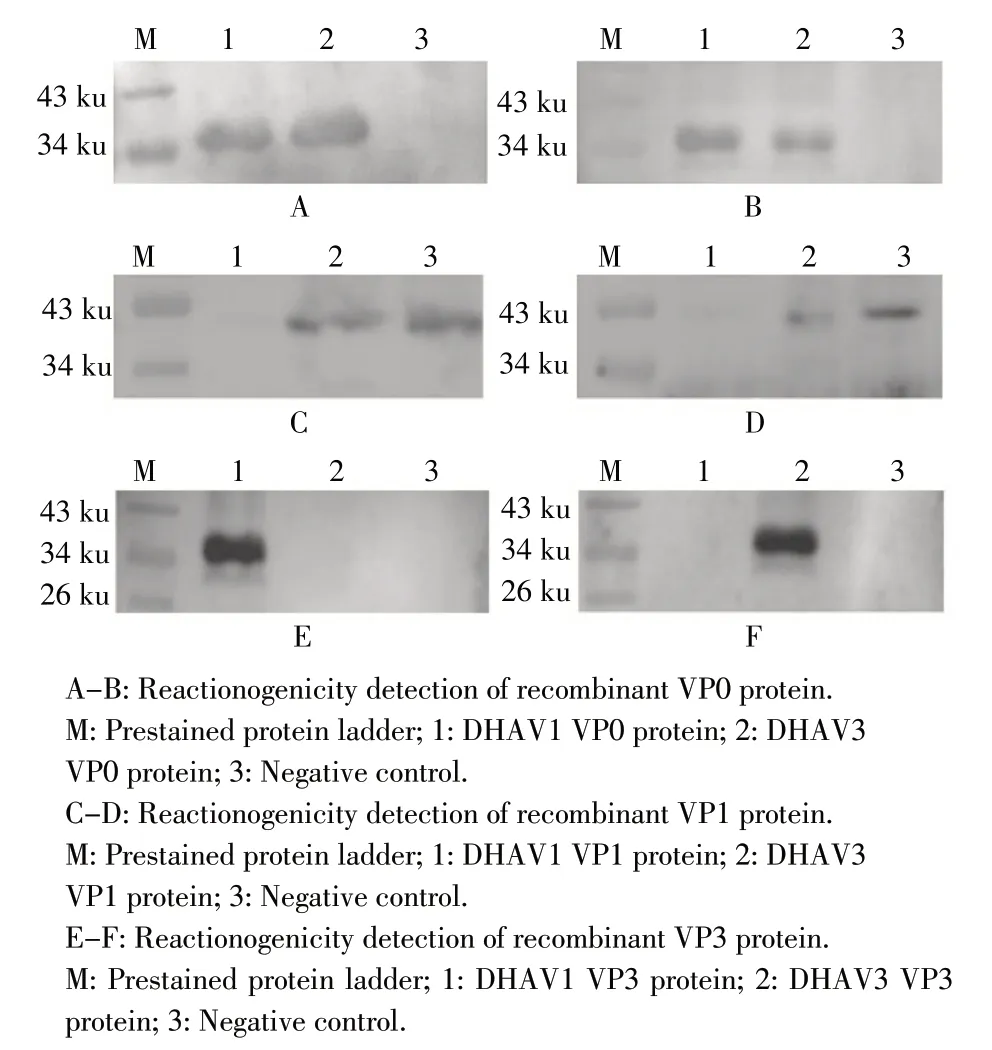
图1 DHAV-1/-3 VP0、VP1 和VP3 蛋白免疫反应性的western blot 检测结果Fig. 1 Reactionogenicities analysis of recombinant protein VP0,VP1,VP3 with DHAV-1/-3 by western blot
分别以纯化的重组DHAV-1/-3 VP0、VP1、VP3 6 段蛋白为包被抗原,进行同型及异型血清抗体的ELISA 检测。结果显示,3 种结构蛋白与异型血清均存在不同程度的交叉反应,且表现为DHAV-1 的3 种重组结构蛋白与DHAV-3 阳性血清交叉免疫反应性均强于DHAV-3 的3 种重组结构蛋白与DHAV-1 阳性血清的交叉免疫反应性,因此DHAV-1 的重组结构蛋白更适合作为检测抗原;DHAV-1 重 组VP0、VP1、VP3 的ELISA 结 果 显 示,VP1 及VP3 的P/N 值 高 于VP0 的P/N 值,而VP0 及VP1 与异型阳性血清交叉免疫反应的稳定性优于VP3,所以重组VP0 和VP1 可作为DHAV 抗体检测的通用型诊断抗原,该结果与westren blot 结果一致(图2)。根据以上结果本研究选择DHAV-1 VP0 进行后续研究(具体原因见讨论)。
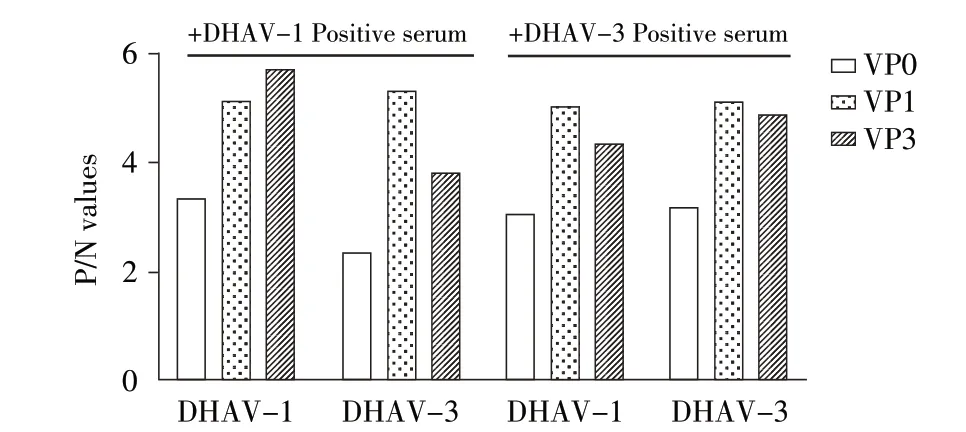
图2 重组DHAV-1/-3 VP0、VP1 和VP3 蛋白免疫反应性的间接ELISA 检测结果Fig.2 Reactionogenicities analysis of recombinant protein VP0,VP1,VP3 of DHAV-1/-3 by indirect ELISA
2.2 间接ELISA 方法的建立
2.2.1 间接ELISA 方法最佳反应条件的优化结果通过方阵滴定试验优化的间接ELISA 反应条件:DHAV-1 VP0 抗原包被浓度为0.25 μg/mL,37 ℃作用2 h 后4 ℃过夜;5%脱脂乳37 ℃封闭90 min;待检血清稀释度为1∶100,37 ℃孵育60 min;1∶400 稀释的山羊抗鸭HRP-IgG 37 ℃孵育60 min;底物避光显色15 min。
2.2.2 阴阳性临界值的确定 将收集的118 份鸭阴性血清,按照最佳反应条件进行间接ELISA 测定,测得的所有鸭阴性血清OD450nm值在0.12~0.26 之间,且符合正态分布(图3)。结果显示,阴性血清的OD450nm平均值()为0.180,标准差(SD)为0.042,±3 SD 为临界值为0.307,经计算检测的血清样本为OD450nm≥X±3 SD(0.307)判定为阳性,OD450nm±2 SD(0.264)判定为阴性,OD450nm值介于0.264~0.307 之间判定为可疑。
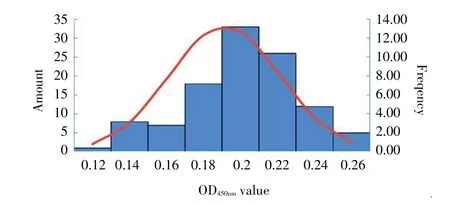
图3 鸭阴性血清间接ELISA 检测结果的正态分布图Fig.3 Normal distribution of ELISA detection result for duck negative serum
2.3 特异性试验结果 利用建立的间接ELISA 方法分别检测鸭源GPV、DEV、H9N2 AIV 和DTMUV 的阳性血清,结果显示该ELISA 方法与上述阳性血清抗体均无交叉反应,与DHAV-1 和DHAV-3 的鸭阳性血清反应呈阳性(图4),表明该方法特异性较强。
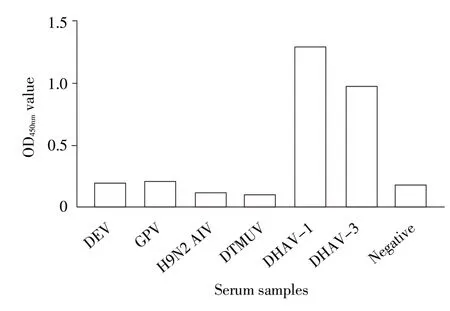
图4 间接ELISA 特异性试验结果Fig.4 The specificity assay of the indirect ELISA
2.4 敏感性试验结果 分别选择不同抗体水平的DHAV-1 和DHAV-3 鸭阳性血清各3 份,将血清2 倍倍比稀释(1∶20~1∶2 560)后,按最佳反应条件进行ELISA 检测。结果显示,检测DHAV-1 强弱阳性血清时的敏感性达到1∶640,检测DHAV-3 强弱阳性血清时的敏感性为1∶320(图5)。综合考虑,将本研究建立的间接ELISA 方法的敏感性定为1∶320,敏感性较高。
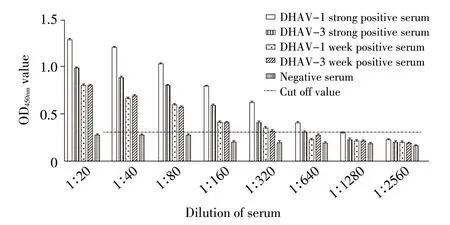
图5 敏感性试验结果Fig.5 Sensitivity assay of the indirect ELISA
2.5 重复性试验结果 按照本研究建立的间接ELISA 方法对6 份不同抗体水平的鸭阳性血清进行批内、批间重复性试验,并计算变异系数。结果显示,批内变异系数为0.57%~2.67%,批间变异系数为1.94%~6.05%,均小于10%(表1),表明该方法重复性较好。
2.6 符合率试验 利用本研究建立的间接ELISA 和商品化的ELISA 检测试剂盒同时检测46 份鸭血清样品。结果显示,本研究建立的间接ELISA 检出DHAV 阳性血清为30 份,阳性检出率为65.2%;商品化的ELISA 检测试剂盒检出阳性血清样品28 份,阳性检出率为60.9%,二者的阳性符合率为93.3%,阴性符合率为88.9%,两种方法的总符合率为95.7%(表2)。表明所建立的间接ELISA 方法与商品化的试剂盒总体符合率较高,检测结果比较可靠。
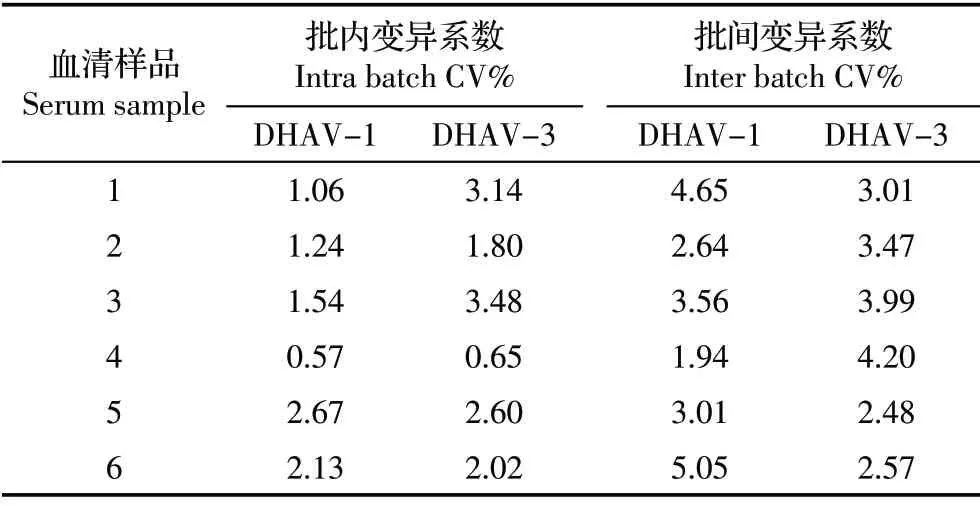
表1 间接ELISA 重复性试验结果Table 1 Repeatability assay of the indirect ELISA(n=6)
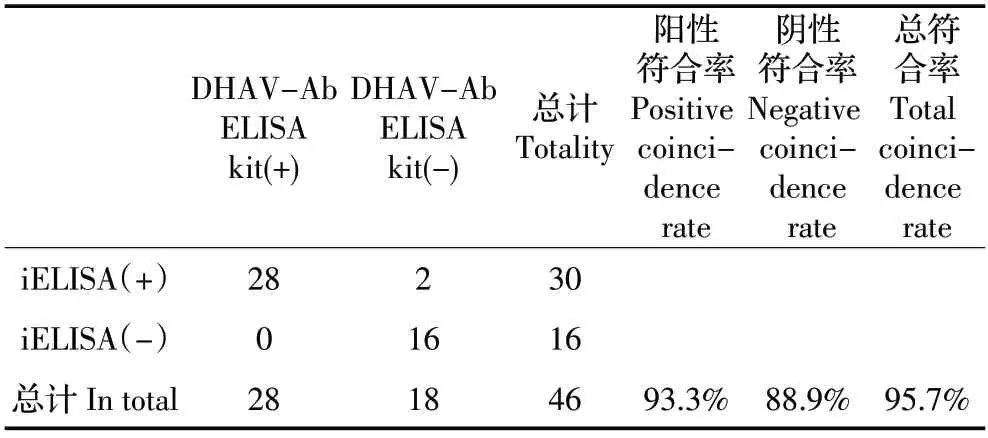
表2 符合率试验结果Table 2 Result of coincidence rate
2.7 临床样品检测结果 利用本研究建立的间接ELISA 方法分别检测免疫DHAV-1 和DHAV-3 共19 周次的鸭血清抗体水平。结果显示,DHAV-1/-3免疫鸭抗体消长规律呈现一致变化趋势,血清抗体均在首免后第2 周转为阳性,二免后第6 周血清抗体达到高峰,峰值为1.235,而后抗体水平逐渐下降,到二免12 周时血清抗体仍呈阳性,三免后血清抗体快速回升(图6)。表明所建立的间接ELISA 方法可以用于临床血清样本的定性及定量检测。
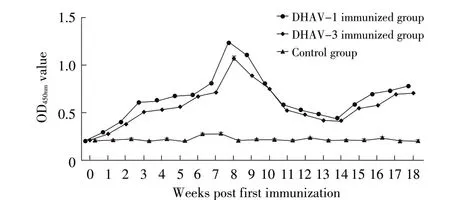
图6 DHAV-1/-3 免疫鸭血清抗体消长规律检测结果Fig.6 Monitoring the level of antibodies in ducks immunized with DHAV-1 and DHAV-3
3 讨 论
DHAV-1 和DHAV-3 混合感染的情况在我国十分普遍[5-7],因此建立可检测DHAV-1/-3 血清抗体的通用型检测方法,对于该病的有效防控具有重要意义。已有文献报道分别以重组的DHAV-1 VP3 及DHAV-3 VP1 建立的ELISA 方法可用于DHAV-1/-3血清抗体的检测[14-15],但对于异型血清抗体的检测没有详细的数据支持。本研究在比较DHAV-1/-3 VP0、VP1、VP3 结构蛋白交叉反应性的基础上,综合考虑确定以DHAV-1 VP0 重组蛋白为通用检测抗原,建立了可同时检测DHAV-1/-3 血清抗体的间接ELISA 方法,并进行了初步应用,为DHAV 抗体的检/监测提供了候选技术手段。
本研究团队研究初期,随机选取了14 株DHAV-1 和DHAV-3 结构蛋白进行氨基酸的同源性分析,结果显示VP0 的同源性最高为90.43%,VP1和VP3 的同源性分别为87.40%和88.82%, 可见VP0较为保守,这与文献报道的同源性结果一致[2]。本研究利用原核表达系统分别表达了DHAV-1/-3 VP0、VP1、VP3 结构蛋白,经western blot 和间接ELISA 检测进一步证实,3 种重组结构蛋白与异型血清均存在不同程度的交叉反应性,且DHAV-1 的3种重组结构蛋白与异型血清的交叉反应性强于DHAV-3 3 种重组结构蛋白与异型血清的交叉反应性。且当血清1∶1 000 稀释进行western blot 检测时,VP0 和VP1 仍与DHAV 两种型的阳性血清抗体反应,而VP3 仅与同型阳性血清抗体发生反应;当DHAV 阳性血清抗体1∶100 稀释进行间接ELISA 检测时,VP0、VP1、VP3 均表现与异型血清的交叉反应性,其中VP1 的交叉反应性最强,这一结果与文献报道VP1 的免疫原性最好一致,表明VP1 存在较多的抗原表位[9-15,25];而VP0、VP1 与异型血清抗体交叉反应性强于VP3。VP3 在血清抗体稀释度较低时(ELISA)表现较好的交叉反应性,而在血清稀释度较高时(western blot)不表现交叉反应性,表明VP3 的交叉反应性存在抗体浓度依赖性,综上所述,VP0、VP1 适合作为检测DHAV 抗体的群特异性抗原,而VP3 依据所建立检测方法的敏感性有可能成为检测DHAV 抗体的型特异性抗原。上述结果进一步表明,VP1 与VP0 相比,VP1 的免疫反应性强于VP0,但本研究在重组VP1 表达及纯化过程中遇到瓶颈,优化表达条件及更换载体,均不能改变其表达量偏低的情况,这与文献报道结果一致[11,19,26],且本研究显示VP0 不仅表达量高,而且以包涵体和可溶性两种方式表达均便于纯化,其与异型血清抗体反应的稳定性较好,P/N 值满足检测需求,且VP0 的保守性更好,所以本研究综合考虑最终选择VP0 作为检测DHAV-1 和DHAV-3 血清抗体的通用型ELISA 诊断抗原并建立相应的ELSIA 检测方法。
本研究建立的ELISA 方法均不与鸭常见病毒的阳性血清发生交叉反应,具有较强的特异性;批内变异系数及批间变异系数分别为0.57%~2.67%和1.94%~6.05%,重复性较好;选择强阳性和弱阳性的血清检测其敏感性为1∶320,且检测同型血清抗体的敏感性略高;该方法与商品化ELISA 试剂盒检测结果的符合率较高达到95.7%。利用所建立的ELISA 方法检测DHAV-1/-3 免疫鸭血清抗体的消长规律,表明该方法可用于临床血清样本的抗体检测。
综上所述,本研究建立的检测DHAV-1 和DHAV-3 抗体的通用型间接ELISA 方法,通过一次反应可实现对DHAV-1 和DHAV-3 两种型的血清抗体同时检测,为今后DHAV 感染的检测及二价疫苗免疫效果的评价提供了技术支持。
