一株多重配H13N8 亚型禽流感病毒分子进化以及对鸡致病性研究
2020-07-01李玉磊李明慧田井满刘丽娜李雁冰陈化兰
李玉磊,李明慧,田井满,刘丽娜,李雁冰,陈化兰
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/ 农业部动物流感重点开放实验室,黑龙江 哈尔滨 150069)
禽流感病毒(Avian influenza virus,AIV)属于正黏病毒科A 型流感病毒属。根据表面糖蛋白血凝素(Hemagglutinin,HA)和神经氨酸酶(Neuraminidase,NA)的抗原性不同,AIV 可分为16 种HA 亚型和9 种NA 亚型[1-3]。野生鸟类是AIV 的天然宿主,所有亚型的AIV 均可以在雁形目(鸭,鹅和天鹅)和鸻形目(海鸥,滨鸟和燕鸥)鸟类中分离到[4-5]。H13亚型禽流感于1977年首次从海鸥中分离[6],在鸻形目以外的禽类物种中很少检测到,这种宿主限制机制可能与H13亚型病毒内部基因所编码非结构蛋白1(Non-structural protein 1,NS1)和核蛋白(Nucleoprotein,NP)蛋白有关[7]。H13 亚型禽流感为低致病性AIV,按照其进化关系被划分为欧亚分支和北美分支[8]。已有研究表明H13 亚型AIV对鸡(Gallus),鸭(Anatidae)和火鸡(Meleagris)均不表现致病性,但对雪貂可引起温和致病性[9]。2017 年在我国青海湖地区首次分离到一株H13N8 病毒,在对其基因组进化分析显示H13 病毒可以在雁形目和鸻形目鸟类中发生种间重组[10],这可能使其获得感染家禽的能力,对家禽养殖业以及公共社会安全造成潜在的威胁。
为了解分离株H13N8 亚型AIV 的生物学特性,评价该亚型AIV 对当前我国家禽的潜在危害和影响,本研究对2018 年宁夏回族自治区沙湖自然保护区分离到的一株低致病性H13N8 亚型AIV 进行了全基因组序列测定,并进行特殊氨基酸位点分析和遗传演化分析,评估了其对SPF 鸡的感染性风险,为H13N8 亚型AIV 的综合防控提供参考依据。
1 材料与方法
1.1 样品采集 2018 年10 月,在宁夏回族自治区沙湖湿地采集新鲜野生鸟类的粪便样品251 份,坐标E126.656259,N45.628504。根据粪便的形状和颜色确定粪便样本鸟的种类。将收集的样品置于含有青霉素,链霉素和10%甘油的PBS中,并在4℃下储存运输。
1.2 主要实验材料 9 日龄~10 日龄SPF 鸡胚购自哈尔滨兽医研究所实验动物中心。RNA 提取试剂盒购自北京天根生化有限公司;RNA 反转录酶购自日本TOYOBO 公司;rTaq DNA 聚合酶购自北京全式金生物公司;PCR 产物纯化试剂盒、胶回收试剂盒购自美国OMEGA 公司;测序反应试剂盒BigDye Terminator 3.1 购自美国ABI 公司。
1.3 病毒分离及其HA 亚型鉴定 将251 份野鸟粪便样品震荡、离心后接种9 日龄~10 日龄鸡胚,37 ℃孵化72 h 后收获鸡胚尿囊液,按常规方法测试其血凝(HA)活性,HA 阳性的样品再以H1~H16 单因子血清确定其HA 亚型。
1.4 病毒全基因组测序及进化分析 利用病毒RNA 提取试剂盒提取病毒RNA,采用反转录引物Union12(5'-AGCRAAAGCAGG-3')反 转 录 为cDNA。参照GenBank 中A/black-tail gull/Weihai/6/2016(H13N8)(MH201570.1)各基因节段的保守区段设计引物(表1),以cDNA 为模板进行各目的基因的PCR 扩增后,经琼脂糖凝胶电泳检测,利用胶回收试剂盒对PCR扩增产物进行回收纯化。引物均由库美生物公司合成。利用Big Dye Terminator 测序试剂盒对各扩增序列进行测定,测序结果利用DNAStar软件包中的Seqman进行拼接,并对特殊的氨基酸位点进行分析。将所得到的全基因组完整序列利用Meg Align 软件进行同源性比较,利用MEGA 7软件绘制病毒各个基因的进化树。
1.5 病毒对SPF 鸡的致病性试验 按照常规方法检测分离病毒株的鸡胚半数感染量(EID50),使用PBS 将病毒稀释至106EID50/100 μL,100 μL/只鼻腔感染8 只4 周龄的SPF 鸡,感染24 h 后放入2 只未经感染的SPF 鸡,以检测病毒的传播能力;感染3 d 后随机迫杀3 只感染鸡,采集脑、脾、肾、胰腺、胸腺、盲肠扁桃体、法氏囊、气管和肺等脏器利用鸡胚进行病毒滴定,以检测病毒在鸡各脏器的复制情况;在感染后第3 d、5 d、7 d 和9 d 分别采集感染鸡咽喉拭子和泄殖腔拭子,利用鸡胚进行病毒滴定,以检测感染鸡的排毒情况;感染后每天观察并记录鸡的临床表现,以评价病毒对鸡的致病性;在感染后第14 d 采血分离血清,通过血凝抑制试验检测鸡的血清转阳情况。
2 结 果
2.1 病毒分离鉴定与全基因组扩增 将采集的野鸟粪便样品接种鸡胚后收获鸡胚尿囊液,进行血凝试验,结果显示,有一份样品接种的鸡胚尿囊液可以使1%鸡红细胞发生凝集,血凝效价达到1∶128。该血凝特性可被H13 亚型AIV 单因子血清所抑制,而不能被阴性血清或其它亚型的AIV 单因子血清所抑制。表明分离株为H13 亚型AIV。

表1 用于扩增AIV 8 个基因节段的引物Table 1 Primers used for amplifying the eight fragments of AIV
2.2 H13N8 AIV的全基因组序列的测定与分析 提取血凝阳性鸡胚尿囊液中病毒RNA进行反转录后,使用特异性引物进行全基因组的RT-PCR扩增,结果显示各条带与预期大小相符(图1),该分离株为H13N8 亚型AIV, 命 名A/great black-headed gull/Ningxia/1/2018(H13N8),简称GBHG/NX/1/18(H13N8)。

图1 H13N8 亚型AIV 各基因节段PCR 扩增结果Fig.1 PCR amplication results of 8 fragments of H13N8 subtype AIV
对病毒株GBHG/NX/1/18(H13N8)各基因序列进行测序分析,结果显示,其HA 基因与A/blackheaded gull/Netherlands/5/2014(H13N6)同源性最高,为96.53%,其NA 基因与A/duck/Mongolia/921/2018(H3N8)同源性最高,为99.86%。内部基因与NCBI数据库中H13N8、H6N2、H13N6 和H13N2 等多种不同亚型AIV 的部分基因片段具有最高的核苷酸同源性(表2),表现出明显的多亚型重组的特点(图2)。
2.3 特殊氨基酸位点分析 对该病毒特殊氨基酸位点分析,结果显示,其HA 蛋白裂解位点序列为ISNR↓GLF,仅有一个碱性氨基酸,符合低致病性AIV 的分子特征。有研究发现HA 蛋白受体结合位点为226L 和228S 能显著增加病毒对人源受体的结合能力[11],但该病毒在此位点为226G 和228N,未获得增加结合人源受体的能力。NA 蛋白颈部未发现缺失。PB2 蛋白均保持256D、627E 和701D 的分子特征。M1 蛋白N30D 和T215A、NS1 蛋白P42S、L98F 和I101M 的突变均可以增加病毒对小鼠的致病性[12-13],本研究发现该病毒均获得了以上突变,表明其具有增强对哺乳动物致病性的潜在能力。M2 蛋白V27A 和S31N/I 突变可降低病毒对金刚烷胺和金刚乙胺的敏感性[14],但分离株没有获得上述突变,表明其对金刚烷胺和金刚乙胺没有产生耐药性(表3)。

表2 H13N8 AIV 全基因组节段的BLAST 分析结果Table 2 The blast analysis of the H13N8 subtype AIV genomes
2.4 外部基因遗传进化分析
2.4.1 HA基因进化分析 对HA基因测序分析,显示该病毒ORF为1 698 bp,编码565 个氨基酸。该基因进化分析显示,该分离株与A/black-headed gull/Netherlands/5/2014(H13N6)同属一个分支,均可被划分为欧亚分支(图3)。

图2 GBHG/NX/1/18(H13N8)流感病毒基因型,8 个线条代表流感病毒的8 个基因节段:从上到下依次为PB2、PB1、PA、HA、NP、NA、M 和NSFig.2 The genotype of GBHG/NX/1/18(H13N8)influenza virus genome.Eight bars represent eight segments of the avian influenza virus:top to bottom PB2,PB1,PA,HA,NP,NA,M and NS

表3 GBHG/NX/1/18(H13N8)基因组关键氨基酸位点分析Table 3 Analysis of key amino acid sites of GBHG/NX/1/18(H13N8)genome
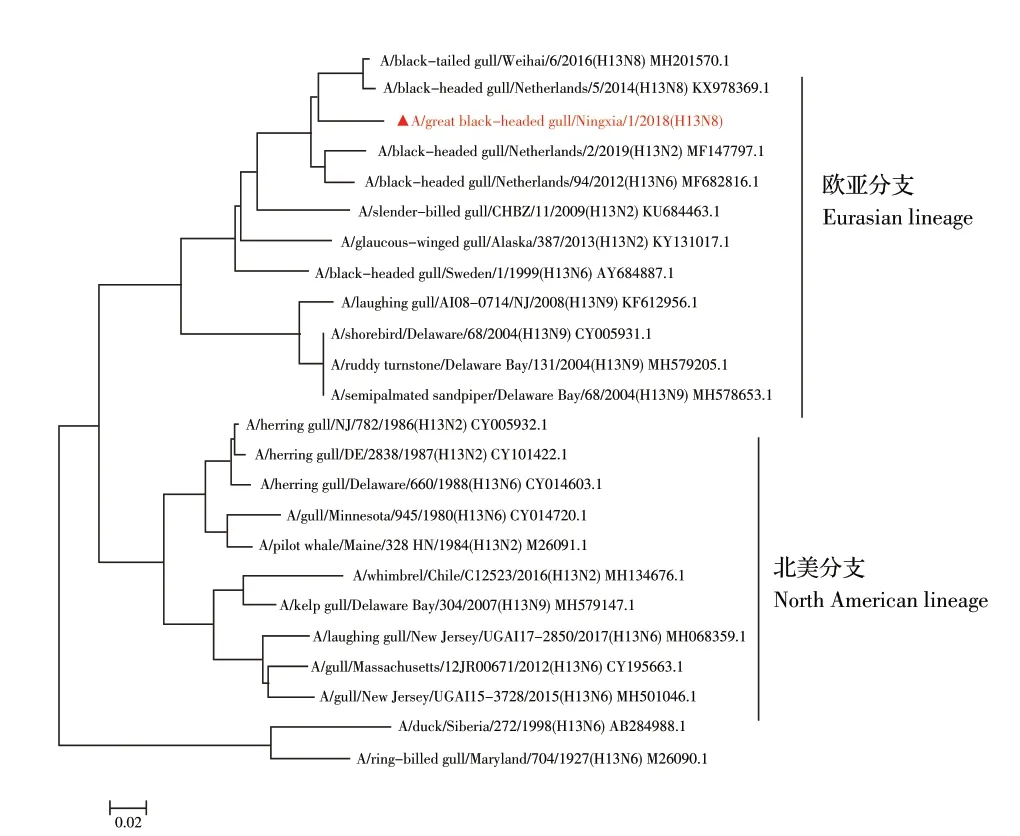
图3 GBHG/NX/1/18(H13N8)分离株HA 基因进化分析Fig.3 The HA gene phylogenetic tree of GBHG/NX/1/18(H13N8)(▲)
2.4.2 NA基因的进化分析 对NA基因测序分析,显示其ORF为1 413 bp,编码470个氨基酸,其颈部无氨基酸缺失。对分离株NA基因进化分析显示,其与2018年从蒙古分离的鸭源H3N8 亚型AIV A/duck/Mongolia/921/2018(H3N8)遗传进化距离较近,同属于Group 1(图4),表明其NA基因可能来自于鸭源H3N8亚型AIV。

图4 GBHG/NX/1/18(H13N8)分离株NA 基因进化分析Fig.4 The HA gene phylogenetic tree of GBHG/NX/1/18(H13N8)(▲)
2.5 内部基因遗传进化分析 GBHG/NX/1/18(H13N8)分离株PB2、PB1和PA基因测序分析,显示其ORF分别为2 280 bp、2 274 bp 和2 174 bp,分别与A/blacktailed gull/Weihai/17/2016(H13N8)、A/duck/Hubei/ZYSYG3/2015(H6N2)和A/black-headed gull/Netherlands/96/2012(H13N6)的遗传进化距离最为接近。NP 和NS 基因ORF 分别为1 510 bp 和890 bp,均与H13N2 亚型AIV 具有相同的进化来源。M 基因ORF 为1 027 bp,与2017 年分离的A/kelp gull/Chile/C27733/2017(H13N8)毒株的亲缘关系很近(图5),这提示分离株的M 基因可能来源于该病毒。
2.6 H13N8 亚型AIV 对SPF 鸡致病性试验结果 鼻腔接种感染SPF 鸡后均无明显临床症状,其在鸡群中无传播能力。对感染后各时间点咽喉拭子和泄殖腔拭子进行病毒滴定,结果显示感染组和接触组均不能向外界排毒,但在感染后14 d有一只接种鸡有较低抗体水平(抗体滴度1∶10),接触组的鸡血清未检测到H13N8抗体。感染鸡各脏器中均也未检测到病毒,即病毒在感染鸡各脏器均不能有效复制。以上结果表明GBHG/NX/1/18(H13N8)分离株感染鸡的潜在风险较小。

图5 GBHG/NX/1/18(H13N8)分离株PB2、PB1、PA、NP、M 和NS 基因进化分析Fig.5 The phylogenetic tree of the PB2,PB1,PA,NP,M and NS genes of GBHG/NX/1/18(H13N8)
3 讨 论
海鸥被认为是H13 亚型AIV 的天然宿主,H13亚型AIV 经常在海鸥种群中呈年度流行[15]。由于在自然环境下海鸥与野鸭、滨鸟等鸟类共享栖息地,这将增加病毒的跨物种传播或重配的风险,从而产生新亚型病毒。2018 年秋季在宁夏回族自治区分离得到GBHG/NX/1/2018(H13N8)AIV,本研究遗传演化分析该病毒基因序列,结果显示该病毒株各基因片段来源复杂,其PB1 和NA 基因均来自鸭源AIV 病毒,表明H13N8 亚型AIV 跨物种重组已经发生,这可能增加该亚型病毒对鸭的感染性和致病性。
H13N8 亚型分离株均分离于野生水禽、鲸以及环境样本,从未在陆生家禽中分离到该亚型AIV,表明H13N8 分离株尚未获得由野生水禽向陆生家禽和哺乳动物进行跨种传播的能力。本研究表明H13N8 AIV 虽然其能够感染鸡,但其不能在鸡体内进行有效复制,并且不能通过呼吸道和消化道排毒,这与高晓龙等的研究结果一致[16]。
通常认为低致病性AIV 对人类不表现致病性,本研究对GBHG/NX/1/2018(H13N8)AIV 序列分析发现的HA 蛋白受体结合位点为226G 和228N,未获得增加结合人源受体的能力。但由于各亚型AIV 流行过程中不断发生重组会使其致病性发生改变,近年来H6N1、H7N9、H9N2 和H10N8 低致病性禽流感病毒感染人事件不断发生,应引起人们对新出现的低致病性禽流感病毒的大流行威胁的关注[17-20]。另外,感染低致病性AIV 的野生水禽虽然不会表现出临床症状,但会在迁移过程中不断排出病毒。因此,对低致病性AIV 流行病学监测显得至关重要。与此同时,H13 亚型AIV 在我国野鸟中分离率呈上升趋势[21],对H13 亚型AIV 的监测和生物特性的研究能够为我国禽流感的监测预警以及疫情防控提供数据支持。
