安装心律植入装置术后静脉阻塞的发生率及危险因素分析
2020-07-01高洁李洪仕朱可佳于向东张文娟
高洁,李洪仕,朱可佳,于向东,张文娟
心律植入装置是不可逆性缓慢性心律失常、终末期心力衰竭以及心脏性猝死二级预防的有效治疗手段。世界心律失常协会自1972年以来每4年对世界范围内心脏起搏器的应用数量进行调查,2009年在第十一届心律植入装置临床应用数量的调查中发现,每年世界范围内起搏器的植入数量超过100万台,植入型心律转复除颤器(ICD)植入数量也超过20万台[1]。随着临床应用数量的剧增,安装心律植入装置的并发症如静脉阻塞、血栓形成以及感染等的发生率明显升高。随着人类寿命的提高,因电池耗竭、电极脱位或起搏器升级的患者数量逐渐增多,静脉阻塞成为进行二次手术的难点。除此之外,静脉阻塞产生上肢肿胀、疼痛等临床症状,可能会导致上肢深静脉血栓、上腔静脉综合征、肺栓塞等,严重者需要导线拔除,甚至引起死亡[2-3]。目前临床上静脉阻塞发生的危险因素及预防策略仍不十分明确。本研究回顾性研究天津医科大学总医院150例起搏器更换患者的静脉情况,分析静脉阻塞的发生率以及危险因素。
1 资料与方法
临床资料:天津医科大学总医院2015年1月至2019年9月行起搏器更换的患者共185例,有35例术前未行静脉造影(原因包括对比剂过敏或肾功能异常及其他因素)。本研究纳入150例术前行导线植入静脉造影检查的患者,这些患者均无上肢、面部或颈部的疼痛、肿胀及发热等静脉阻塞的症状,收集患者一般临床资料及植入性装置的资料。150例患者中男性62例,女性88例,平均年龄(75.0±11.6)岁。更换起搏器的原因包括电池耗竭138例、电极异常(包括电极移位及断裂)5例、感染(包括囊袋感染、伤口感染及电极感染)7例。起搏器类型包括单腔起搏器18例、双腔起搏器130例以及心脏再同步化治疗(CRT)2例。ICD植入6例,均为双腔起搏器,其中4例应用单线圈除颤电极,2例应用双线圈除颤电极。150例患者中,心律植入装置的适应证包括90例(60.0%)窦房结功能异常、52例(34.7%)房室阻滞、6例(4.0%)心脏性猝死的二级预防、2例(1.3%)扩张型心肌病。
方法:(1)静脉造影作为判断静脉是否狭窄的金标准,判断研究中所纳入患者的静脉情况。应用20~40 ml对比剂注入植入装置同侧的外周静脉行静脉造影。所有患者植入的起搏器均在同侧。在X线透视下顺序性的显示并记录腋静脉、锁骨下静脉、头臂静脉及上腔静脉的血流。以血管的最大、最小直径评估静脉是否阻塞,定义血管最小直径/最大直径×100≥50%为静脉狭窄。对比剂对比显像中无血流通过则为静脉完全闭塞。通过静脉造影确定为静脉狭窄(直径狭窄≥50%)或闭塞为阻塞组(n=38),以静脉狭窄程度<50%者为对照组(n=112)。(2)根据患者性别、年龄、心律植入装置的适应证、合并疾病等一般临床资料,穿刺静脉及穿刺次数、起搏部位、是否应用临时起搏器等术中资料,以及植入装置导线数目、阈值阻抗等参数、术后是否发生感染等相关资料预测心律植入装置后静脉阻塞发生的危险因素。起搏器更换原因中正常更换定义为:电池耗竭和(或)达到厂家建议且使用5年以上;非正常更换包括电极脱位、囊袋感染、起搏器提前升级等多种因素。静脉穿刺次数根据更换静脉穿刺点的个数判断,在一个拟穿刺点内调整穿刺针位置不计为增加静脉穿刺次数。起搏器手术中,有经验术者常规选择一个拟穿刺点可穿刺成功。
统计学方法:所有数据均经SPSS 25.0软件进行分析。计量资料用均数±标准差表示,组间比较采用t检验或者单因素ANOVA分析;计数资料以百分比或率表示,采用χ2检验或者Fisher确切概率法;采用多因素Logistic回归分析相关的危险因素。以P<0.05为差异有统计学意义。
2 结果
静脉造影结果:38例(25.3%)发生静脉阻塞,其中12例(8.0%)患者中出现静脉狭窄;26例(17.3%)患者静脉完全闭塞。在阻塞的静脉中,36例(24.0%)以锁骨下静脉狭窄或闭塞为主,仅2例(1.3%)发生腋静脉闭塞。
一般资料及植入装置特征(表1):阻塞组平均年龄较对照组更小[(71.5±14.8)岁 vs.(76.1±10.0)岁,P=0.035];阻塞组<50岁的患者比例较对照组更高(10.5% vs.0.9%,P=0.015)。4例发生静脉阻塞并且<50岁的患者,均未合并血栓性疾病病史或凝血系统异常的遗传病史。对照组非正常原因更换起搏器患者比例低于阻塞组(7.1% vs.18.4%,P=0.045);与对照组比较,阻塞组发生术后感染患者(13.2% vs.1.8%,P=0.012)、体内植入导线数目[(2.2±0.8)根 vs.(1.9±0.3)根,P=0.001]、静脉穿刺次数[(1.4±0.7)次 vs.(1.1±0.4)次,P=0.004]均高于对照组。性别、合并疾病(包括冠心病、心房颤动、心力衰竭以及糖尿病)、入路静脉(包括锁骨下静脉、腋静脉及股静脉)、术中是否应用临时起搏器、起搏部位(包括心尖部及间隔部起搏)、起搏器类型(单、双、三腔起搏器)及术中阈值、阻抗、R波感度在两组间比较差异均无统计学意义(P均>0.05)。
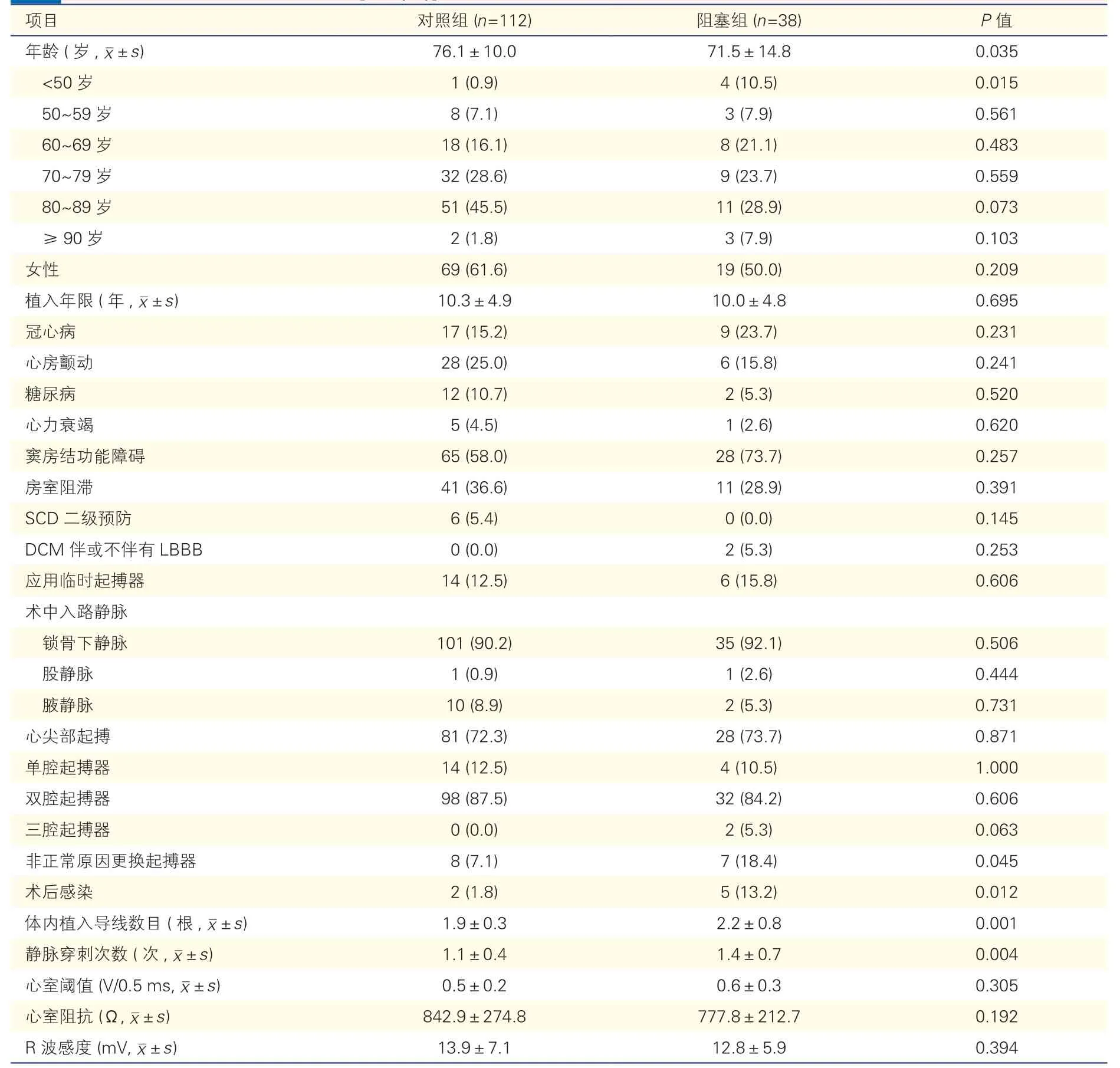
表1 阻塞组和对照组基线特征分析[例(%)]
应用单因素回归分析判断静脉阻塞的危险因素,结果发现年龄(OR=1.033,95%CI:1.022~1.066,P=0.039);体内植入导线数目(OR=1.261,95%CI:1.060~1.378,P=0.005);起搏器植入术中入路静脉穿刺次数的增加(OR=1.397,95%CI:1.190~1.830,P=0.014)以及起搏器植入术后感染(包括囊袋感染、伤口感染及电极感染)(OR=8.333,95%CI:1.545~44.952,P=0.014)是静脉阻塞的危险因素(表2)。非正常原因更换起搏器在单因素回归分析中并未显示出对静脉阻塞的影响。
应用多因素Logistic回归分析研究年龄、术后感染、静脉穿刺次数以及体内植入导线数目对于起搏器植入术后静脉阻塞的危险因素,调整高血压、糖尿病、心房颤动心血管危险风险因素的影响后发现术后感染(OR=11.475,95%CI:1.562~84.281,P=0.016)、静脉穿刺次数的增加(OR=1.373,95%CI:1.164~1.850,P=0.019)以及体内植入导线数目(OR=1.270,95%CI:1.095~1.770,P=0.014)是静脉阻塞的独立危险因素(表3)。
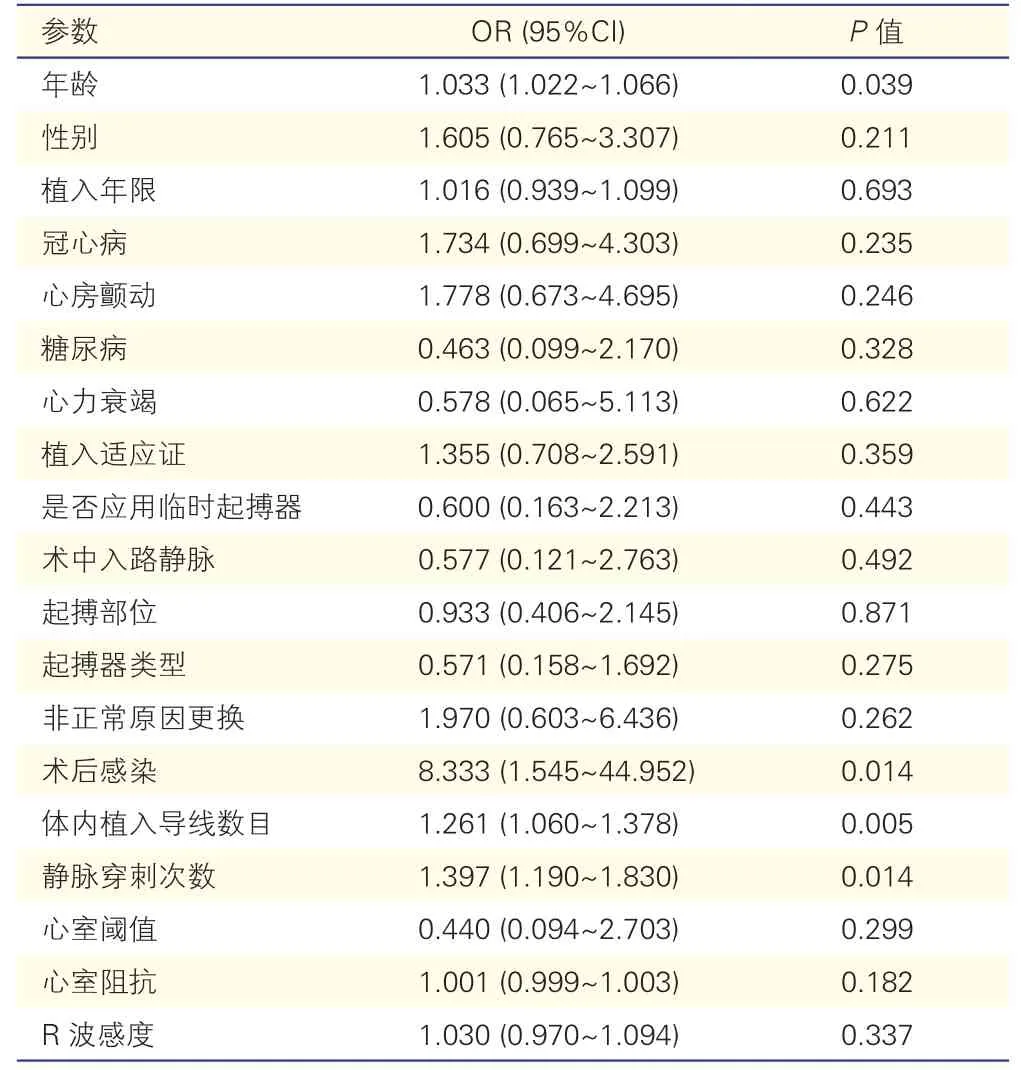
表2 单因素回归分析静脉阻塞危险因素
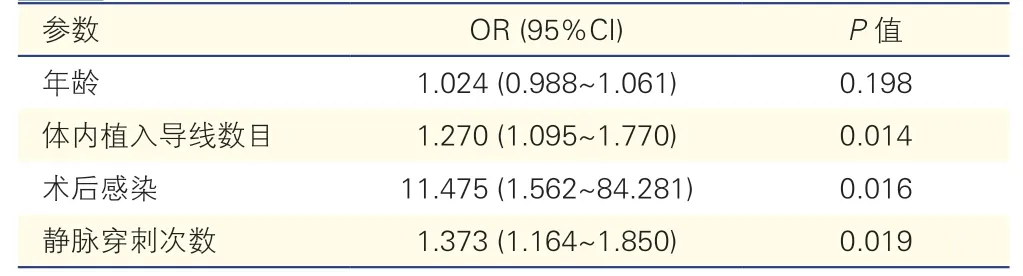
表3 调整高血压、糖尿病、心房颤动后的多因素回归分析
3 讨论
我们研究发现:(1)因不同疾病安装心律植入装置术后静脉阻塞的发生率25.3%,静脉完全闭塞的发生率17.3%。即使在静脉完全闭塞的患者中,无上肢、颈面部疼痛、肿胀等相关临床症状,静脉造影结果显示形成侧枝循环;(2)体内植入导线数目、入路静脉穿刺次数的增加以及术后感染是静脉阻塞/完全闭塞的危险因素;(3)患者自身疾病、合并疾病、性别、年龄等基线资料及术中入路静脉、起搏部位、起搏器类型、植入年限、是否应用临时起搏器、心室阈值、阻抗、R波感度等术中参数未显示与静脉阻塞发生的相关性。
2004年,Lickfett 等[4]在105例ICD更换的患者中研究术后静脉的发病率25.0%;2007年,Korkeila 等[5]研究认为器械植入术后静脉阻塞的发病率在14.0%;2010年,Bulur 等[6]在84例植入双腔起搏器患者中发现静脉阻塞的发生率在38.0%;2016年,Santini 等[7]在184例植入起搏器/ICD患者中静脉阻塞的发生率在38.0%。比较本研究及先前的研究,本研究的发生率与先前研究中14.0%~38.0%的发生率一致。即使在静脉完全阻塞的患者中,仍无相关的临床症状。既往研究发现症状性静脉阻塞的发生率确实较低,在0%~2.0%之间[4-6,8-13]。症状性静脉阻塞发生率较低可能是因为静脉阻塞发生过程缓慢,机体已形成充足的侧枝循环保护。
本研究结果显示体内植入的导线数目是静脉阻塞发生的危险因素,与相关研究中得出的结论一致。Haghjoo 等[13]首次以100例起搏器更换患者为最大样本量报道,导线数目的增加是静脉阻塞的高危风险因素(OR=2.22,95%CI:1.03~4.76);Bulur 等[6]在84例植入双腔起搏器(包括额外增加1根除颤电极)的患者中发现导线数目的增加与静脉阻塞的发生呈正相关(OR=4.404,95% CI:1.211~16.010);Santini 等[7]研究184例起搏器及ICD植入的患者中,校正高血压、高血脂及糖尿病多个混杂因素后发现CRT(体内3根导线植入)是静脉严重狭窄的高危因素(OR=4.52,95% CI:1.10~18.50)。另外,导线数目增加可能导致心腔内存在多根废弃导线,对于年轻患者,考虑行导线拔除,减少静脉阻塞以及导线脱落等严重情况[14]。目前仍无基础实验证实导线数目增加导致静脉阻塞的病理基础。植入导线数目的增加直接引起静脉管腔直径减小,静脉内导线的微小移动有可能造成静脉的持续性机械损伤,不断激活血管内凝血机制,形成血栓造成静脉阻塞;导线长期作为异物在静脉内引起的炎症反应以及纤维化;可能是导致最终静脉阻塞或闭塞的机制。
器械植入术后的局部感染是静脉阻塞的另一相关因素。2014年Li等[9]在202例因感染或导线功能异常需导线拔除的患者中发现感染组(包括全身系统性及局部感染)静脉阻塞的发生率远高于非感染组(OR=3.94,32.0% vs.11.0%,P=0.002)。2002年Bracke等[15]研究89例感染或导线故障的患者发现,全身系统性感染组静脉阻塞的发病率远高于导线故障组(P=0.07),但在局部感染的患者中未发现明确相关性。我们推测感染通过导线播散至中心或外周循环中可能是术后感染患者静脉阻塞发生率高的机制之一。
研究另一结论发现入路静脉的穿刺次数的增加是术后静脉阻塞的危险因素。目前尚无关于静脉穿刺次数是否影响静脉阻塞的研究结论。在植入器械装置时,因术者的手术经验不足,入路静脉穿刺次数的增加,可能同样增加了术后静脉阻塞的风险。穿刺静脉能够造成内皮损伤引起局部的凝血机制激活反应性炎症反应。反复更换穿刺点穿刺静脉造成内皮损伤程度增加,不断激活局部的凝血机制以及反应性炎症反应可能是研究结果中入路静脉穿刺次数的增加导致静脉阻塞发生率增高的因素。
该研究具有所有横断面研究的局限性。首先,单中心患者数据在植入装置的型号、品牌、导线材料、直径等装置特征中差异较小,研究中未比较装置差异的影响。其次,研究纳入人群在2015~2019年因不同原因行起搏器更换者,年限较久,无法获得植入前静脉情况进行比对、无法评估静脉在术后发生阻塞/闭塞的具体时间、未获得抗凝药物的应用情况是否影响术后静脉阻塞的发生。最后,因研究样本量较小,静脉穿刺次数的增加与静脉阻塞发生相关的新结论强度较低;在其他研究中合并心力衰竭、心房颤动、ICD导线的应用等是静脉阻塞的危险因素的结论未得到论证。
结论:本研究发现在安装心律植入装置后静脉阻塞的发生率并不低,所以在设备更换、升级等手术中即使在无症状性静脉阻塞的患者中,应完善术前静脉造影评估静脉情况以确保手术的安全性。研究发现体内植入导线数目、穿刺次数的增加及术后感染是静脉阻塞发生的危险因素。但在此类高危患者中预防性应用抗凝药物是否延缓静脉阻塞发生尚不明确。我们仍需大型前瞻性研究证实相关结论。
