利用血管内超声结果验证定量血流分数对冠状动脉造影临界病变诊断价值的研究
2020-07-01李梦寰柳杨何源廖深根姚文明王骁智宋雯王晖
李梦寰,柳杨,何源,廖深根,姚文明,王骁智,宋雯,王晖
冠状动脉(冠脉)临界病变通常指冠脉造影发现血管狭窄40%~70%。这种病变是否引起心肌缺血及是否需要冠脉血运重建治疗,仍是临床面临的一大困境[1]。目前,冠脉血流储备分数(FFR)被认为是评估冠脉临界病变功能学的金标准。数个大规模、多中心、临床随机对照研究均显示:FFR<0.8时冠脉血运重建治疗是安全的,FFR指导的经皮冠脉介入治疗(PCI)近、远期主要不良心血管事件发生率均较低[2-6]。但FFR要求术中使用压力导丝及冠脉内注入血管扩张药物,且医疗费用高、手术时间长、冠脉内注药存在风险,其临床应用受到一定的限制。血管内超声(IVUS)能提供详细的冠脉解剖结构、准确的冠脉狭窄程度等信息。有研究显示,在非左主干病变中,IVUS测得的最小管腔面积(MLA)>4 mm2时,病变相关的主要不良心血管事件发生率低,可行延迟PCI[7-10]。Ben-Dor等[11]发现,IVUS测得的MLA及面积狭窄率(AS)与FFR呈中等程度相关,其对冠脉临界病变功能学诊断有一定参考意义。
定量血流分数(QFR)是一种无创的、体外评估冠脉功能学的方法,通过两个不同角度的冠脉造影(CAG)图像,构建成三维立体的目标冠脉,经血流速度校正得出QFR数值[12]。国内外数项前瞻性、多中心、临床随机对照研究证明,QFR与FFR一致性极好,以FFR为心肌缺血评估金标准时,QFR诊断的敏感度及特异度均很高[12-14]。QFR与IVUS参数之间的关系尚不明确。本文旨在使用无创的QFR系统来分析血管功能学意义,并探究其对血管管腔形态学狭窄程度的诊断价值。
1 资料与方法
研究对象:连续筛选2014年1月至2015年1月于南京医科大学第一附属医院心血管内科住院行CAG、目测冠脉病变狭窄为40%~70%且行IVUS检查的患者。所有CAG及IVUS结果均由两名冠心病介入技师判断得出。排除标准:CAG图像质量不佳,QFR平台无法自动获取血管轮廓;目标血管少于2个投照体位,或2个投照方向<25°;选取的2个投照体位血管暴露不充分,重叠过多;左主干病变、分叉病变、慢血流。
资料收集:患者的基本临床资料及IVUS测量参数(IVUS-MLA、IVUS-AS)均通过回顾住院电子病历系统获得;采用QFR测量系统获得QFR数值及三维CAG定量分析(3D-QCA)参数(包括直径狭窄率、病变长度、MLA、AS等)。
IVUS操作和测量:所有患者IVUS测定均参照美国心脏病学会制定的IVUS测定技术标准[15],具体过程:(1)采用波士顿公司生产的iLab超声诊断仪及冠脉超声成像导管(Atlantis SR),频率40 Hz,2.9 F血管内超声探头;(2)冠脉内注入200 μg硝酸甘油,静脉予以普通肝素5 000 U,排空超声成像,导管保护鞘内空气,经0.014 F导丝将超声导管送至血管远端,以0.5~1.0 mm/s速度自动撤回,同时记录超声图像。(3)血管段分析均在心脏舒张期时选择最狭窄血管横截面进行。(4)记录MLA及AS。AS=(参考管腔横截面积-MLA)/参考管腔横截面积×100%。
QFR测定方法:执行QFR测量的分析人员已通过QFR分析规范化培训。纳入的病变血管均采用离线QFR测量平台[版本AngioPlus1.0.1.1,博动医学影像科技(上海)有限公司,中国],具体操作过程如下[12]:(1)选取两个投照体位(角度>25°)的目标血管造影图像;(2)排除过度重叠、短缩的目标血管图像;(3)分别选取一帧舒张末期且目标血管内对比剂充盈良好的造影图像;(4)标记两个图像中同一处解剖位置,推荐分叉处作为解剖标志;(5)选取需要测量目标血管段,系统将自动描绘出二维血管轮廓(图1A、1B),且生成目标血管三维图像(图1C);(6)获取对比剂通过目标血管段的帧数以计算通过时间(造影采集速度15桢/s);(7)基于血管三维模型及流体动力学原理,系统计算出病变QFR值(图1E)。除了QFR数值外,系统还将给出三维QCA数据,如直径狭窄率、病变长度、MLA、AS等数据,并记录。以QFR≤0.8作为评估冠脉临界病变存在心肌缺血的标准[12],并将病变分为QFR≤0.8组及QFR>0.8组。
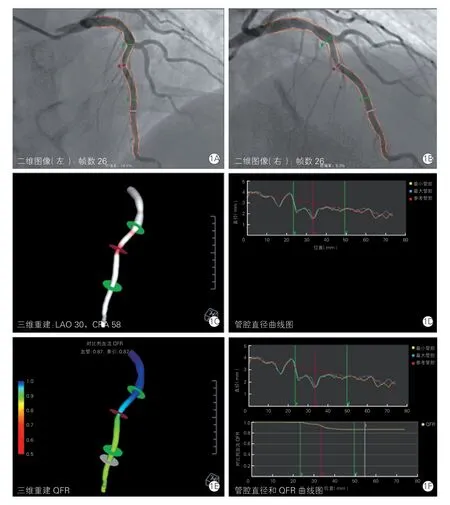
图1 定量血流分数操作过程
统计学方法:使用SPSS 19.0统计软件进行数据分析。符合正态分布的计量资料用均数±标准差表示,组间比较采用Studentt检验。计数资料用例数和百分比表示,采用卡方检验或Fisher确切概率法。通过Pearson及Spearman相关分析分别评估QFR与IVUS参数之间、冠脉病变目测狭窄程度评估及IVUS参数的关系及变异性,计算Cohen's Kappa系数对IVUS参数及QFR的诊断价值进行一致性评价。采用ROC曲线来分析QFR≤0.8对血管显著狭窄病变的预测价值。P<0.05为差异有统计学意义。
2 结果
符合研究标准的冠脉病变筛选流程:150处冠脉病变符合临界病变且行IVUS检查,其中57处病变目标血管两个投照体位重叠严重,21处病变两个投照方向<25°,9处病变图像质量不佳,最终共纳入57例患者、共62处病变,并完成QFR测定。
57例患者的一般资料和冠脉病变特点(表1):平均年龄为(62.8±9.5)岁,男性占77.2%。4例(7.0%)患者既往行PCI,38例(66.7%)患者诊断为不稳定性心绞痛。50处(80.6%)冠脉病变位于左前降支,13处(21.0%)病变QFR≤0.8。
QFR与IVUS参数相关性分析结果:线性回归分析(图2)显示,QFR与IVUS-MLA(R=0.477,P<0.001)之间存在中等程度正相关,QFR与IVUSAS之间呈较强负相关(R=-0.604,P<0.001);散点图(图3)显示,IVUS-MLA>4 mm2的冠脉病变QFR值均>0.8;在IVUS-MLA≤4 mm2的病变中,52.7%的病变QFR>0.8;在IVUS-MLA<3 mm2的病变中,40%的病变QFR≤0.8;在IVUSAS<70%的病变中,2处(5.1%)病变QFR≤0.8;在IVUS-AS>70%的病变中,11处(47.8%)病变QFR≤0.8。
QFR≤0.8组和QFR>0.8组患者一般临床资料和冠脉病变特征比较(表2、3):两组间患者的一般临床资料差异均无统计学意义。QFR≤0.8组的靶病变IVUS-MLA小于QFR>0.8组[(3.04±0.52)mm2vs.(4.15±1.16)mm2],前者IVUSAS[(76.03%±5.65%) vs.(60.19%±10.79%)]更高(P均<0.001)。3D-QCA分析显示,QFR≤0.8组的病变血管AS(68.60%±9.71% vs.50.33%±12.44%,P<0.001)、直径狭窄率(55.92%±8.05% vs.37.74%±7.95%,P<0.001)均高于QFR>0.8组(P均<0.001),但两组的病变长度无明显差异[(34.16±23.76)mm vs.(20.45±9.82)mm,P=0.063]。
冠脉病变目测狭窄程度与IVUS-AS相关性散点图(图4):冠脉病变目测狭窄程度与IVUS-AS存在一定相关关系,但相关程度较低(rs=0.453,P<0.001)。

表1 57例患者的一般资料及冠状动脉病变特点[例(%)]

图2 IVUS-MLA、IVUS-AS与QFR之间的线性回归分析图
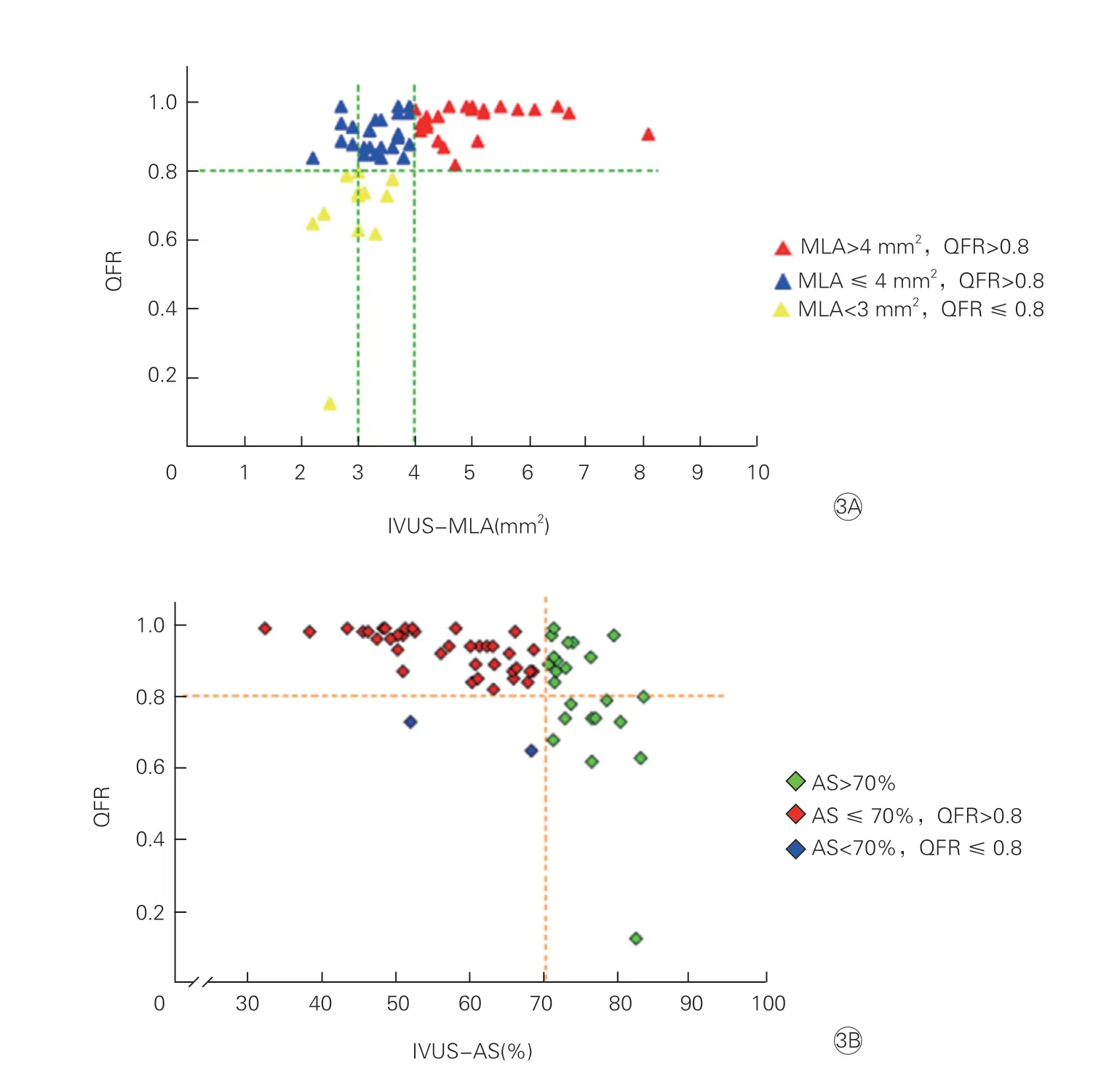
图3 IVUS-MLA(3A)、IVUS-AS(3B) 与QFR之间的散点图
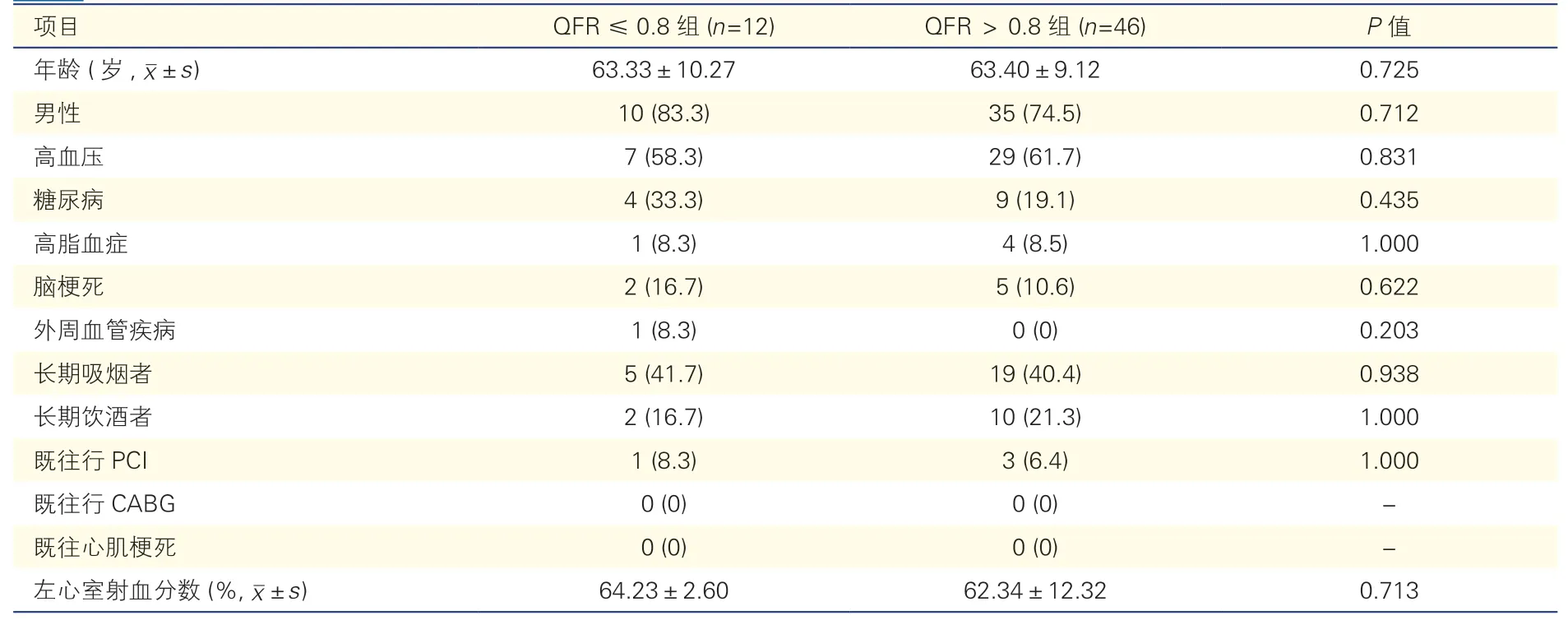
表2 QFR≤0.8组和QFR>0.8组患者一般临床资料比较[例(%)]*

表3 QFR≤0.8组和QFR>0.8组患者冠状动脉病变特征比较
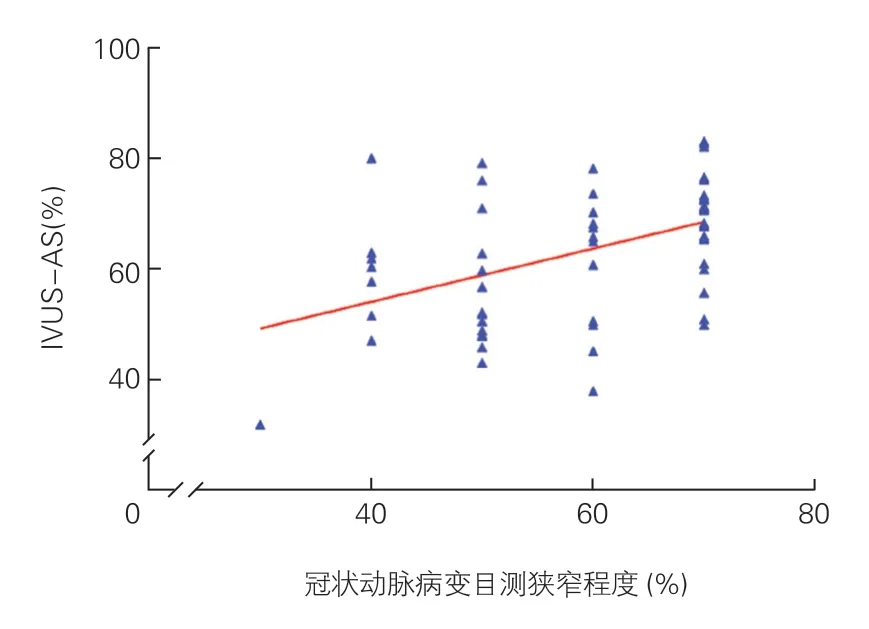
图4 冠状动脉病变目测狭窄程度及IVUS-AS相关性散点图
以IVUS-MLA<4 mm2或IVUS-AS>70%作为血管显著狭窄诊断标准时,QFR≤0.8作为诊断界值的ROC曲线分析结果(图5):QFR值预测IVUSMLA<4 mm2的曲线下面积(AUC)为0.822(95%CI:0.717~0.926,P<0.001),QFR≤0.8对应的敏感度为32.4%,特异度为96.0%,阳性预测值为92.3%,阴性预测值为49.0%;QFR值预测IVUS-AS>70%的AUC为0.746(95%CI:0.617~0.876,P=0.001),QFR≤0.8对应的敏感度为47.8%,特异度94.9%,阳性预测值为84.6%,阴性预测值为75.5%。
以IVUS-MLA<4 mm2或IVUS-AS>70%作为冠脉显著狭窄病变诊断标准时,QFR≤0.8作为诊断界值的一致性分析结果:QFR与IVUS-MLA判断结果的Cohen's Kappa系数为0.246(95%CI:0.085~0.407,P=0.007),具有一般强度一致性;而QFR与IVUS-AS判断结果的Cohen's Kappa系数为0.469(95%CI:0.246~0.692,P<0.001),具有中等强度一致性。

图5 以IVUS-MLA<4 mm2(5A)或IVUS-AS>70%(5B)作为血管显著狭窄诊断标准时QFR≤0.8作为诊断界值的ROC曲线
3 讨论
近年来,用无创方法来识别冠脉狭窄性病变是否存在心肌缺血越来越受到关注。FAVOR ⅡChina研究显示,QFR与基于压力导丝的FFR测定结果一致性达92.7%[12],该研究也在国外其他多个中心得到了验证[14,16-17]。本研究比较了QFR与IVUS参数之间的关系,我们发现QFR与IVUSMLA(R=0.477,P<0.001)存在中等程度相关,与IVUS-AS相关性更强(R=-0.604,P<0.001)。当QFR≤0.8时,IVUS-MLA更小,IVUS-AS更高。Ben-Dor等[11]比较了FFR与IVUS参数的关系,发现FFR与MLA呈正相关,与AS呈负相关,并具有中等程度相关;因FFR与QFR极好的一致性,本研究结果在一定程度上为上述研究结果提供了证据支持。我们的研究结果显示,QFR≤0.8组中的冠脉病变长于QFR>0.8组,但差异并无统计学意义(P=0.067),也许增加样本量,两组间的冠脉病变长度差异可能会达到统计学意义。
在临床实践中,血管狭窄程度越严重往往提示心肌缺血越重。多项回顾性研究比较了IVUS参数与FFR之间的关系,均提示血管狭窄越严重,FFR值越低[11,18]。因QFR具有无创的优点,我们尝试分析QFR对血管显著狭窄病变的诊断价值。一致性检验分析显示,以IVUS-MLA及IVUS-AS作为诊断血管显著狭窄病变标准时,QFR≤0.8与IVUS的诊断一致性较好。QFR≤0.8对IVUS-MLA<4 mm2诊断血管显著狭窄病变的敏感度为32.4%,特异度为96.0%,阳性预测值为92.3%,阴性预测值为49.0%;QFR≤0.8对IVUS-AS>70%诊断血管显著狭窄病变的敏感度为47.8%,特异度为94.9%,阳性预测值为84.6%,阴性预测值为75.5%。该研究结果显示,QFR对血管显著狭窄病变具有较高的诊断价值。
我们希望通过使用无创的方法,除了获取靶血管功能学信息,还可以了解靶血管形态学特征,推测靶血管病变的狭窄程度,为术者术中决策的制定提供更多信息。本研究的局限性在于,研究结果由单中心样本得出,样本量偏少,仍需多中心数据进一步验证。
