国际抗癌联盟(UICC)第8版肺癌分期方案的验证*
2020-07-01
在所有恶性肿瘤中,肺癌的发病率和死亡率在中国乃至全世界均位居首位[1]。肺癌中约85%病例为非小细胞肺癌(non-small cell lung cancer,NSCLC),其5年总生存率(overall survival,OS)仅为15%[2]。TNM分期系统已广泛应用于NSCLC,以预测患者预后并指导临床治疗决策[3]。
2018年1月,美国癌症联合委员会(AJCC)和国际抗癌联盟(UICC)发布了第8 版TNM 肺癌分期系统[4]。该版本基于国际肺癌研究协会(IASLC)最新数据库的信息进行修订,数据库包含从1999年至2010年94 708 例被诊断为肺癌的患者信息[5]。尽管其中大部分患者来自亚洲,但主要为日本患者,仅不足1%的患者来自中国[6]。考虑到中国是世界上肺癌患者最多的国家,而且中国患者的临床特征与日本患者不同,因此仅1%患者的资料可能无法很好地反映出中国患者的真实情况[7]。此外,在过去的10年中,靶向治疗和免疫治疗在改变肺癌患者的预后和临床治疗模式中发挥越来越重要的作用[8]。因此,亟需应用最近10年之内更大量的中国患者的数据对第8版TNM分期系统进行外部验证。
本研究分别按照第7版和第8版TNM分期系统,对在北京大学肿瘤医院行手术治疗的3 825 例NSCLC 患者资料进行重新分期,以期评估新分期系统在中国患者中的临床意义并讨论其潜在问题。
1 材料与方法
1.1 病例资料
收集2010年6月至2018年4月在北京大学肿瘤医院行手术治疗的3 825 例Ⅰ~Ⅳ期NSCLC 患者的临床资料。
1.2 方法
1.2.1 术前检查 手术前常规行颅脑磁共振成像(MRI)、全身骨扫描及腹部和锁骨上超声,以及肺功能检查和心脏评估。考虑医疗费用,非常规行PETCT检查。
1.2.2 术后随访 患者术后2年之内每3个月复查1次,术后2~5年间每6个月复查1次,术后5年每1年复查1 次,复查项目包括胸部CT、腹部和锁骨上超声,以及肺部肿瘤标记物。
1.3 统计学分析
采用SPSS 20.0软件进行统计学分析。应用Kaplan-Meier法绘制生存曲线,使用Log-rank检验评估各亚组之间差异。以P<0.05为差异具有统计学意义。
2 结果
2.1 患者特征
研究共纳入3 825 例受试者,其中男性2 218 例,女性1 607 例,中位年龄(62.0±7.1)岁,年龄24~89岁。在所有患者中,2 292 例患者行肺叶切除术(59.9%)。其他手术方式:楔形切除术846 例(22.1%),肺段切除术385 例(10.1%),联合肺叶切除术119 例(3.1%),全肺切除术116 例(3.0%),开胸探查手术67例(1.8%)。在所有3 825例患者中,964例患者(25.2%)接受了新辅助治疗,其中558例(14.6%)和406例(10.6%)分别接受了新辅助化疗和新辅助靶向治疗。分别有1 125 例(29.4%)和779 例(20.4%)≥ⅠB期患者接受了辅助化疗或辅助靶向治疗。584例(15.3%)患者接受了术后放疗。术后病理类型:3 026 例(79.1%)腺癌,597 例(15.6%)鳞状细胞癌,79例(2.1%)腺鳞癌,76 例(2.0%)大细胞癌和47 例(1.2%)病理类型为包括类癌、未分化癌和小细胞癌的其他类型肺癌(表1)。
2.2 病理分期
根据第7版肺癌分期系统进行分期后,3 825例患者的病理分期:pⅠA期1 104例(28.9%),pⅠB期859例(22.5%),pⅡA期475例(12.4%),pⅡB期370例(9.7%),pⅢA期817例(21.4%),pⅢB期109例(2.8%),pⅣ期91例(2.4%)(图1A)。
按照第8版分期系统进行分期后,pⅠA1期372例(9.7%),pⅠA2 期314 例(8.2%),pⅠA3 期418 例(10.9%),pⅠB期526例(13.8%),pⅡA期333例(8.7%),pⅡB期609例(15.9%),pⅢA期716例(18.7%),pⅢB期446例(11.7%),pⅣA期91例(2.4%)。因本研究数据均来源于手术患者,故不包含按照第8版分期属于ⅢC期及ⅣB期的病例资料(图1B)。

表1 3 825例NSCLC患者的临床资料
相比第7版分期,按照第8版肺癌分期方案进行分期后,906例(23.7%)病例出现病理分期变化,而且全部由较早分期转向了较晚分期(表2)。
2.3 生存分析
按照第7 版进行分期后,除pⅢB 期的生存曲线在pⅣ期的生存曲线之下以外,其他各期的生存曲线均随着分期的升高而降低;除pⅢB期和pⅣ期之间外(P=0.931),每两个相邻亚组之间的差异均具有统计学意义(图2A);按照第8版进行分期后,其他各期的生存曲线均随着分期的升高而降低;除ⅠA1 期和ⅠA2期以外(P=0.057),每两个相邻亚组之间的差异均具有统计学意义(均P<0.05)。因本研究所有资料均来源于手术病例,故不包含按照第8 版分期后的ⅢC期患者(图2B)。
分别按照第7版和第8版的T分期进行分期后显示,随着T分期的升高,各亚组的生存曲线逐步下降,并且每两个相邻亚组之间的差异均具有统计学意义(P<0.05,图3)。
第8版分期未对N分期进行修改,按照第7版和第8版相同的N分期定义进行分期后显示,随着N分期的升高各亚组的生存曲线逐步下降,并且每两个相邻亚组之间的差异均具有统计学意义(P<0.05),因本研究所有资料均来源于手术病例,故不包含N3期患者(图4)。
对于M分期,由于本研究中所有资料均来源于手术病例,按照第8版分期后无M1c期患者数据,因此第7版和第8版的生存曲线相同,如图5所示,M0期和M1a期之间差异具有统计学意义(P<0.001),但M1a期和M1b期之间差异无统计学意义(P=0.397,图5B)。

图1 按照UICC系统分期后各分期的患者数量

表2 按照UICC第8版肺癌分期系统分期后患者的分期变化情况 例

图2 按照UICC系统分期后各分期患者的生存曲线
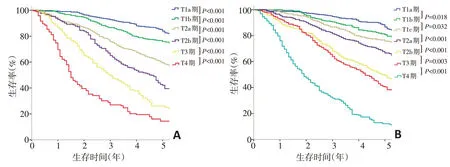
图3 按照UICC T分期系统分期后各分期患者的生存曲线

图4 按照UICC第8版N分期系统分期后各分期患者的生存曲线

图5 按照UICC第8版M分期系统分期后各分期患者的生存曲线
3 讨论
随着现代医学的进步,人们对肺癌的了解不断深入,分期系统作为指导预后和治疗的“国际语言”随之不断地修订[9]。UICC肺癌分期系统大约每10年更新1次,目前最新版的肺癌分期是UICC和AJCC于2018年1月发布的第8 版分期系统[4],最新的版本在近年临床实践中争议较大的几个方面均给出了意见。
在应用第7版及之前的肺癌TNM分期系统时,术后病理分期为ⅡA~ⅢA期的患者均建议进行术后辅助化疗,而ⅠB期患者手术后是否需要接受辅助化疗尚存争议[10]。CALBG 9633研究是唯一一项仅关注于ⅠB期肺癌辅助化疗患者的大型随机研究,该试验按照第7版肺癌分期系统进行分期。结论是ⅠB期患者接受辅助化疗的总生存期与未接受辅助化疗的总生存期差异无统计学意义(HR=0.83,P=0.12),即ⅠB期肺癌患者总体上未能从辅助化疗中获益。而该试验的子集分析却显示,肿瘤直径≥4 cm的ⅠB期患者接受辅助化疗可延长总生存期(HR=0.66,P=0.04)[11-12]。进入第8版分期时代后,由于第8版肺癌分期将T2a期的肿瘤最大径由第7版的3~5cm改为3~4 cm,而将4~5 cm的肿瘤归入T2b期,令第7版中肿瘤4~5 cm的ⅠB期患者在第8版中变更为ⅡA期。因此若应用第8版分期,CALBG 9633研究的结论则是,术后辅助化疗可以使ⅡA期NSCLC患者生存获益,而对ⅠB期NSCLC患者无效,近期多个大样本量研究也证实上述结论[13-14]。
肺叶切除术与亚肺叶切除术哪种是治疗磨玻璃样肺癌的最佳手术方式,该问题也是肺癌外科界争议的焦点之一[15]。自第6版肺癌分期时代开始,大量随机研究已关注此问题,不同的分期指导着不同研究的制定标准。在第6 版分期时代,肺癌研究小组(LCSG)开展的082研究按照第6版分期中的T1期与T2 期的分界(肿瘤直径3 cm),比较分界点上下分别接受肺叶切除术和亚肺叶切除术患者的生存差异。结果表明,尽管两组之间的总生存期无显著性差异,但亚肺叶切除组的3年局部复发率显著高于肺叶切除组,表明以3 cm为分界点欠合理[16]。在第7版分期时代,3个大型研究对肺叶切除与亚肺叶切除进行比较(CALGB140503、JCOG0802 和EORTC1223),均使用2 cm 作为分界点,即第7 版中的T1a 期与T1b 期的分界,但亚肺叶切除组的复发率仍高于肺叶切除组[17],预示着2 cm 仍不是适合区分行肺叶切除还是亚肺叶切除的合适分界点,可以用以判断行肺叶还是亚肺叶切除术的肿瘤大小的分界点仍需进一步下调[18]。在第8 版分期中,T1 期以1 cm 为间距进一步分为T1a、T1b和T1c期,ⅠA期也因此分为ⅠA1、ⅠA2和ⅠA3 期。在第8 版分期的指导下,有关肺叶切除术或亚肺叶切除术治疗磨玻璃样肺癌的探索有望进入一个新时代。
分期的主要作用之一即为指导治疗方式的选择,一般认为ⅢA 期与ⅢB 期是能否手术的分期界限,ⅢA 期患者可以接受手术,而ⅢB 期患者一般不建议行手术治疗。由于预后较差,第8 版分期中T3N2M0 期由ⅢA 期移至ⅢB 期,这一改动使得这部分患者不再属于可手术的范围。但本研究显示,T3N2M0期患者的生存曲线接近T2N2M0 ⅢA期患者的生存曲线,而明显优于T4N2M0 ⅢB 期患者(P=0.008)。显然,上述结果不支持第8 版分期中对T3N2M0期的升期。
有研究表明,肺癌患者的预后与肿瘤大小存在直接的相关性[19]。在第8 版分期的修订中,T 分期的变化最大,而其中最值得注意的是最大直径≤3 cm的肿瘤被进一步细分为T1a期(≤1 cm),T1b期(1~2 cm),T1c 期(2~3 cm)。本研究结果显示,T1a 期和T1b 期之间(P=0.018)以及T1b期和T1c期之间(P=0.032)的预后存在显著性差异,这一结论支持了第8版中对肿瘤直径≤3 cm的进一步细分。
UICC 肺癌分期第8 版建议继续应用第7 版分期中对于N分期的定义,本研究证实了该N分期定义对区分不同亚期患者预后的准确性。
在第8 版分期中,进一步将第7 版中的M1b 期(胸腔外转移)分为M1b 期(胸腔外单病灶转移)和M1c 期(胸腔外多病灶转移)。由于本研究所有患者均为手术病例,因此本研究中无M1c期患者。本研究中91 例M1a 期患者计划行根治性切除术,但在术中探查时发现胸膜播散转移,经病理诊断证实为pM1a期患者;13 例M1b 期患者术前检查时发现胸腔外器官寡转移(如单个颅脑转移或单个肾上腺转移),并于肺癌切除术前或术后行转移器官的根治性手术或根治性放疗。本研究结果显示,M0 期和M1a 期之间的生存曲线存在显著性差异(P<0.001),但M1a 期和M1b 期之间无显著性差异(P=0.397)。有研究报道,将原发肿瘤及单发转移瘤均行切除并辅以综合治疗,相比于非手术治疗,可以延长患者的生存期[20]。因此,本研究支持将M1b期进一步分为M1b期和M1c期,以利于医生选择适合接受更为积极的局部和全身治疗的患者。
综上所述,本研究在3 825 例接受外科手术治疗的NSCLC患者中通过T、N和M分期来探索两个分期系统之间的生存差异。研究发现,与第7 版分期相比,第8 版提供了更为准确的预后信息,尤其是对病理分期为ⅠA1、ⅠA2和ⅠA3期的肺癌患者。
