解淀粉芽孢杆菌NS2降解玉米赤霉烯酮的研究
2020-07-01张晨曦YawaMinnieElodieFolly赵月菊
张晨曦 Yawa Minnie Elodie Folly 赵月菊 刘 阳
(中国农业科学院农产品加工研究所/农业农村部农产品质量安全收贮运管控重点实验室,北京 100193)
玉米赤霉烯酮(zearalenone,ZEN)是一种非甾体雌激素真菌毒素,可通过聚酮类合成代谢途径在各种镰刀菌属(Fusarium)真菌中进行生物合成,如禾谷镰刀菌(Fusarium graminearum)、半裸镰刀菌(Fusariumsemitectum)、克鲁克韦伦斯镰刀菌(Fusariumcrookwellense)、黄色镰刀菌(Fusariumculmorum)和木贼镰刀菌(Fusariumequiseti)等[1]。ZEN 毒素是污染最为广泛的毒素之一,具有遗传毒性、细胞毒性、血液毒性、肝毒性、肾毒性和免疫毒性,其中遗传毒性最为严重[2]。ZEN 的化学式与雌二醇类似,可以竞争性地与雌激素受体结合,从而在人和动物中蓄积引发雌激素效应,如影响雌性哺乳动物胸部乳腺发育、引发排卵不规律、外阴炎症甚至造成假性怀孕、流产等[3-6]。近年来,在全球20 多个国家的食品和饲料调查中,ZEN毒素污染十分广泛[7]。如2017年,周建川等[8]测定了1 034 个饲料原料及配合饲料样品中的ZEN 含量,玉米副产物、全价饲料的超标率分别达28.89%和13.53%。朱文倩[9]采集了我国159 例玉米油样本,对其ZEN 含量进行检测,结果显示大多数玉米油中都含有ZEN 毒素,浓度最高可达1 950 μg·kg-1,远超过欧盟植物油中ZEN 的限量(400 μg·kg-1)[10]。由此可见,我国食品和饲料中ZEN 的污染十分严重,应引起人们足够的重视。筛选高效降解ZEN 的脱毒菌,开发有效安全的脱毒技术,可为研发食品和饲料ZEN 污染预警技术、防控和脱毒技术提供理论依据和方法途径,具有十分重要的科学意义。
生物消减技术可在温和条件下去除真菌毒素,具有高效、特异、环境友好的特点,同时也极少会造成食品和饲料中营养成分的损失以及口味风味的改变[11-12]。研究表明多数真菌和细菌具有去除ZEN 的功能,Zhang 等[13]筛选到1 株对ZEN 具有高效去除作用的酿酒酵母,可在48 h 内完全消减5 μg·mL-1的ZEN;葛婵婵等[14]筛选到2 株芽孢杆菌,可在8 h 内将10 μg·mL-1的ZEN 完全消减,主要活性成分来源于胞外酶;龙淼等[15]报道红球菌(Rhodococcussp.)SYA13,可在72 h 将5 μg·mL-1的ZEN 去除87.1%。但是仅根据检测ZEN 的含量来衡量脱毒效果存在不科学性,因为去除毒素并不等于降解成无毒产物。如ZEN 可通过C-6’-酮羰基还原途径,代谢为2 种立体异构体,即α-玉米赤霉烯醇(α-zearalenol,α-ZOL)和β-玉米赤霉烯醇(β-zearalenol,β-ZOL)。这2 种物质均具有雌激素效应,且三者的雌性激素活性顺序依次为α-ZOL>ZEN >β-ZOL,其中α-ZOL 的毒性为ZEN 的200%[16]。通过这种代谢途径反而增强了毒性效应,并不是真正的脱毒。因此研究生物降解机制,分析降解产物的毒性以及对在食品和动物饲料中添加微生物的安全性评价具有重要的意义。
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)是一种益生菌,是欧洲食品安全局(European Food Safety Authority,EFSA)认定的安全菌株,可作为饲料添加剂[17]。该菌已多年用于生产商业中重要的酶和代谢物[18],如淀粉酶和β-葡聚糖酶已被列为农业部令(2013年2045 号)允许使用的酶制剂类饲料添加剂。解淀粉芽孢杆菌还具有抑制灰葡萄孢、链格孢、尖孢镰刀菌、大肠杆菌、沙门氏菌等多种病原菌生长的作用[19]。张子豪等[20]从土壤中筛选到1 株解淀粉芽孢杆菌,其对大肠埃希氏菌具有显著的抑菌效果,抑菌圈直径可达25.5±0.5 mm。刘宇帅等[21]发现解淀粉芽孢杆菌通过分泌抗菌脂肽芬芥素对尖孢镰刀菌和禾谷镰刀菌显示出较强的抑菌活性。陈楠楠等[22]在探究解淀粉芽孢杆菌抗菌机制时发现解淀粉芽孢杆菌能够产生种类繁多的抑菌物质,有效地抑制真菌和其他细菌的活性。这些研究充分说明解淀粉芽孢杆菌具有充分的应用潜力和商业价值。
本研究筛选到1 株对ZEN 具有明显降解效果的菌株NS2,经16S rDNA 鉴定发现其为解淀粉芽孢杆菌,分别在液体培养基和固态发酵中研究了菌株NS2对ZEN 的降解能力,并对其降解产物以及代谢途径进行了分析,同时对该菌株抗微生物活性进行评估,旨在为ZEN 解毒产品的开发与应用奠定材料基础。
1 材料与方法
1.1 主要材料与试剂
1.1.1 样品与主要试剂 玉米、小麦、大麦3 种粮食样品,从我国湖南、江苏、四川、安徽、江西、河北、山西,7 个省份采集,于-20℃保存,具体采集信息见表1。ZEN 标准品(纯度99%)、α-ZOL 和β-ZOL,购自德国Sigma-Aldrich 公司;聚合酶链式反应(polymerase chain reaction,PCR)等相关分子试剂,购自北京擎科新业生物技术有限公司;乙腈为色谱纯,其他化学试剂为分析纯。
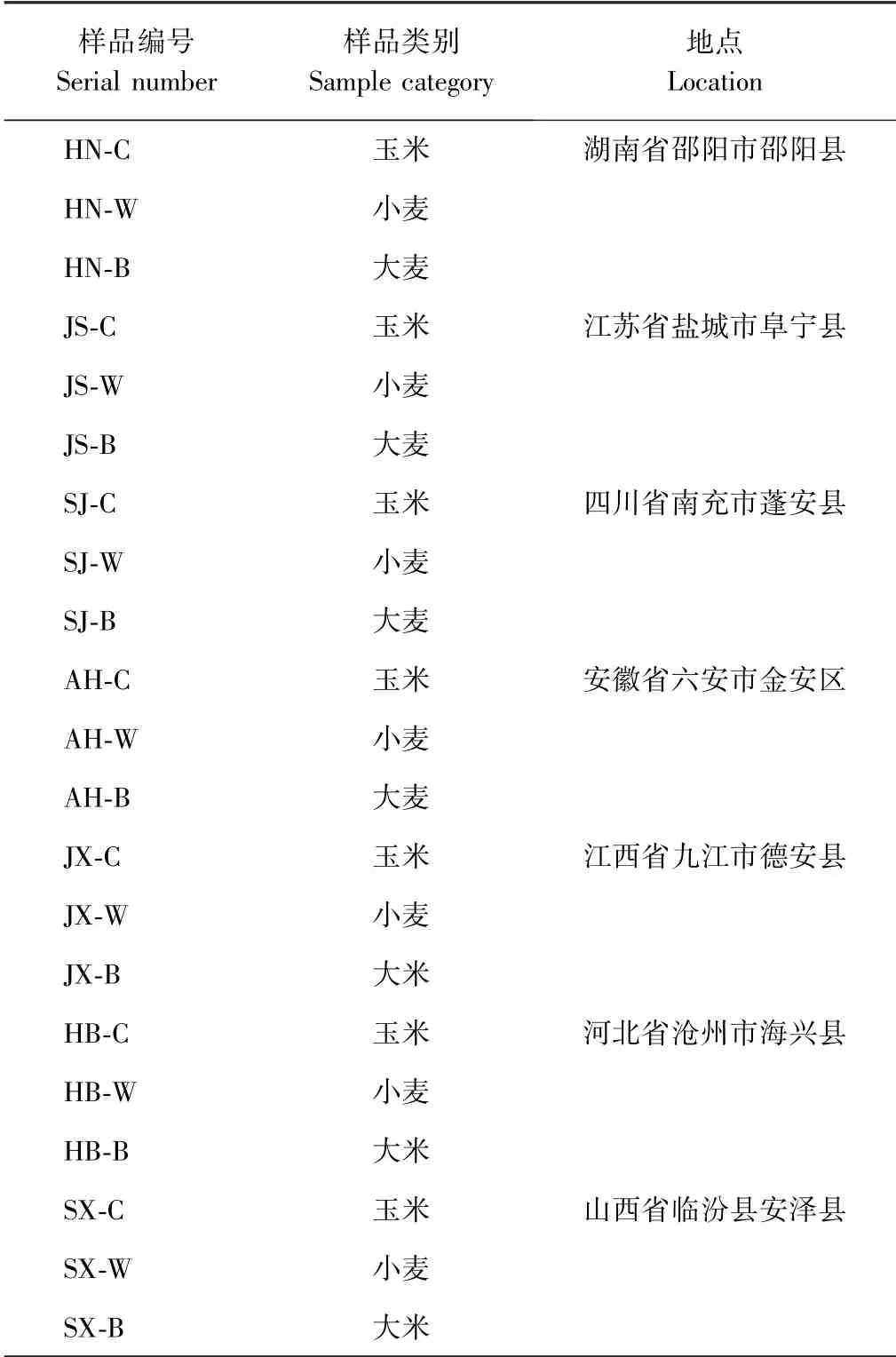
表1 样品采集信息Table 1 Sample collection information
1.1.2 主要培养基 无机盐培养基(minimal medium,MM)[23]:1.6 g·L-1Na2HPO4、1 g·L-1KH2PO4、0.5 g·L-1MgSO4·7H2O、0.5 g·L-1NaNO3、0.5 g·L-1(NH4)2SO4、0.025 g·L-1CaCl2·2H2O,于121℃高压灭菌15 min 后加入2 mL 微量金属溶液和1 mL 维生素溶液。
微量金属溶液(trace metal solution):1.5 g·L-1FeCl2·4H2O、0.19 g·L-1CoCl2·6H2O、0.1 g·L-1MnCl2·4H2O、0.07 g·L-1ZnCl2、0.062 g·L-1H3BO3、0.036 g·L-1Na2MoO4·2H2O、0.024 g·L-1NiCl2·6H2O、0.017 g·L-1CuCl2·2H2O,用无菌过滤器(0.22 μm)过滤。
维生素溶液:2 mg·L-1生物素、2 mg·L-1叶酸、5 mg·L-1核黄素、5 mg·L-1烟酸、5 mg·L-1硫铵素盐酸盐、10 mg·L-1吡哆醇盐酸盐、50 mg·L-1维生素B12、5 mg·L-1泛酸钙、5 mg·L-1对氨基苯甲酸、5 mg·L-1硫辛酸,用无菌过滤器(0.22 μm)过滤。
营养肉汤(nutrient broth,NB)培养基[24]:10 g·L-1蛋白胨、3 g·L-1牛肉膏、5 g·L-1NaCl,121℃高压灭菌15 min。
营养肉汤琼脂(nutrient broth agar,NA)培养基:10 g·L-1蛋白胨、3 g·L-1牛肉膏、5 g·L-1NaCl、15 g·L-1琼脂,121℃高压灭菌15 min。
1.2 主要仪器与设备
HR30-IIA2 型生物安全柜,青岛海尔股份有限公司;LS-50HD 型立式压力蒸汽灭菌锅,江阴滨江医疗设备有限公司;DRP-9052 型电热恒温培养箱,上海森信实验仪器有限公司;SZ2-1LST 型电子显微镜,日本Olympus 公司;SCIENTZ-950E 超声波细胞破碎机,宁波新芝生物科技有限公司;T100 型PCR 仪,美国Bio-Rad 公司;Agilent 1260 高效液相色谱仪、Agilent 1200高效液相色谱仪、Agilent 6520 ESI-Q-TOF,美国安捷伦公司。
1.3 试验方法
1.3.1 降解ZEN 菌株分离 采用王国兵等[25]的方法并进行适当修改。准确称量10 g 粮食样品置于250 mL 无菌三角瓶中,加入90 mL 无菌蒸馏水,28℃、180 r·min-1震荡15 min 后获得细菌悬浮液。用无菌蒸馏水稀释至浓度梯度10-6、10-7、10-8,取100 μL 涂布在NA 平板上。30℃培养24 h 后用接种环挑取不同形态的单菌落,划线于NA 平板上纯化。将纯化后的菌株接种到NB 培养基中,30℃、180 r·min-1培养24 h,获得纯化后菌液。
1.3.2 降解ZEN 菌株筛选 试验组:向无菌10 mL离心管中加入985 μL 新鲜MM 和5 μL 100 μg·mL-1的ZEN 标准品。加入10 μL 1.3.1 所述的纯化后菌液,充分混匀,于28℃、180 r·min-1震荡培养72 h。对照组:取10 μL 不接菌的NB 培养基加入990 μL 含5 μg·mL-1ZEN 的MM 中[26]。
使用Romer 免疫亲和净化柱对ZEN 标准品、对照组、试验组样品中毒素进行净化提取,用高效液相色谱荧光检测器(high performance liquid chromatographyfluorescence detector,HPLC-FLD)对净化提取得到的样品进行检测[27]。
Romer 免疫亲和净化柱提取方法[27]:取1 mL 样品,加入5 mL 84%乙腈,混匀,旋涡震荡3 min。10 000 r·min-1离心5 min 后用0.22 μm 过滤器过滤。取3 mL 过滤后样品,加入25 mL 20 mmol·mL-1pH 值7.4 的磷酸盐缓冲溶液(phosphate buffer saline,PBS)过免疫亲和柱。用10 mL PBS 淋洗,0.5 mL 甲醇洗脱3 次,过0.22 μm 过滤器。
HPLC-FLD 检测条件[28]:流动相乙腈∶水=70∶30;流速1 mL·min-1;色谱柱:Agilent ZorbaxSB-C18 柱(4.6 mm×250 mm,5 μm);激发波长274 nm,发射波长440 nm;柱温30℃;进样量20 μL。
ZEN 降解率=(对照组残留ZEN 含量-试验组残留ZEN 含量)/对照组ZEN 含量×100%[29]。
1.3.3 ZEN 降解菌鉴定 ZEN 降解菌形态学及生理生化鉴定方法参照《伯杰氏系统细菌学手册》[30]。根据《常见细菌系统鉴定手册》中的试验方法[31]利用细菌16S rDNA 通用引物(27F:5′-AGAGTTTGATCCTGGC TCAG-3′;1492R:5′-TACCTTGTTACGACTT-3′)对菌株NS2 的16S rDNA 基因序列进行测定分析,测序结果在NCBI 使用BLAST 比对,从GenBank 数据库中获得与菌株16S rDNA 源的公认标准序列数据[32],并利用软件MEGA 7.0 采用最大似然法分析NS2 的16S rDNA基因与相似种属的进化关系[33]。
1.3.4 ZEN 降解菌特性分析
1.3.4.1 降解菌的抗微生物活性试验 参照Teather等[34]和Guo 等[35]的方法。将ZEN 降解菌点在NA 平板中心,于28℃培养24 h 后,转移至氯仿蒸汽中,30 min,将氯仿蒸发20 min。取NB 中的0.1 mL 108CFU·mL-1大肠杆菌和鼠伤寒沙门氏菌涂布在平板上,并将样品于28℃培养16~18 h,测量抑制圈直径。
1.3.4.2 降解菌的木聚糖酶、羧甲基纤维素酶、蛋白酶活性测定 在分别含有木聚糖、羧甲基纤维素和脱脂乳的固体培养基上检测ZEN 降解菌细胞外木聚糖酶、羧甲基纤维素酶和蛋白酶活性。具体操作:将ZEN 降解菌点在含0.5%木聚糖-NA 平板中心,并于28℃培养72 h 后,加入0.5%刚果红染色15 min,然后用1 mol·L-1NaCl 溶液洗涤2 次除去过量的染料,菌落周围若出现清晰区域则表明有木聚糖酶产生;与木聚糖酶活性测定类似,含0.5% 羧甲基纤维素-NA 平板用于羧甲基纤维素酶测定;在脱脂乳平板上检测蛋白酶活性[36]。
1.3.5 ZEN 降解菌降解活性成分分析 参考Guan等[37]的方法。挑取ZEN 降解菌单菌落于4 mL NB 培养基中,28℃、180 r·min-1预培养4 h,将1 mL 培养物转移至100 mL MM 中,28℃、180 r·min-1继续培养48 h。将菌液4℃、5 000 r·min-1离心10 min 获得胞外上清液和菌体细胞沉淀。将胞外上清液用无菌0.22 μm过滤器过滤,将沉淀的菌体用50 mmol·L-1PBS 缓冲液(pH 值7.4)清洗3 次后并用相同缓冲液重悬至细胞浓度为3 g·mL-1获得菌体细胞。另准备一份相同的菌体细胞用超声波细胞破碎机在冰上进行破碎,超声程序:输出功率325 W;总工作时间25 min;工作/间歇时间为5 s/5 s,超声后于4℃、12 000 r·min-1离心10 min,使用无菌0.22 μm 过滤器过滤上清液,得到细胞内容物。
取5 μL 浓度为100 μg·mL-1的ZEN 标准品溶液置于10 mL 离心管中,加入985 μL 新鲜MM。加入10 μL 上述获得的胞外上清液、菌体细胞和细胞内容物,充分混匀后在28℃、180 r·min-1(旋转半径20 mm)条件下震荡培养72 h,10 000 r·min-1离心10 min 去除细胞,收集上清液。对照组:取10 μL 50 mmol·L-1PBS加入体积为990 μL 的含5 μg·mL-1ZEN 的MM。然后按照1.3.2 的方法提取毒素,用于HPLC-FLD 检测,并计算ZEN 降解率。
1.3.6 ZEN 降解产物的提取和检测 按1%接种量接种已培养好的ZEN 降解菌菌液至含有5 μg·mL-1ZEN的5 mL MM 中,28℃、180 r·min-1震荡培养36 h,8 000 r·min-1离心10 min,取2.5 mL 上清液用于提取降解产物。将5 mL 仅含有5 μg·mL-1ZEN 的MM 设为阳性对照,5 mL 仅含有NS2 的MM 设为阴性对照。
对于水溶性降解产物,样品用乙腈-水(84∶16,v/v)萃取;对于水不溶性降解产物,用氯仿(1∶1,v/v)萃取。萃取完成后于氮吹仪干燥,用甲醇-水(7∶3,v/v)悬浮,并采用高效液相色谱与四级杆飞行时间质谱联用技术(high performance liquid chromatography and quadrupole time-of-flight mass spectrometry,HPLC-QTOF-MS)进行分析[38]。
LC 检测条件:Agilent 1200 高效液相色谱仪,色谱柱Agilent Plus C18(2.1 mm×100 mm,3.5 μm。流动相A 为100%水,流动相B 为100%乙腈。梯度洗脱程序为0~5 min,30%流动相B;5~15 min,30%~50%流动相B;15~30 min,50%流动相B;30~36 min,90%流动相B,36~37 min,90%~30%流动相B;37~49 min,30%流动相B。总运行时间49 min,流速 0.2 mL·min-1,注射体积5 μL。柱温30℃。
MS 检测条件[39]:Agilent 6520 ESI-Q-TOF,电喷雾电离(ESI),毛细管电压为3.5 kV,碎裂电压为135Ⅴ,分离器为65 Ⅴ。脱溶剂气体温度为350℃,干燥气体流速为9 L·min-1,雾化器为45 psi,碰撞气为氮气。使用扩展的动态范围和1.4 光谱/秒的扫描速率以及通过改变碰撞能量与质量,检测方式为多反应监测(multiple reaction monitoring,MRM),扫描范围为100~1 000 m/z。使用的数据站操作软件是Mass Hunter(版本B.01.03)。
1.3.7 降解菌对受污染玉米中ZEN 的降解 从当地超市购买玉米粒,测定其ZEN 含量。将玉米粒精细研磨,过20 目筛,取25 g 玉米粉于250 mL 三角瓶中灭菌,加入ZEN 标准品,使其终浓度为2.5 mg·kg-1。每个三角瓶接种2.5 mL 预培养的ZEN 降解菌(2.5 mL NB 用于对照组)。28℃培养3 d 后,采用1.3.2 的方法提取和检测ZEN 含量。
2 结果与分析
2.1 ZEN 降解菌的筛选
从湖南等5 个地区的玉米、小麦、大麦样品中共分离到108 个单菌落。采用HPLC 法,利用以ZEN 为唯一碳源的MM 对上述单菌进行降解菌的筛选,获得10株具有ZEN 降解效果的菌株,具体信息见表2。
由表2可知,菌株NS2 降解效果最好,其液相色谱图如图1所示,ZEN 经降解菌NS2 于28℃、180 r·min-1处理72 h 后,在保留时间为7.6 min 时其特征性吸收峰明显降低,经计算后得出对照组中残留ZEN含量为5.04 μg·mL-1,试验组中残留ZEN 含量为0.20 μg·mL-1,降解率高达95.99%。因此选择NS2 进行后续研究。
2.2 ZEN 降解菌的鉴定
2.2.1 降解菌NS2 形态特征 降解菌NS2 在NA 培养基平板上培养24 h 后,形成的单菌落类似圆形,边缘不规则,有隆起,表面褶皱,不透明,干燥,菌落呈浅黄色,具体形态见图2;显微镜下油镜观察(图3),细胞呈杆状,大小为(0.6~1.0)μm×(1.5~3.0)μm,革兰氏染色阳性,产芽孢,芽孢呈椭圆形,有荚膜,周生鞭毛稀疏,初步判断为芽孢杆菌。
2.2.2 降解菌NS2 生理生化特性 由表3可知,降解菌NS2 为严格好氧型细菌,能利用酪素、淀粉、明胶、吐温、七叶苷、柠檬酸等,不能利用酪氨酸、脲酶等。
2.2.3 降解菌NS2 的16 SrDNA 鉴定 将扩增出的16S rDNA 单一条带进行DNA 测序,序列长度为1 452 bp,相应的序列已提交至GenBank(序列登记号:KM096464),并保存于中国普通微生物菌种保藏管理中心,编号:CGMCC9068。通过MEGA7.0 软件构建该菌株的16S rDNA 序列系统发育树,根据形态学及生理生化鉴定结果结合16S rDNA 序列分析,菌株NS2 被鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
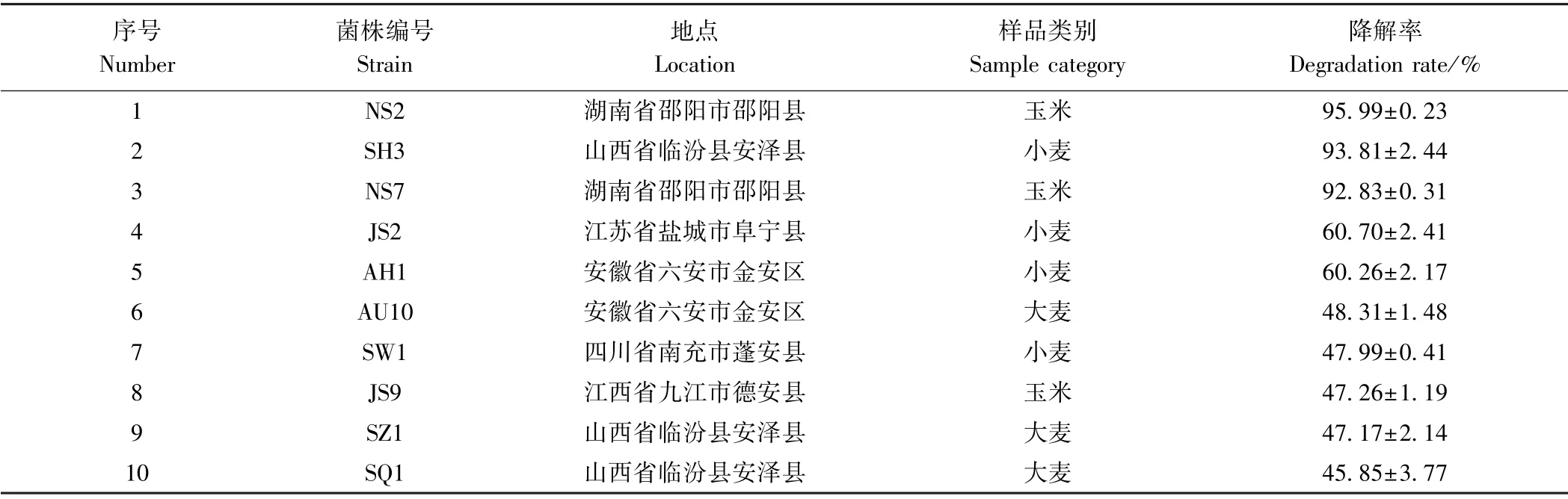
表2 具有ZEN 降解作用的菌株信息Table 2 Strain information with ZEN degradation
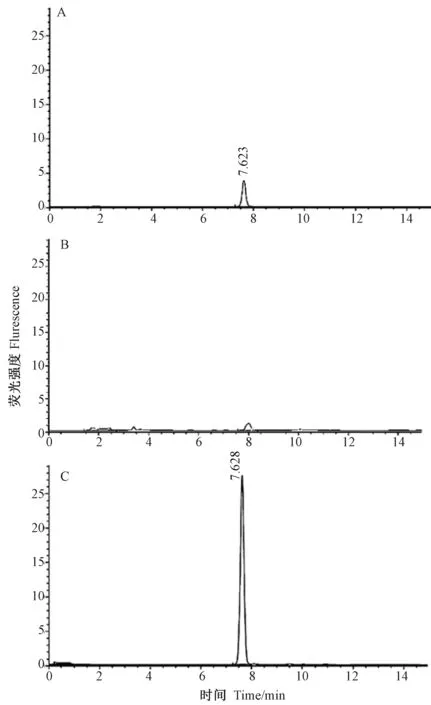
图1 NS2 对ZEN 的降解效果Fig.1 Degradation effect of NS2 on ZEN
图2 降解菌NS2 形态特征图Fig.2 Morphological characteristics of degrading bacteria NS2
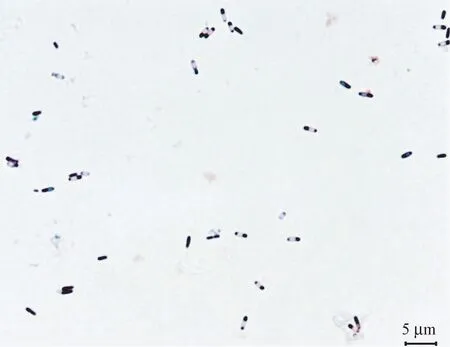
图3 油镜显微镜下NS2 形态特征Fig.3 NS2 morphological characteristics under the microscope
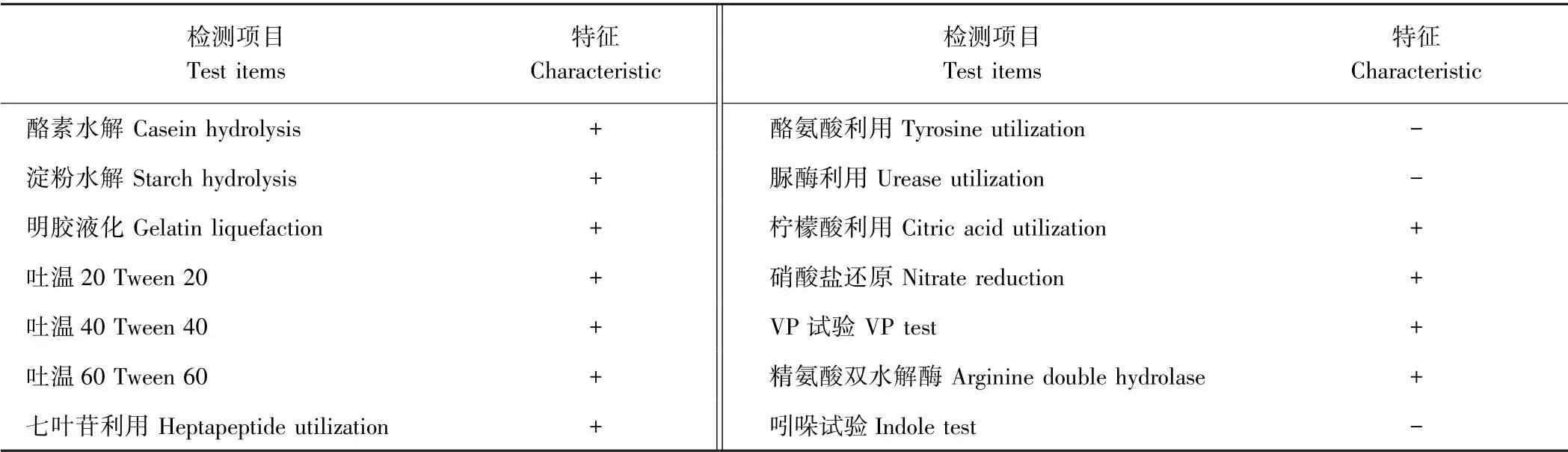
表3 降解菌NS2 生理生化特性Table 3 Characteristics of strain NS2
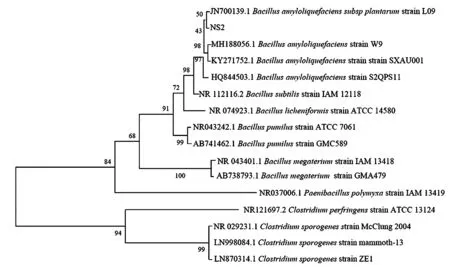
图4 基于16S rDNA 序列的菌株NS2 系统发育树Fig.4 Phylogenetic tree of strain NS2 based on 16S rDNA sequence
2.3 菌株NS2 特性分析
2.3.1 菌株NS2 的抗菌活性 当解淀粉芽孢杆菌NS2 与2 种病原菌指示剂大肠杆菌和鼠伤寒沙门氏菌共培养时,可观察到清晰的抑制圈,表明NS2 可以抑制大肠杆菌和鼠伤寒沙门氏菌的生长(表4)。说明该菌具有良好的抗菌活性,具有保鲜防腐等应用潜力和商业价值。
2.3.2 菌株NS2 的木聚糖、羧甲基纤维素酶、蛋白酶活性 在含有木聚糖,羧甲基纤维素的NA 培养基中未观察到明显的晕圈,说明菌株NS2 不产生木聚糖酶和羧甲基纤维素酶,但是在脱脂乳的NA 培养基上观察到了清晰的晕圈(图5),表明NS2 蛋白酶活性较高,这可能会在提高饲料利用率方面具有潜在的应用价值。

表4 NS2 与病原菌指示剂共培养时的抑菌效果Table 4 Antibacterial effect of NS2 when co-cultured with pathogen indicator /cm
2.4 菌株NS2 降解活性成分分析
将胞外上清液、菌体细胞、细胞内容物分别与5 μg·mL-1ZEN 毒素在28℃、180 r·min-1共同孵育72 h,降解结果如图6所示。其中,活的菌体细胞降解率为57%,细胞内容物降解率为40.3%,而胞外上清仅为1.8%。由此可知,降解效果主要来自于活细胞产生的胞内活性物质,胞外上清液几乎没有活性物质,推测该降解活性物质可能无法分泌。

图5 脱脂乳-NA 培养基上由NS2 产生的蛋白酶Fig.5 Protease production by NS2 Bacillus amyloliquefaciens in Skim milk-NA medium
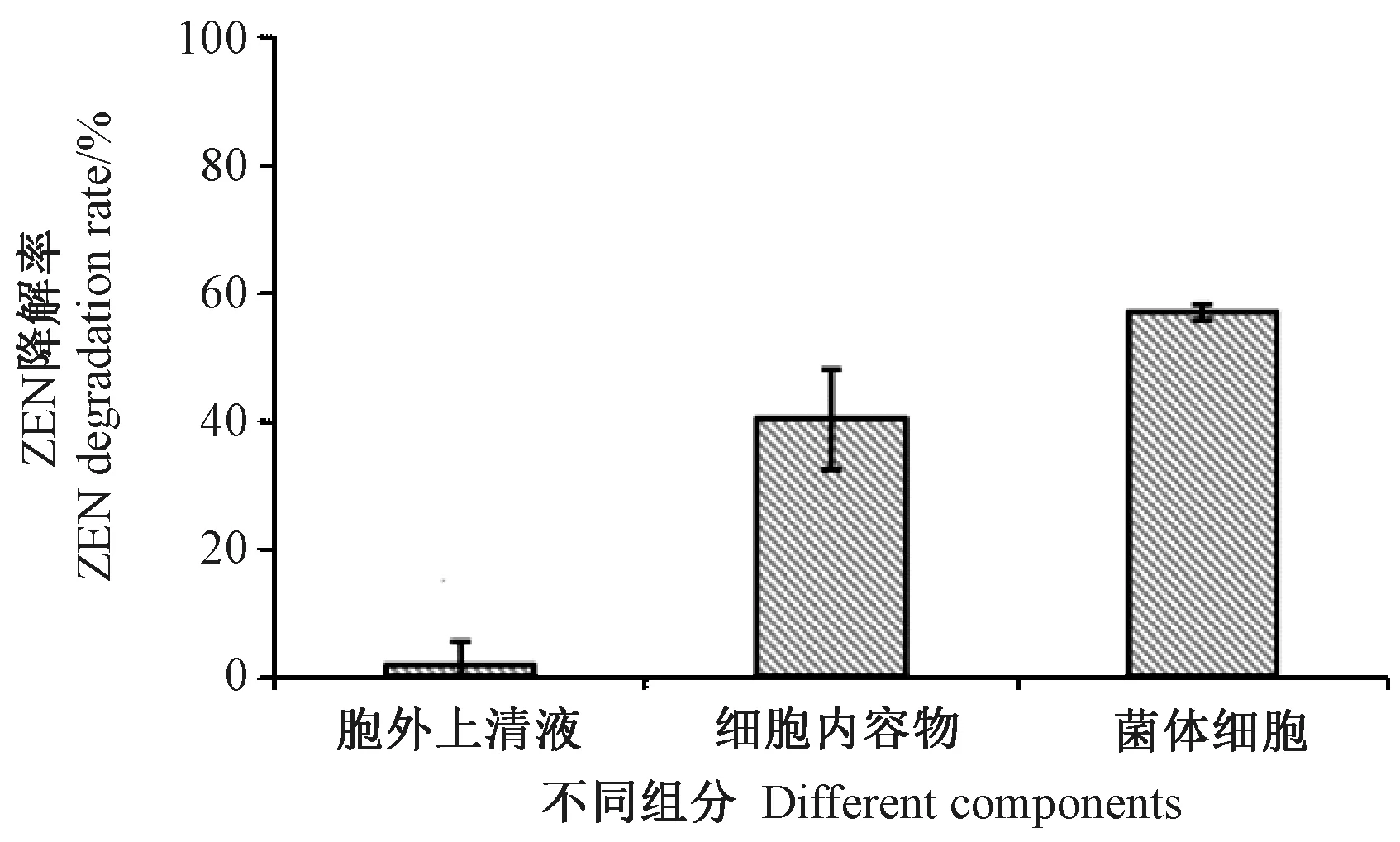
图6 菌株NS2 的不同组分对ZEN 降解率的影响Fig.6 The influence of different components of strain NS2 on ZEN degradation
2.5 ZEN 降解产物分析
为了检测菌株NS2 降解ZEN 后的降解产物,将菌株接种到含有5 μg·mL-1ZEN 的MM 中,28℃孵育36 h 后,检测降解率为43.3%。为减少溶剂极性对降解产物分析的影响,分别使用氯仿和乙腈2 种有机试剂提取水不溶性、水溶性降解产物,然后用HPLC-QTOF-MS 检测。使用Mass Hunter 数据分析软件的分子特征提取功能分析试验数据,结果如图7、8所示,数据库中未检索到α -ZOL、β-ZOL 和其他有毒降解产物,初步判定ZEN 经降解菌NS2 处理后代谢较完全,无有毒代谢物产生。
2.6 菌株NS2 对玉米粉中ZEN 的降解
向玉米粉中加入ZEN 标准品,使其初始ZEN 浓度为2.5 mg·kg-1,按10%的接种量接种菌株NS2,28℃培养3 d 后,ZEN 降解率为88.2%,说明该菌在实际应用基质中具有高效的降解作用,为ZEN 降解菌制剂的开发与商业化奠定了基础。
3 讨论
ZEN 生物消减技术主要是基于微生物产生的酶对ZEN 的高效降解作用,或微生物菌体对毒素的吸附作用,具有高效、特异、温和、环境友好、不对产品造成营养成分破坏等优点。
益生菌是ZEN 降解微生物潜在的良好来源,除了能够降解ZEN,降低其毒性外,还可以通过改善微生态平衡,与局部免疫系统细胞相互作用对宿主产生有利的影响。解淀粉芽孢杆菌是一种益生菌,是EFSA 认定的安全菌株,可作为饲料添加剂使用。该菌几十年来一直用于生产各种商业上重要的抑菌蛋白、脂肽类抗生素等代谢物,具有抑制病原微生物生长、改善水质、促进饲料利用率等作用[40-41]。本研究观察到NS2 在液体和固体培养基中均具有高效的ZEN 降解活性,同时还显示出针对大肠杆菌和鼠伤寒沙门氏菌的抗微生物活性。若将该菌添加到饲料或饲料原料中,可在源头上减少ZEN 毒素的危害,同时还可以通过产生蛋白酶等活性物质,改善饲料口味,促进动物对饲料中营养物质的消化吸收,提高饲料的转化率[42]。因此,解淀粉芽孢杆菌NS2 在降解真菌毒素的菌制剂的开发、应用方面具有巨大的优势和潜力。
微生物脱毒虽然可以有效降低食品或饲料中的ZEN 含量,但是经过处理后,ZEN 的毒性是否能有效降低、是否会生成新的有毒产物等问题,一直都是科研工作者所关注的焦点。研究显示,ZEN 可通过酮羰基还原的代谢方式生成α-ZOL 或β-ZOL,而α-ZOL 的雌激素毒性比ZEN 的还要高,约等于其二倍。因此不能仅依靠检测ZEN 含量来衡量脱毒效果,需要同时检测降解产物的结构和雌激素毒性。潘丽婷等[43]筛选到了1 株对ZEN 有高效降解作用的解淀粉芽孢杆菌,但是未对降解产物的结构、毒性进行研究。而本研究通过HPLC-Q-TOF-MS 进一步分析解淀粉芽孢杆菌降解ZEN 后的产物,未检测到α-ZOL 或β-ZOL,也未观察到其他有毒代谢产物。因此,解淀粉芽孢杆菌NS2 不是通过酮羰基还原这条途径来降解ZEN 的。但ZEN降解产物的毒性还需要通过Ams 试验、动物试验进一步深入分析。
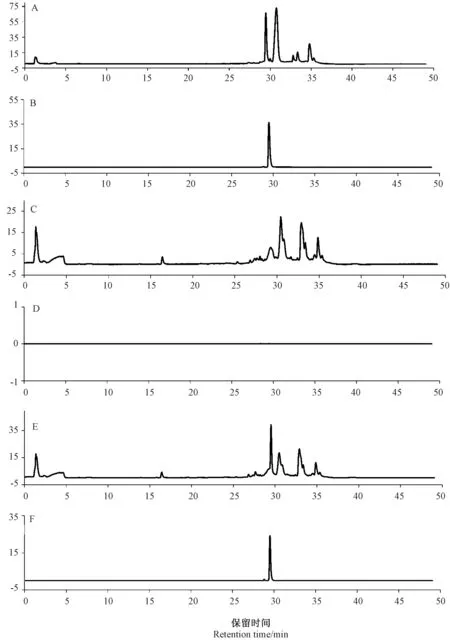
图7 用氯仿萃取的ZEN 降解产物的HPLC-Q-TOF-MS 谱Fig.7 HPLC-Q-TOF-MS spectra of ZEN degradation products extracted with chloroform
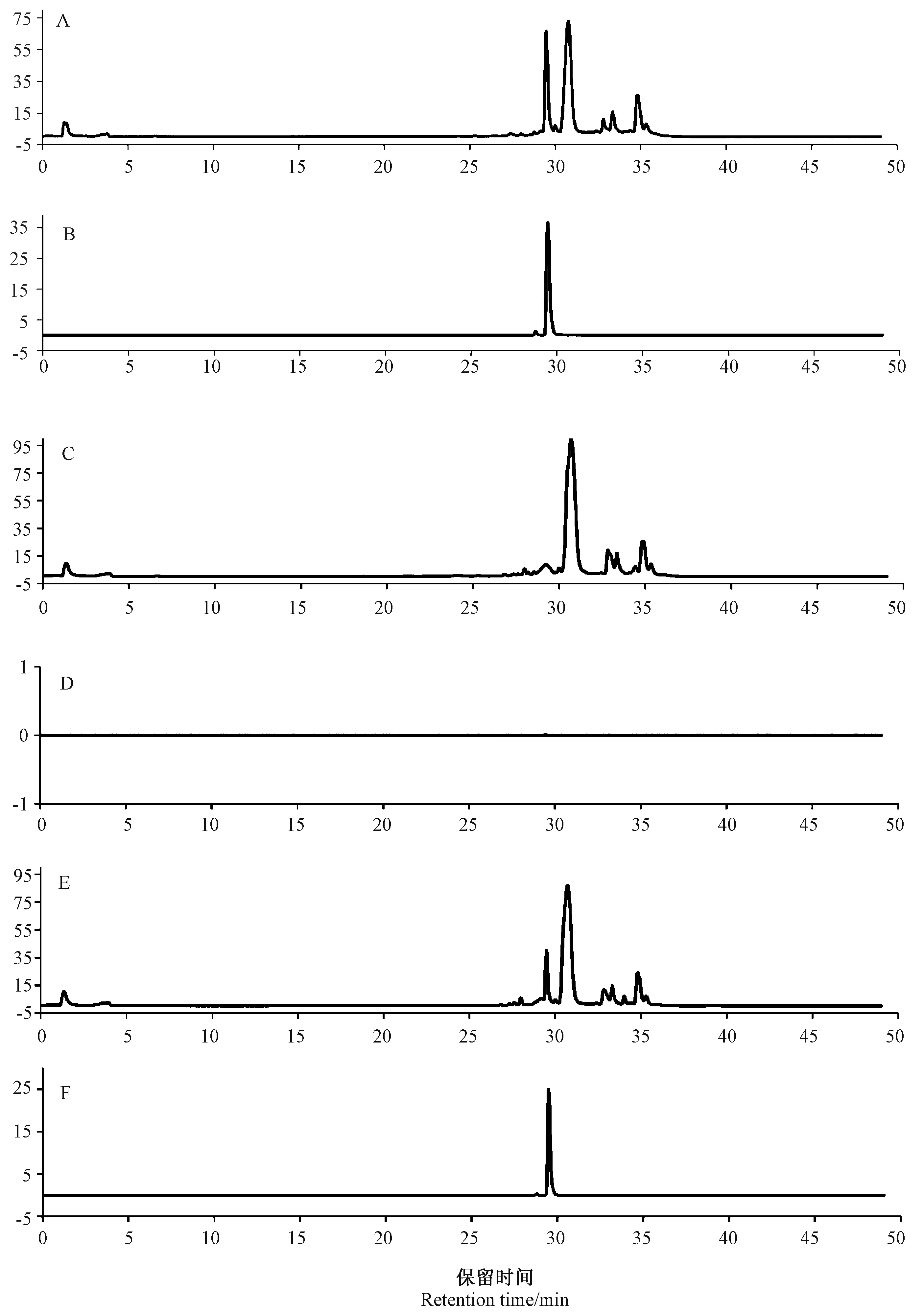
图8 用乙腈萃取的ZEN 降解产物的HPLC-Q-TOF-MS 谱Fig.8 HPLC-Q-TOF-MS spectra of ZEN degradation products extracted with acetonitrile
4 结论
本研究从湖南省邵阳市采集的玉米中筛选分离到1 株ZEN 高效降解菌,经形态学、生理生化和16s rDNA 分子鉴定为解淀粉芽孢杆菌,该菌株是一种益生菌,能够有效抑制病原菌大肠杆菌、鼠伤寒沙门氏菌的生长,同时还能分泌蛋白酶,在提高饲料利用率方面有巨大的潜力。该菌株在72 h 内对5 μg·mL-1ZEN 的降解率高达95.99%,降解产物中未检测到有毒的α-ZOL、β-ZOL 和其他有毒产物。解淀粉芽孢杆菌NS2 的发现为食品和饲料中玉米赤霉烯酮的去除提供了一种有效措施,为ZEN 解毒菌剂的开发与应用奠定了基础。
