Lp-PLA2 基因多态性与冠心病及其血脂水平的关联性研究
2020-07-01马大伟蔡大炜史万青周利民
马大伟, 蔡大炜, 史万青, 凌 春, 周利民
(1.安徽省滁州市第一人民医院(南区)急诊内科病区,滁州 239000; 2.安徽省滁州市第一人民医院(南区)心血管内一科,滁州 239000; 3.安徽省滁州市第一人民医院(南区)血液内科,滁州 239000)
冠心病(CHD)是指冠状动脉粥样硬化所引起以心肌缺氧、缺血、坏死为病理表现的心脏疾病,随着老龄化的加剧,中老年群体发生冠心病的风险明显升高[1]。但由于冠心病动脉粥样硬化的发病原因尚未完全明确,大部分学者认为其可能与动脉脂质沉积、内膜损伤有关[2-3]。血脂异常被证实是冠心病的主要危险因素,而针对CHD遗传易感性基因的研究也是当前心血管领域的研究热点。文献报道[4],炎性细胞因子的单核苷酸多态性(SNP)有可能成为影响炎症出现、血栓形成及动脉粥样硬化(AS)发生的危险因素。国外研究表明,脂蛋白相关磷脂酶A2(Lp-PLA2)是CHD发病的独立危险因素[5],且受基因多态性的调控,PLA2G7 多个位点的基因突变会对Lp-PLA2 表达活性形成影响,从而引起CHD 的发病率不同。本研究选取本地区CHD 患者为研究对象,采用聚合酶链反应-限制性片段长度多态性(PCRFRLP)检测Lp-PLA2 基因A379V 和T403C 位点SNP,探讨遗传因素与CHD 发病的关联,以期发现CHD 的遗传危险因素,为临床治疗提供科学数据支持。
1 对象与方法
1.1 研究对象
选取2018 年7 月至2019 年4 月在我院急诊内科病区南区和心内一科住院的CHD 患者63例,其中男38 例,女25 例,平均年龄(66.63±13.69)岁,所有患者均行心电图心肌酶谱检查,12 例患者行冠状动脉造影(CAG),符合WHO 颁布的缺血性心脏病命名和诊断标准[6]。纳入标准:①本地居住20 年以上,汉族;②CAG 显示至少有一支冠状动脉狭窄程度≥50%。排除标准:①合并肾脏、肝脏、肾上腺和甲状腺等影响脂质代谢的疾病;②合并有风湿性心脏病、主动脉夹层及心肌病等心脏疾病者;③精神或意识不清晰者。另外选取同期在我院健康体检中心进行体格检查的体检者60 例,其中男性34 例,女性26 例,平均年龄(65.67±12.54)岁。对照组纳入标准:本地居住20 年以上,汉族;排除标准:CHD 患者。所有研究对象均签署知情同意书。
1.2 方法
1.2.1 一般情况收集 经过统一培训我院急诊内科病区南区和心内一科的医护人员记录所有研究对象的年龄、性别、病程、吸烟情况、饮酒情况、既往疾病史和疾病家族史等。
1.2.2 样本收集 采集所有研究对象2~3 mL 空腹静脉血2 份,一份采用肝素抗凝、离心,取1 mL上清液,保存于-80℃冰箱,用于目标靶基因SNP分析;另一份直接用于检测此次研究的生化指标。
1.2.3 DNA 提取及分析 严格按照血液基因组柱式小量DNA 提取试剂盒说明书操作提取DNA,具体步骤如下:①取200 μL 上清液,加入Protease K 20 μL,摇拌均匀;②加入Buffer GL 200 μL,摇拌均匀,震荡时间大于1 min;③56 ℃孵育10 min,剧烈颠倒摇拌均匀数次;④加入无水乙醇200 μL,颠倒混匀至少大于10 次,将得到溶液加入吸附柱(内置收集管)中;10000 r·min-1离心1 min,倒掉废液;⑤向吸附柱中加入500 μL Buffer GW1,10000 r·min-1离心1 min,倒掉废液;⑥继续向吸附柱中加入500 μL Buffer GW1 ,10000 r·min-1离心1min,倒掉废液;⑦10000 r·min-1离心2 min,倒掉废液,置于室温数分钟;⑧将离心过的吸附柱放入新的EP 管中,将吸附柱倾斜,向吸附柱的中间部位悬空加入200 μL Buffer GE,加完后室温放置5 min,10000 r·min-1离心1 min,采用滴管收集离心后DNA 溶液;⑨将提取的DNA 置于琼脂糖凝胶板,固定后电泳,检测DNA 浓度。
1.2.4 SNP 检测 在美国国立生物技术信息中心(NCBI)上查询Lp-PLA2 基因位点资料,采用Primer 5.0 设计包含目的基因的位点的引物,A379V 目的基因片段上游引物为5’-CAGACCAACAAGACCAGTACCTT-3’,下游引物为5’-GACAGCTTTGTCCTGAGATTCAT-3’,扩增片段长度为550 bp;T403C 目的基因片段上游引物为5’-ACGGCTCCTTCTAGCTCCAT-3’,下游引物为5’-CTCCTTTCCGCAGACCTGAT-3’,扩增片段长度为535 bp,内参基因β-actin 上游引物为5’-AGAGGGAAATCGTGCGTGAC-3’,下游引物为5’-ACTCCTGCTTGCTGATCCACATC-3’,扩增片段长度为511 bp。采用康为世纪(CWBIO)公司含燃料2×Cobuddy Master Mix 试剂盒进行PCR 反应,反应体系包括25 μL 2×Cobuddy Master Mix,2μL DNA Template,2.5 μL R(10 mM),18 μL Rnase Free Water,2.5 μL F(10 mM)。反应条件设置:95 ℃预变性6 min,94 ℃变性30 s,退火30 s,72 ℃延伸30 s,循环35 个周期,72 ℃延伸10 min。将反应好的体系进行琼脂糖凝胶电泳,采集并拍照琼脂糖凝胶靶条带,采用ABI 3130xlDNA 测序仪/基因分析仪进行测序分析。
1.3 观察指标
采用贝克曼库尔特AU680 全自动生化分析仪检测所有研究对象甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、脑钠尿肽(BNP)、同型半胱氨酸(HCY)、超敏C 反应蛋白(hs-CRP)、脂蛋白(a)[LP(a)]、白细胞(WBC)等指标。
1.4 统计学方法
数据用SPSS 22.0 软件进行统计分析。计量资料采用均数±标准差(±s)表示,两组比较采用独立样本t检验。组间基因型和等位基因频率采用χ2检验或Fisher 精确概率法,非条件Logistic回归模型分析CHD 相关影响因素。P≤0.05 为差异有统计学意义。
2 结果
2.1 两组受试者一般情况比较
CHD 组患者TC、TG、HDL-C、BNP、HCY、hs-CRP、LP(a)、WBC 血清浓度较对照组升高,且CHD 组患者有糖尿病史、高血压史的比例也高于对照组(P均<0.05),两组患者年龄、性别分布、吸烟比例、BMI、LDL-C 水平差异均无统计学意义(P均>0.05),见表1。
2.2 Lp-PLA2 基因型Hardy-Weinberg 平衡检验
Lp-PLA2 基因A379V、T403C 位点在CHD和对照人群中的基因型分布符合Hardy-Weinberg 平衡(A379V:F值分别为0.583 和0.842,P>0.05;T403C:F值分别为0.712 和1.057,P>0.05),由此可见两组间基因型分布频率均达到基因遗传平衡的标准,基本体现全人群基因的分布情况,此次选择的样本代表性较为理想。
2.3 Lp-PLA2 基因A379V、T403C 位点SNP 分布
A379V 位点SNP 分布在CHD 组和对照组中差异无统计学意义(P>0.05)。CHD 组Lp-PLA2基因T403C 位点SNP 分布中CC 等位基因频率(14.29%)高于对照组(1.67%)(P<0.05),见表2。
2.4 CHD 患者Lp-PLA2 基因A379V、T403C 位点SNP 分布与血脂水平的关系
由表3 可见,A379V 位点基因型为(TT+CT)患者HDL-C 水平低于基因型为CC 患者(P<0.05);T403C 位点基因型为TT 患者TG 水平高于基因型为(CC+TC)患者(P<0.05);其他血脂指标在不同基因型患者之间差异均无统计学意义(P均>0.05)。
2.5 CHD 影响因素的Logistic 回归分析
以糖尿病史(0=无,1=有)、高血压史(0=无,1=有)、TC、TG、HDL-C、LDL-C、BNP、HCY、LP(a)、WBC、A379V 位点和T403C 位点为自变量,以是否患有CHD(0=无,1=有)为应变量,建立非条件Logistic 回归模型,分析发现在校正以上自变量后,患者有糖尿病史、TC、HDL-C、HCY、LP(a)均是CHD 的独立影响因素,T403C 位点携带CC 基因型者CHD 发病风险高,见表4。
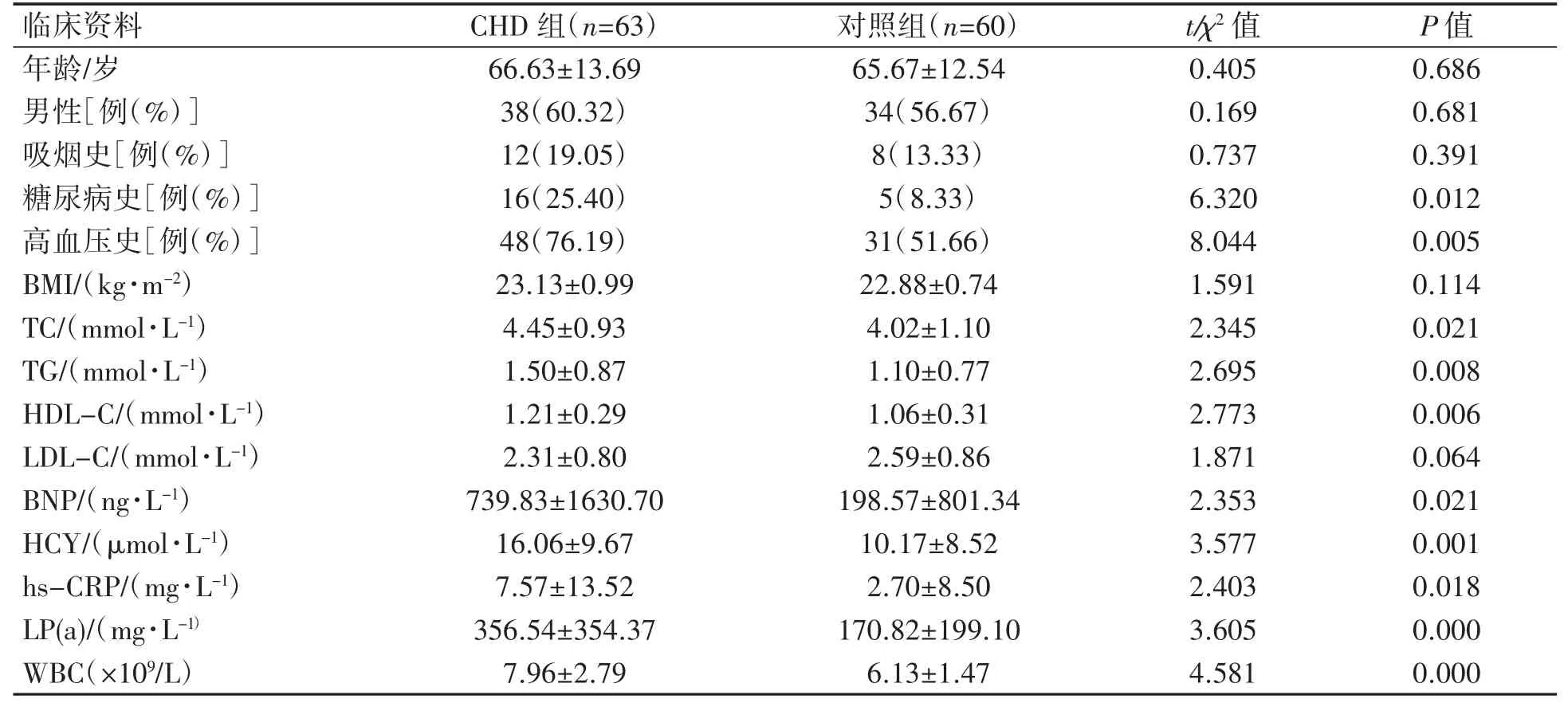
表1 两组受试者一般情况的比较

表2 Lp-PLA2 基因A379V、T403C 位点SNP 分布
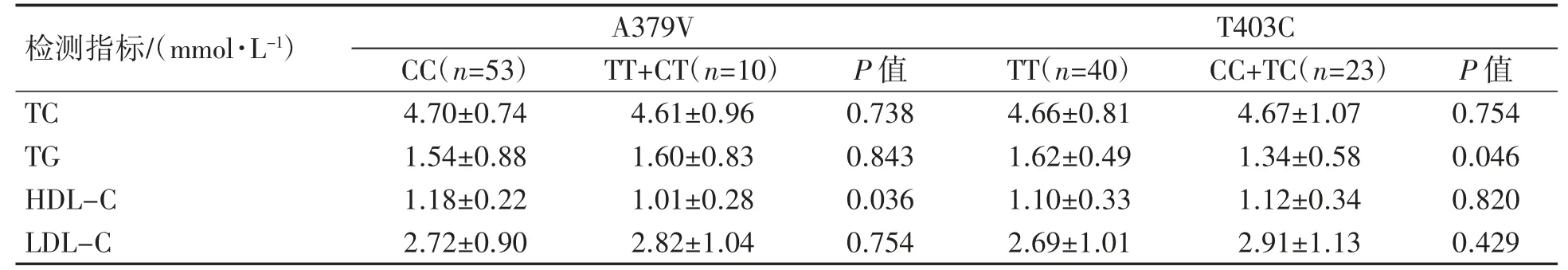
表3 CHD 患者血脂水平与A379V、T403C 位点的关系
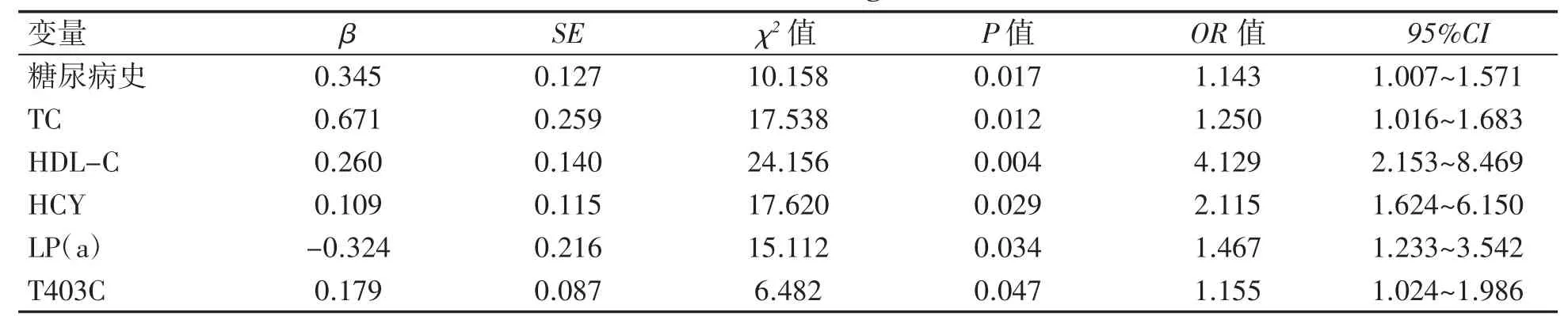
表4 CHD 影响因素的Logistic 回归分析
3 讨论
文献报道[7],Lp-PLA2 又名血小板活化因子乙酰水解酶(PAF-AH),是由血管内膜浸润的巨噬细胞和淋巴细胞合成并分泌的一种新发现的炎性标志物,与动脉粥样硬化相关。研究发现[8],Lp-PLA2 是钙离子非依赖性的磷脂酶A2 家族成员之一,分子大小为45.4 kDa。Lp-PLA2 产生于动脉粥样硬化斑块中的巨噬细胞,进入血液后,与脂蛋白结合成复合物,其中1/3 结合于高密度脂蛋白,剩余与低密度脂蛋白结合。研究发现,血浆Lp-PLA2 水平超过200 ng·mL-1将会对心脏和血液系统带来严重伤害,产生冠心病等相关疾病[9]。国家胆固醇教育计划成人治疗小组Ⅲ(ATPⅢ)指南推荐将Lp-PLA2 作为主要危险因素对心血管患病风险进行评估[10]。
研究表明[11],Lp-PLA2 的生物功能受体内基因的控制,其上游基因PLAG7 多个位点的基因突变会对Lp-PLA2 的生物功能带来不同影响,从而导致患者CHD 患病风险不同。美国杜克大学医学中心的一项大型流行病学研究发现[12],Lp-PLA2 基因rs1051931、rs1805017 位点的基因突变属于非同义突变,与CHD 的发病存在明显关联。El-Saed 等[13]研究结果表明,Lp-PLA2 基因rs16874954 位点基因多态性是亚洲人群发生冠心病的独立危险因素,而欧洲人群则无此位点SNP。A379V 是Lp-PLA2 基因第11 个外显子rs1051931 位置上碱基的改变,分为379A 野生型和379V 变异型两种等位基因。Li 等[14]对806 例CHD 患者的研究发现,心肌梗死的CHD 患者379V 等位基因频率与无心肌梗死患者相比差异明显,说明A379V 位点基因突变会导致CHD 患者发生心肌梗死的概率明显升高。本研究发现,A379V 位点各基因型及等位基因频率在CHD 组和对照组差异无统计学意义,提示Lp-PLA2 基因A379V 位点SNP 与本研究人群冠心病的发病尚未发现较大关联,可能与本次选择的样本量偏少有关,研究结果可能存在偏移有关。研究表明[15],T403C 是Lp-PLA2 基因5’端转录起始区rs1421378 位点碱基置换,形成T 和C 两种等位基因,在人群中形成纯合子CC、TT 和杂合子TC三种基因型。Hoffmann 等[16]对3234 例CHD 患者研究发现,在调整CHD 传统影响因素后显示启动子区T403C 出现基因突变会对Lp-PLA2 表达活性造成一定影响,且未使用降脂药物的患者该作用更为突出。本研究发现,CHD 组患者的CC基因频率高于对照组,经过去除相关因素的影响后,该位点仍表现为CHD 患病的独立危险因素,提示该位点SNP 能增加CHD 的发病风险。
综上,本次研究发现Lp-PLA2 基因T403C多态性位点与CHD 的发生有关,说明Lp-PLA2基因突变导致CHD 患者血脂紊乱,建议经过基因筛查后发现Lp-PLA2 基因位点突变的人群密切关注血脂水平,降低CHD 的发病风险。
