外泌体对老龄小鼠骨髓间充质干细胞衰老影响的初步研究
2020-06-30吴晓恋傅稼耀武文婧谢培进吴珺华
吴晓恋, 傅稼耀, 武文婧, 谢培进, 吴珺华
(上海牙组织修复与再生工程技术研究中心,同济大学口腔医学院·同济大学附属口腔医院口腔修复教研室,上海200072)
口腔颌面部外伤、肿瘤或拔牙后牙槽骨吸收等都会造成颌骨骨缺损,目前主要通过自体或异体骨移植、骨引导再生技术等进一步修复,但仍有一定的局限性。 骨髓间充质干细胞 (bone marrow mesenchymal stem cells, BMSCs) 因其具有多向分化潜能,可促进骨缺损修复[1-2],是组织工程技术中的关键;但因BMSCs 自身存在衰老问题[3],有研究证明老龄化机体的BMSCs 成骨分化能力大大降低[4],可能是老龄化患者骨再生修复缓慢的原因之一。
外泌体(exosome)作为一种细胞间信息传递的生物活性物质, 近年来成为科学研究的前沿和热点,BMSCs 是分泌外泌体能力最强的细胞之一。BMSCs 来源的外泌体(BMSCs-exo)具有与BMSCs 相似的多种生物学功能,其内含有近50 种miRNAs,已被证实广泛参与了细胞生物学中多种生理机制的调控[5]。 BMSCs 来源的外泌体具有与BMSCs 相似的多种生物学功能,如减轻心肌缺血和再灌注损伤[6],减轻肾脏损伤[7],参与免疫系统功能调节[8],调节肿瘤的发生、发展[9],治疗神经系统性疾病[10],改善骨质疏松症[11],促进软骨修复[12]等。 而且BMSCs 分泌的外泌体不仅能作用于周围的细胞进行组织修复, 还能特异性地识别BMSCs,起到自我调节作用。
衰老细胞不仅自身功能减退,有研究发现衰老的细胞还会分泌大量的生物因子, 在其周围形成衰老相关分泌表型(senescence-associated secretory phenotype,SASP), 诱导周围组织出现连锁反馈[13];但关于外泌体在BMSCs 衰老过程中的作用, 鲜见报道。 本文拟对年轻小鼠来源外泌体对老龄小鼠BMSCs 衰老的作用及机制进行初步探索,为老龄患者颌骨缺损修复时外泌体的临床应用提供基础研究依据。
1 材料和方法
1.1 材料
1.1.1 实验动物 C57BL/6 小鼠由上海斯莱克动物实验有限公司提供,饲养于同济大学动物实验中心。
1.1.2 实验试剂 无外泌体血清(EXOFBS50A-1,BI 公司, 美国), 外泌体提取试剂盒(4478359,Life公司, 美国),PKH67 荧光染色剂 (Sigma 公司,美国),总RNA 提取试剂盒(Invitrogen 公司,美国),衰老细胞β-半乳糖苷酶染色试剂盒(碧云天公司,中国)。 细胞转染试剂盒,miR-199a-3p mimics,miR-214-3p mimics,miR mimics 阴性对照 (广州锐博生物科技有限公司,中国)。
1.2 实验方法
1.2.1 小鼠BMSCs来源外泌体的分离、提纯及鉴定 将3~4 周龄的小鼠颈椎脱臼处死,75%乙醇浸泡10 min;无菌条件下取出股骨及胫骨,去净软组织,剪去长骨两端,暴露骨髓腔,用1 mL 注射器吸取含10%胎牛血清、1×双抗的α-MEM 培养基冲洗骨髓腔,接种于培养皿内,置于37 ℃、5%CO2孵箱中培养; 培养3 d 后换液, 磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗2 遍后,加入8~10 mL 完全培养液培养;当细胞融合度达80%时传代,培养至P3 代, 待细胞融合至70%左右时, 将培养基换成10%无外泌体血清+1×双抗+α-MEM 培养基; 培养3 d 后收集细胞培养基,于4 ℃下400×g 离心15 min,进行2 次以去除培养基中的细胞碎片;于4 ℃下5 000×g 离心15 min,进行2 次以去除培养基中的凋亡小体等,弃沉淀物,收集上清液;在上清液中加入1/2 体积的外泌体提取试剂,上下颠倒充分混匀,置于4 ℃静置,孵育12~16 h;将混合液分装,于4 ℃下10 000×g 离心120 min,弃上清液,沉淀部分即为分离的外泌体。 经透射电镜扫描、粒径检测及流式细胞仪表面标记物检测,进一步鉴定分离、提纯的物质。
1.2.2 PKH67 荧光标记外泌体 将PKH67 原液按1∶500 比例稀释,取500 μL 稀释后的PKH67 染料,加入至用试剂盒提取获得的外泌体中,加样器轻柔混匀,25 ℃下孵育2~5 min,以加入同样染料的PBS作为对照组。 孵育后加入等体积的1%牛血清白蛋白(bovine serum albumin,BSA)溶液1 min,作为终止液,终止染色反应。将PBS 加入超滤管内至30 mL,用试剂盒提取外泌体,重复1 次,对照组做相同处理,离心后用PBS 重悬,备用。 将PKH67 染色后的外泌体按照1 μg/mL 的浓度加入衰老小鼠BMSCs 中作为实验组(BMSCs+外泌体),将PKH67 染色后的等体积PBS 加入衰老小鼠BMSCs 中作为对照组(BMSCs+PBS),培养箱中分别培养3、6、12 h。PBS 冲洗2 次,加入4%多聚甲醛固定30 min。 PBS 冲洗2 次后,用DAPI 荧光染料将细胞核染色。 用抗荧光淬灭剂封片,避光保存。 通过荧光显微镜获得图像。
1.2.3 年轻小鼠BMSCs来源外泌体作用于老龄小鼠BMSCs衰老情况的检测 提取老龄小鼠BMSCs培养至P3 代,制备为细胞悬液,计数后以1×108个/mL 的密度接种在60 mm 培养皿中; 将提取的年轻小鼠BMSCs 来源的外泌体按10 μg/mL 的浓度加入10%无外泌体血清和1×双抗及α-MEM 配制成的完全培养基中,使用等量PBS 加入10%无外泌体血清和1×双抗及α-MEM 配制成的完全培养基作为阴性对照。 细胞接种次日,去除原培养液,PBS 洗2 遍,将以上2 组培养基加入培养皿中, 放进培养箱培养3 d, 分别进行CCK-8 检测、 实时荧光定量PCR(quantitative real-time PCR,qPCR)检测及β-半乳糖苷酶染色分析。
1.2.4 年轻小鼠和老龄小鼠BMSCs来源的外泌体基因芯片检测 分别提取年轻小鼠及老龄小鼠BMSCs 来源的外泌体, 加入等体积TRIzol 裂解液裂解30 min,然后加入1/5 体积的三氯甲烷,上下剧烈颠倒混匀,静置1 min;于4 ℃下12 000×g 离心15 min,转移上层的无色水相层液体至新的离心管中,加入等体积无水乙醇(勿触碰沉淀物),轻轻上下颠倒混匀,移至RNA 取管中;于4 ℃下12 000 × g离心15 min,按照说明书,依次加入试剂盒中的缓冲液,加15 μL 的RNase-free 水,溶解RNA。 RNA浓度及纯度测定:取1 μL 总RNA 加到Nanodrop 载物台上,读取总RNA 浓度,以及260 nm/280 nm 吸收值的比值,2.0 左右被认为纯度较高; 取1 μL 总RNA 备用, 采用Agilent 2100 分析仪进行生物芯片分析,并将浓度、纯度较高的RNA 样品(外泌体及其分泌细胞)交由北京百迈克生物有限公司进行质谱分析,并根据分析结果,选取差异性表达最大的2个miRNAs(miR-199a-3p、miR-214-3p)进行后续 实验。
1.2.5 分别转染miR-199a-3p-mimics和miR-214-3p-mimnics至老龄小鼠BMSCs中以观察衰老状况的改变 将1×105个/mL 浓度的BMSCs 接种至60 mm的培养皿中, 采用10%胎牛血清的α-MEM 培养液培养, 每皿4 mL, 放置于37 ℃培养箱中培养;4 h后,取出培养皿,显微镜下确认细胞贴壁且状态良好,去除培养基并用PBS 清洗,配制转染液:分别添加miR-199a-3p mimics、miR-214-3p mimics,配制成过表达的转染液, 其余各组添加随机序列的对照mimics;分别将转染液添加至培养皿中,每皿4 mL,放入细胞培养箱中培养24 h;转染24 h 后,取出培养皿,去除培养液后PBS 清洗,换成正常培养基,培养3 d 后分别进行qPCR 检测、CCK-8 检测及β-半乳糖苷酶染色分析。
1.2.6 统计学分析 采用SPSS 22 软件进行统计分析,结果以均数±标准差(Mean±SD)表示,组间差异比较用one-way ANOVA 分析,P<0.05 为差异有统计学意义。 2 组间差异比较用独立样本t检验分析,P<0.05 为差异有统计学意义。
2 实验结果
2.1 小鼠BMSCs 来源外泌体的鉴定

图1 外泌体鉴定Figure 1 Identification of exosomes
外泌体鉴定方式主要有电镜检测、 粒径检测、表面标志蛋白检测等(图1)。 透射电镜扫描下观察到囊泡为纳米级囊泡,囊泡复染后呈深色,直径在20~200 nm(图1A);经粒径测量分析所得,囊泡直径均值为146.4 nm,粒径主峰为130.2 nm,直径在20~200 nm 的囊泡百分比为98%(图1B);流式细胞仪检测囊泡表面标志蛋白CD63 和CD81。 结果显示, 经染色后得到的外泌体表面标志蛋白均呈阳性,阳性率在70%以上(图1C~F)。 上述结果表明,小鼠BMSCs 培养基中分离得到的细胞外囊泡为外泌体。
2.2 老龄小鼠BMSCs 特异性摄取年轻小鼠BMSCs来源的外泌体
将年轻小鼠BMSCs 来源外泌体添加至老龄小鼠BMSCs 的完全培养基中,培养3 h 后,显微镜下观察到老龄小鼠的BMSCs 内开始出现绿色荧光,12 h后,荧光强度显著性增加,几乎所有细胞内都能观察到绿色荧光标记的外泌体,而在对照组的BMSCs中没有出现绿色荧光信号(图2)。结果表明,年轻小鼠BMSCs 来源外泌体以时间依赖性方式被老龄小鼠的BMSCs 特异性摄取。

图2 外泌体绿色荧光标记表达情况Figure 2 Expression of green fluorescent markers in exosomes
2.3 年轻小鼠BMSCs 来源外泌体对衰老BMSCs的影响
将年轻小鼠BMSCs 来源外泌体加入老龄小鼠BMSCs 的完全培养基中,3 d 后进行CCK-8 检测。结果发现,经年轻小鼠BMSCs 来源外泌体作用后的老龄小鼠BMSCs 的增殖能力,与对照组比较,差异具有统计学意义(图3A);qPCR 检测结果显示,经年轻小鼠BMSCs 来源外泌体作用后的老龄小鼠BMSCs 中衰老基因表达明显下降, 与对照组相比较,差异具有统计学意义(图3B);β-半乳糖苷酶染色结果显示, 经年轻小鼠BMSCs 来源外泌体作用后,BMSCs 衰老细胞数量明显减少(图3C~D)。以上实验结果说明,年轻小鼠BMSCs 来源的外泌体可有效缓解BMSCs 的衰老状态。
2.4 年轻小鼠BMSCs 来源外泌体和老龄小鼠BMSCs来源外泌体的基因芯片分析结果
我们分别提取了年轻小鼠的BMSCs 来源外泌体(S01)和老龄小鼠的BMSCs 来源外泌体(S02)进行外泌体的基因芯片分析,比较2 组样本间存在差异性表达的miRNAs, 筛选出了2 个表达量较高且表达差异明显的miRNAs, 即miR-199a-3p 及miR-214-3p, 进一步探究这2 个miRNAs 在老龄BMSCs的衰老过程中可能起到的作用(图4)。
2.5 MiR-199a-3p、miR-214-3p 对 老 龄 小 鼠 来 源BMSCs 衰老的影响
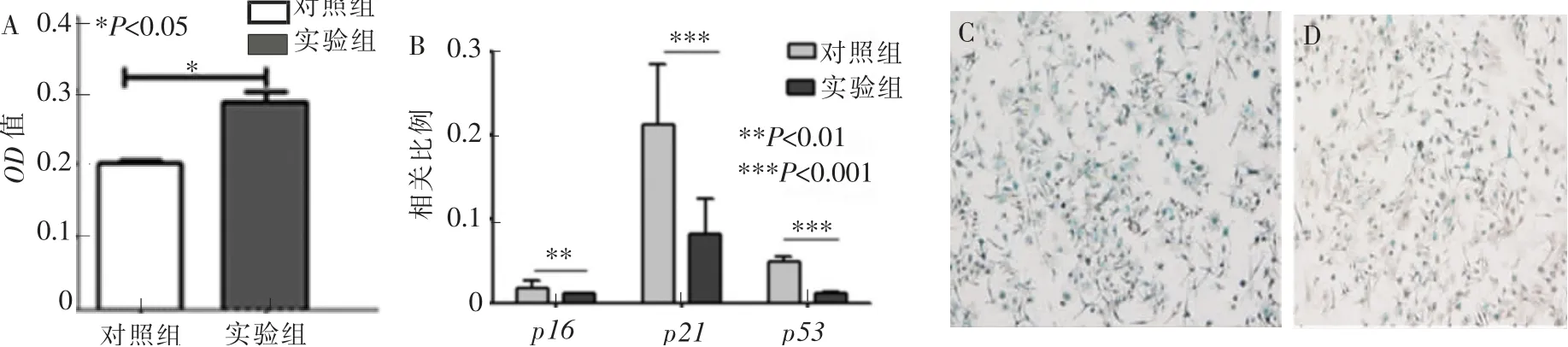
图3 年轻小鼠BMSCs 来源外泌体对衰老BMSCs 的影响Figure 3 Effect of young mice BMSCs-exosome on aging BMSCs
根据“2.4”的结果,我们进一步改变老龄小鼠BMSCs 细胞内2 个miRNAs 的表达量, 初步探究miR-199a-3p、miR-214-3p 对老龄小鼠BMSCs 衰老的影响。 利用miR-199a-3p mimics 和miR-214-3p mimics 分别转染老龄小鼠来源的BMSCs 后的CCK-8 检测结果显示:老龄小鼠的BMSCs 内转染miR-199a-3p mimics 后,OD值明显高于对照组,衰老相关基因p16、p53表达也明显下降, 与对照组相比较,差异具有统计学意义,说明miR-199a-3p可能参与了BMSCs 衰老过程的调节;而老龄小鼠BMSCs 内 转 染miR-214-3p mimics 后,OD值 及qPCR 数据与对照组相比较,没有明显差异,说明老龄小鼠来源的BMSCs 内miR-214-3p 含量的增加可能对细胞衰老没有明显的影响(图5)。

图4 BMSCs 来源外泌体miRNAs 热图Figure 4 MiRNAs thermogram of exosomes from BMSCs
3 讨论
衰老是一种普遍存在于生物系统中的退行性过程, 伴随着不可逆的退行性变化和不断增加的疾病敏感性,最终造成死亡[14]。 衰老是人类健康不得不面临的重要问题, 衰老的细胞会分泌一些信号分子,引起各种衰老相关性疾病的发生, 威胁着人类的生命健康。随着年龄的不断增长,机体在形态、结构和生理功能等方面必然会出现一系列全身性的、多方面的退行性变化,如骨质丢失、骨质疏松、骨髓再生能力减弱、机体自我修复功能下降等。 临床上老龄患者因外伤、肿瘤等导致的颌骨缺损,运用常规的骨移植、骨引导再生技术进行修复时, 因老龄化机体存在的全身性、退行性变化,使修复存在一些局限性。 因此,寻找一个既能抗衰老又能促进颌骨修复的治疗方法,具有重要的临床意义。
细胞衰老是指因各种因素而使细胞停滞于G0/G1 期, 无法进入S 期启动染色体复制以完成增殖活动的生理过程[15]。 BMSCs 一旦发生衰老,其成骨分化的能力也将大大降低。 本文研究发现, 经年轻小鼠BMSCs 来源外泌体作用后的老龄小鼠BMSCs, 增殖能力较对照组明显增强, 细胞有继续增殖分化的现象,说明年轻小鼠BMSCs 来源外泌体具有缓解老龄小鼠BMSCs 衰老的作用, 甚至可以说年轻小鼠BMSCs来源的外泌体可以逆转老龄小鼠BMSCs 的衰老状态,使衰老的BMSCs 重新开始分化、增殖。

图5 MiR-199a-3p、miR-214-3p 对老龄小鼠来源的BMSCs 衰老的影响Figure 5 The effect of miR-199a-3p and miR-214-3p on the aging process of BMSCs from old mice
外泌体是细胞在生理或病理状态下分泌的、大小约40~100 nm 的同质性囊泡[16]。 囊泡内含丰富的生物活性物质,它不仅易与邻近细胞膜发生融合,还有部分外泌体能循环进入体内作用于全身系统,由内分泌途径被吸收,将生物活性物质选择性地呈递给受体细胞,调节细胞间的信号传导,发挥生物学功能[17]。 由于外泌体的诸多优点,如良好的耐受性,所载药物在体内可保持一个较长的循环半衰期从而提高疗效; 能穿过细胞膜将承载物质运送至靶细胞;特有的定向归巢能力,并能进行膜修饰从而增强细胞特异性靶向作用;在体内、体外均能加载药物等。 有关外泌体载药治疗的研究在近几年取得了巨大的进展[18],目前,在心血管疾病[19]、系统性神经性疾病[20]、免疫性疾病[21]、肿瘤[22-23]等方面均有广泛的外泌体载药或外泌体载miRNA 基因治疗的临床研究报道。 本文研究发现,随着小鼠的增龄性变化,BMSCs 来源外泌体内miR-199a-3p、miR-214-3p 的基因表达量也发生了显著性改变, 增加BMSCs 细胞内2 个miRNAs 的表达量后,我们发现增加miR-199a-3p 基因表达可明显缓解BMSCs 的衰老过程。外泌体内含有大量来源细胞的miRNA、 蛋白质、脂质、信号分子等生物活性物质。 结合以上实验结论,我们可以推测,BMSCs 来源外泌体内的miR-199a-3p 极有可能在BMSCs 衰老过程中起到重要的调节作用,但具体机制有待进一步的研究。
综上所述,本文研究结果提示年轻小鼠BMSCs来源的外泌体具有缓解老龄小鼠BMSCs 衰老的作用,探究外泌体及其所含miRNA 在BMSCs 衰老过程中的作用机制,将会为未来运用BMSCs 来源外泌体载miRNA 修复老龄患者颌骨缺损提供理论依据。
