MiR-579-3p 靶向肌动蛋白相关蛋白3B 调控口腔鳞状细胞癌细胞增殖和凋亡的机制研究
2020-06-30高功杰王海业李晓彦
高功杰, 王海业, 李晓彦
(1. 郑州植得口腔医院,河南 郑州 450052;2. 郑州大学第一附属医院口腔科,河南 郑州 450033;3. 郑州人民医院郑东院区普外科,河南 郑州 450003)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)简称口腔鳞癌,是口腔颌面部常见的肿瘤之一,其发病率呈增长趋势。OSCC 的治疗主要以手术为主,并辅助放疗、化疗等[1]。 随着医学水平的进步,OSCC 的治疗效果有了很大改善,但中晚期患者5 年生存率依然较低,预后不佳[2]。 因此,进一步探究OSCC 发生、发展的分子机制,提供新的治疗靶点或途径,对于提高OSCC 疗效和改善患者预后具有重要意义。 微小RNA(microRNA,miRNA)是一类小分子非编码单链RNA, 在真核生物中广泛存在。miRNA 可通过与靶基因的3′非翻译区 (3′untranslated region,3′UTR) 靶向结合调控靶基因的表达,进而影响细胞的生长、分化、凋亡等生物学行为,在肿瘤的发生、发展中发挥重要作用[3-5]。 microRNA-579-3p(miR-579-3p)是近年来新发现的一类RNA,与肿瘤的发生、发展密切相关。 研究显示,miR-579-3p 低表达与黑色素瘤患者预后不良及耐药性密切相关, 过表达miR-579-3p 可降低人黑色素瘤细胞耐药性,提高治疗效果[6]。miR-579-3p 过表达通过靶向抑制巨噬细胞清道夫受体1(recombinant macrophage scavenger receptor 1,MSR1)蛋白表达显著降低了OSCC 细胞的增殖、侵袭和迁移[7]。 但目前,miR-579-3p 对OSCC 细胞恶性生物学行为的影响还未知。生物信息学软件预测显示,ACTR3B可能是miR-579-3p 的靶基因。ACTR3B可编码肌动蛋白相关蛋白, 在肌动蛋白细胞骨架中发挥重要作用。Yu 等[8]研究表明,ACTR3B 表达升高可促进结肠和直肠癌细胞增殖、迁移和侵袭。 目前,miR-579-3p 和ACTR3B 在OSCC 中的作用还未知。 本研究主要探讨了miR-579-3p 对OSCC 细胞增殖和凋亡的影响及其可否通过调控ACTR3B 影响OSCC 细胞的增殖和凋亡,以期为OSCC 的靶向分子治疗提供新途径。
1 材料和方法
1.1 细胞和实验试剂
正常人口腔角质形成细胞(NHOK)和OSCC 细胞系CAL27、CAL33、SCC15 (中国科学院上海细胞库);胎牛血清(fetal bovine serum,FBS)(浙江天杭生物科技股份有限公司,中国);胰蛋白酶和RPMI 1640 培养基(Gibco 公司,美国);ACTR3B 过表达载体(pcDNA-ACTR3B)和LipofectamineTM2000 试剂盒(Invitrogen 公司,美国);miR-579-3p 模拟物(mimcs)及阴性对照、miR-579-3p 抑制剂及阴性对照、ACTR3B 的小干扰RNA(广州伯信生物科技有限公司,中国);TRIzol 试剂, 反转录试剂盒及PCR 试剂盒(Takara 公司,日本);引物序列(上海生工生物工程有 限 公 司, 中 国);ACTR3B 抗 体 (Cell Signaling Technology 公司, 美国); 兔抗人细胞周期蛋白D1(CyclinD1)和活化的半胱天冬酶-3(C-caspase-3)多克隆抗体(Santa Cruz 公司,美国);四甲基噻唑蓝(Sigma 公司,美国);膜联蛋白V(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide, PI)细胞凋亡试剂盒(北京百奥莱博科技有限公司,中国);双荧光素酶活性检测试剂盒(上海碧云天生物技术有限公司,中国)。
1.2 实验方法
1.2.1 细胞培养 NHOK 和OSCC 细胞系CAL27、CAL33、SCC15 均用含10%FBS 的RPMI 1640 培养基置于培养箱(37 ℃、5%CO2、97%湿度)中培养。 每隔2 d 更换1 次新鲜培养基。 待细胞汇合至80%~90%时,加入0.25%胰蛋白酶溶液消化,传代培养。
1.2.2 细胞分组和转染 对数增殖期的CAL33 细胞以每孔1×105个的密度接种于6 孔板中, 待细胞汇合至60%时, 更换无FBS 培养基。 参照LipofectamineTM2000 试剂盒操作说明书, 将miR-579-3p mimcs(miR-579-3p 组)及 阴 性 对 照(miR-NC 组)、miR-579-3p 抑 制 剂(anti-miR-579-3p 组)及 阴 性 对照 (anti-miR-NC 组)、ACTR3B 的小干扰RNA(si-ACTR3B 组) 及阴性对照 (si-NC 组)、miR-579-3p mimcs 与ACTR3B 过表达载体 (miR-579-3p+pcDNA-ACTR3B 组)、miR-579-3p mimcs 与空载体(miR-579-3p+pcDNA-NC 组)分别转染至CAL33 细胞。 转染12 h 后,更换新鲜培养基,继续培养至48 h,收集细胞用于后续实验。 qRT-PCR 检测细胞中miR-579-3p 表达,western blot 检测细胞中ACTR3B 蛋白水平,验证转染效果。
1.2.3 qRT-PCR检 测miR-579-3p和ACTR3B mRNA表达 磷酸缓冲盐溶液 (phosphate buffer saline,PBS)清洗细胞,加入TRIzol 试剂提取细胞中总RNA。微量核酸仪检测RNA 的纯度和浓度,RNA溶液在260 nm 与280 nm 波长处吸光度(absorbance,A)的比值在1.8~2.0,说明纯度较好。 然后参照反转录试剂盒操作说明书, 将RNA 反转录为cDNA。 以cDNA 为模板,进行扩增。 扩增程序:95 ℃预变 性10 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s, 共进行45 个循环。 引物序列:miR-579-3p 正 向5'-TTGCAGACTCGCGGCAG-3', 反 向5'-CGCCGCGTAGAAACGTT-3';ACTR3B 正 向 5'-AGAAAATGGCGCAAAATC-3', 反 向5'-AAAATAGGCTGGGAGGAAA-3';U6 正 向5'-GCAAGGATGTGGTCGTG-3', 反 向5'-ACTGAGCCCCGAATGAA-3';β-actin 正向5'-AGCCACCCCACTTCTCTCT-3',反向5'-CCTCCCCTGTGTGGACTT-3'。 miR-579-3p 以U6为 内 参,ACTR3B 以β-actin 为 内 参,2-△△Ct法 计 算miR-579-3p 和ACTR3B mRNA 的相对表达水平。
1.2.4 Western blot检 测 细 胞 中ACTR3B、Cyclin D1和C-caspase-3蛋白水平 加入含蛋白酶抑制剂的蛋白裂解液, 提取细胞中总蛋白,BCA 蛋白浓度法测定蛋白浓度。 取适量蛋白,在100 ℃下煮沸5 min。变性后,每孔30 μg 蛋白行SDS-聚丙烯酰胺凝胶电泳 (SDS-polyacrylamide gel electrophoresis,SDS-PAGE)。 电泳后,湿转至硝酸纤维素膜,于5%脱脂牛奶中封闭1 h。分别加入ACTR3B 、Cyclin D1和C-caspase-3 抗体,4 ℃下孵育过夜。 次日,TBST缓冲液洗膜后,加入辣根过氧化物酶标记的IgG,37 ℃下孵育1 h。TBST 缓冲液洗膜后,加入ELC 显影液,避光显影,凝胶成像系统曝光拍照。
1.2.5 MTT法检测CAL33细胞增殖 各组转染后的CAL33 细胞以5×103个的密度接种于96 孔板中。每组设置3 个复孔。培养箱中培养24 h 后,每孔加入20 μL MTT 溶液(5 mg/mL),继续孵育4 h。 吸弃培养基,加入150 μL 二甲基亚砜,振荡混匀后,于酶标仪490 nm 处测定吸光度(A)值。 实验重复3 次。 细胞存活率(%)=A实验组/A对照组×100%。
1.2.6 流式细胞仪检测CAL33细胞凋亡 各组转染后的CAL33 细胞以每孔2.5×104个的密度接种于24 孔板中。 每组设置3 个复孔。 培养48 h 后,胰酶消化,收集细胞于流式管中。 PBS 清洗细胞3 次,4 ℃、1 000 r/min 离心5 min, 吸弃上清液。 参照Annexin V-FITC/PI 试剂盒操作说明书, 加入200 μL结合缓冲液混悬细胞。 加入5 μL Annexin V-FITC和5 μL PI,轻轻混匀,室温避光孵育15 min。 最后再加入300 μL 结合缓冲液, 混合均匀后流式细胞仪检测细胞凋亡。
1.2.7 双荧光素酶报告基因实验验证miR-579-3p和ACTR3B靶向关系 Starbase 生物信息学软件预测显示,ACTR3B 的3′非翻译区(3′UTR)存在与miR-579-3p 结合的核苷酸序列。 PCR 扩增含miR-579-3p 结合位点的ACTR3B 的3′UTR 序列,并插入pGL3 质粒载体的相应位点构建ACTR3B 野生型质粒(WT-ACTR3B)。通过基因定点突变技术将结合位点突变后, 插入pGL3 质粒载体的相应位点构建ACTR3B 突变型质粒(MUT-ACTR3B)。 然后分别将WT-ACTR3B、MUT-ACTR3B 与 miR-579-3p mimic及阴性对照共转染至CAL33 细胞。 转染12 h 后,更换新鲜培养基,继续培养至48 h,收集细胞。 参照双荧光素酶活性检测试剂盒操作说明书, 检测荧光素酶活性,结果以荧光素活性/海肾荧光强度比值表示各组的荧光素酶活性。
1.3 统计学分析
利用SPSS 22.0 软件分析实验数据。 计量资料以(±s)表示,2 组间比较采用独立样本t检验,多组间比较采用单因素方差分析。以P<0.05 表示差异有统计学意义。
2 结果
2.1 OSCC 细胞系中miR-579-3p 和ACTR3B 表达水平
与NHOK 比较, 口腔鳞癌细胞系CAL27、CAL33 和SCC15 中miR-579-3p 表达水平降低 (P<0.05),ACTR3B mRNA 和蛋白表达水平升高 (P<0.05)。 选择CAL33 细胞为研究对象, 进行后续研究。 详见图1 和表1。
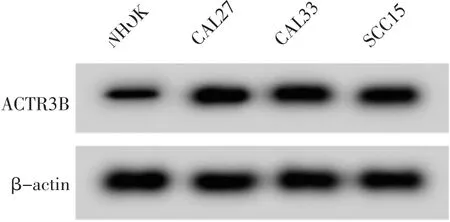
图1 Western blot 检测ACTR3B 蛋白表达Figure 1 Western blot detected the expression of ACTR3B protein
2.2 过表达miR-579-3p 对口腔鳞癌CAL33 细胞增殖和凋亡的影响
miR-579-3p 组CAL33 细胞中miR-579-3p 水平高于miR-NC 组(P<0.05),表明miR-579-3p mimics转染成功,CAL33 细胞中miR-579-3p 过表达。 与miR-NC 组比较,miR-579-3p 组CAL33 细胞存活率和CyclinD1 蛋白水平降低(P<0.05),细胞凋亡率和C-caspase-3 蛋白水平升高(P<0.05)。 详见图2 和表2。
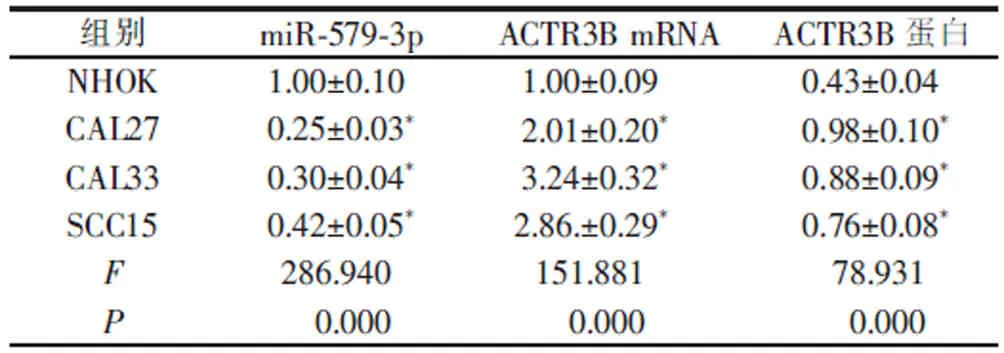
表1 OSCC 细胞系中miR-579-3p 和ACTR3B 表达水平(x±s ,n=9)Table 1 Expression levels of miR-579-3p and ACTR3B in oral squamous carcinoma cell lines (x±s, n=9)
2.3 沉默ACTR3B 对口腔鳞癌CAL33 细胞增殖和凋亡的影响
si-ACTR3B 组CAL33 细胞中ACTR3B 蛋白水平高于si-NC 组 (P<0.05), 表明ACTR3B 小干扰RNA 转染成功,CAL33 细胞中ACTR3B 表达沉默。与si-NC 组比较,si-ACTR3B 组CAL33 细胞存活率和CyclinD1 蛋白水平降低(P<0.05),细胞凋亡率和C-caspase-3 蛋白水平升高(P<0.05)。详见表3 和图3。
2.4 miR-579-3p 靶向调控ACTR3B 表达
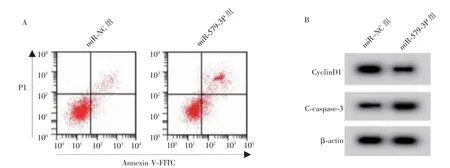
图2 过表达miR-579-3p 对CAL33 细胞增殖和凋亡的影响Figure 2 Effect of overexpression of miR-579-3p on the proliferation and apoptosis of CAL33 cells
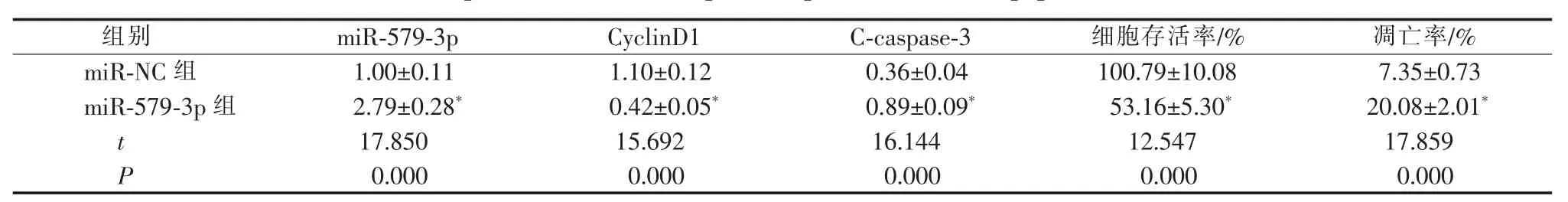
表2 过表达miR-579-3p 对CAL33 细胞增殖和凋亡的影响(x±s ,n=9)Table 2 Effects of overexpression of miR-579-3p on the proliferation and apoptosis of CAL33 cells (x±s, n=9)
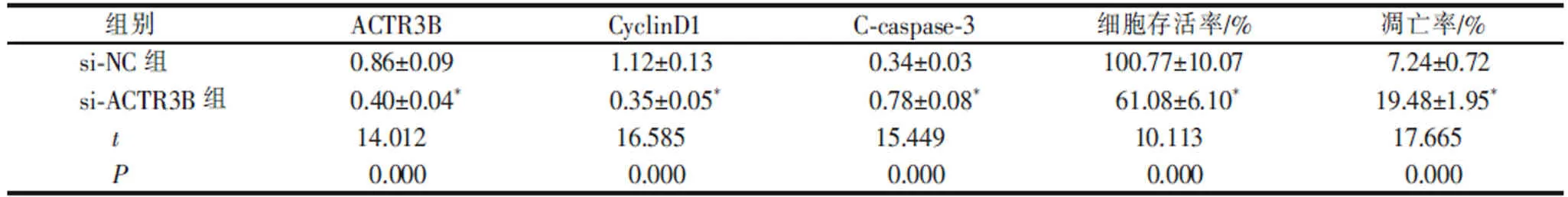
表3 沉默ACTR3B 对CAL33 细胞增殖和凋亡的影响(x±s ,n=9)Table 3 Effect of silencing ACTR3B on the proliferation and apoptosis of CAL33 cells (x±s, n=9)
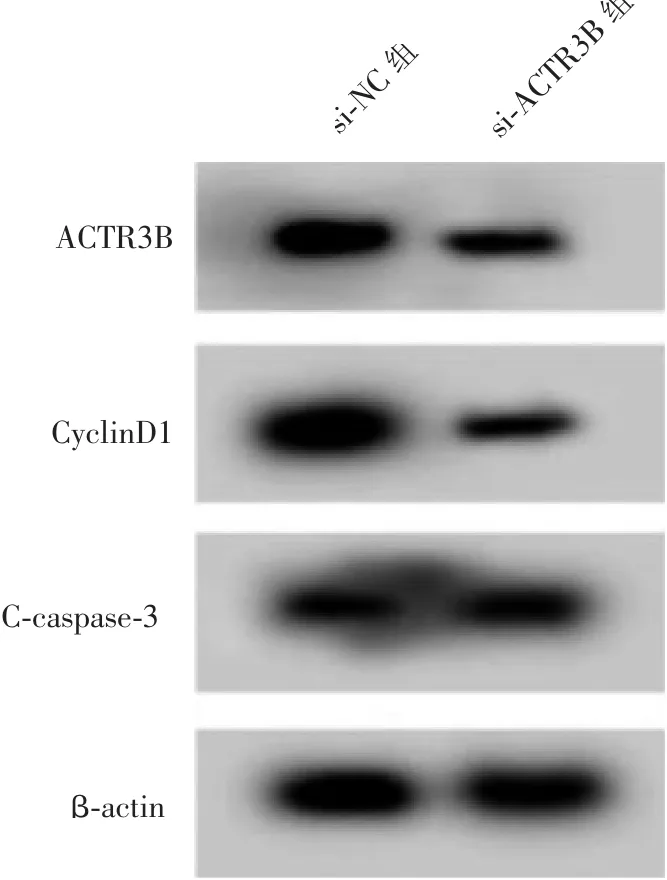
图3 Western blot 检 测ACTR3B、CyclinD1、C-caspase-3 蛋 白 的表达Figure 3 Western blot detected the expression of ACTR3B, CyclinD1, C-caspase-3 protein
Starbase 软 件 预 测 显 示,ACTR3B的3′UTR中含有与miR-579-3p 互补的核苷酸序列, 提示ACTR3B是miR-579-3p 的靶基因(图4)。 双荧光素酶活性检测结果显示,与miR-NC 组比较,miR-579-3p 组共转染WT-ACTR3B 的荧光素酶活性降低(P<0.05), 共转染MUT-ACTR3B 的荧光素酶活性无显著变化(P>0.05),说明miR-579-3p 可与ACTR3B 的3′UTR 靶向结合(表4)。 miR-579-3p 组ACTR3B 蛋白水平低于miR-NC 组 (P<0.05),anti-miR-579-3p组ACTR3B 蛋白水平低于anti-miR-NC 组(P<0.05),进一步说明miR-579-3p 靶向负调控ACTR3B 表达(表5)。
2.5 过表达ACTR3B 降低了过表达miR-579-3p 对OSCC CAL33 细胞增殖和凋亡的影响
与miR-579-3p+pcDNA-NC 组比较,miR-579-3p+pcDNA-ACTR3B 组CAL33 细胞存活率和CyclinD1 蛋白水平升高 (P<0.05), 细胞凋亡率和Ccaspase-3 蛋白水平降低(P<0.05)。详见表6 和图5。
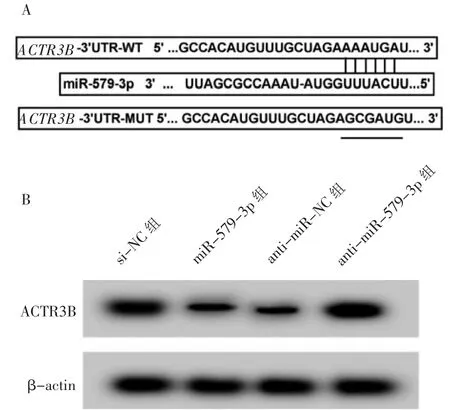
图4 miR-579-3p 靶向调控ACTR3B 表达Figure 4 miR-579-3p targets ACTR3B expression
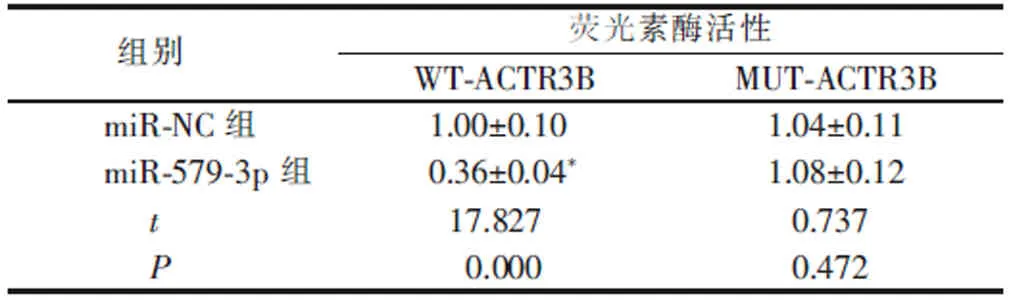
表4 双荧光素酶活性检测结果(x±s ,n=9)Table 4 Test results of double luciferase activity (x±s, n=9)

表5 miR-579-3p 对ACTR3B 蛋白表达的影响(x±s ,n=9)Table 5 Effect of miR-579-3p on the expression of ACTR3B protein (x±s, n=9)
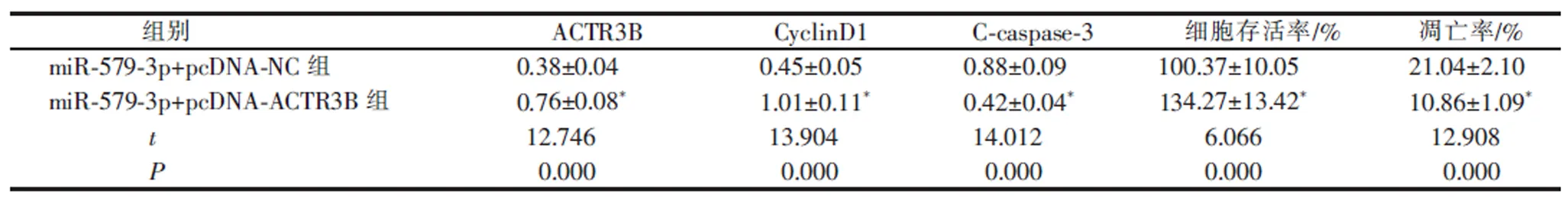
表6 过表达ACTR3B 降低了miR-579-3p 过表达对CAL33 细胞增殖和凋亡的影响(x±s ,n=9)Table 6 Overexpression of ACTR3B reduced the effect of miR-579-3p overexpression on the proliferation and apoptosis of CAL33 cells(x±s, n=9)
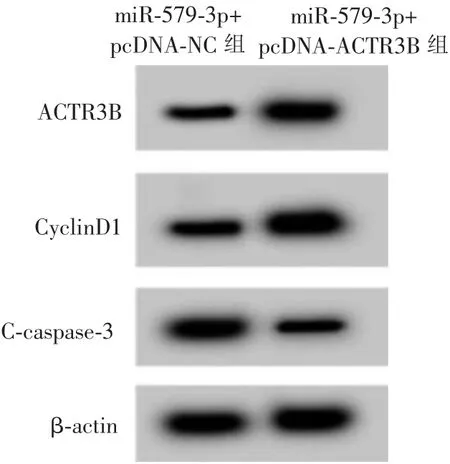
图5 Western blot 检测ACTR3B、CyclinD1、C-caspase-3 蛋白表达Figure 5 Western blot detected the expression of ACTR3B, CyclinD1, C-caspase-3 protein
3 讨论
OSCC 是常见的头颈部恶性肿瘤,约占所有恶性肿瘤的3%[9]。 由于OSCC 具有较强的侵袭性和转移复发的特点,其治疗效果不佳,给人类的健康带来严重的威胁[10]。因此,阐明OSCC 发生、发展的分子机制,寻找影响OSCC 发生、发展的分子靶点是靶向治疗OSCC 急需解决的关键问题。
近年来的研究显示,miRNA 在多种肿瘤发生、发展中发挥重要作用。miRNA 通过识别靶基因并与之结合,降解靶分子mRNA 或阻止靶基因蛋白质的合成,从而在细胞内发挥“促癌”或“抑癌”作用[11]。如He 等[12]的研究显示,过表达miR-133a-3p 可通过直接靶向调控Ⅰ型胶原α 链抑制OSCC 细胞的增殖和迁移。 Rastogi 等[13]的研究显示,过表达miR-377通过靶向组蛋白去乙酰化酶9 抑制了OSCC 细胞的生长和迁移, 并诱导了细胞凋亡,miR-377 可能是OSCC 治疗的新靶点。肿瘤的发生、发展往往涉及多个编码基因的改变。 研究还显示,1 个miRNA 可调控多个基因的表达, 这使得miRNA 作为抗癌靶点时,将比单个编码RNA 蛋白基因靶点更为广泛,且稳定有效[3,14-15]。
miR-579-3p 是近年来新发现的一种miRNA,它参与黑色素瘤[16]、帕金森病[17]等疾病的发生和发展,但目前在OSCC 中的作用还未知。 本研究首先以NHOK 为对照,qRT-PCR 检测了OSCC 细胞系CAL27、CAL33、SCC15 中miR-579-3p 表达水平,结果显示,CAL27、CAL33、SCC15 细胞系中miR-579-3p 表达水平明显低于NHOK, 提示miR-579-3p 可能参与了OSCC 的发生、 发展过程。 接着以OSCC 细胞系CAL33 为研究对象, 转染miR-579-3p mimics 后,CAL33 细胞存活率降低,凋亡率升高,提示过表达miR-579-3p 可抑制OSCC 细胞增殖,并诱导细胞凋亡,是OSCC 治疗的潜在靶点。CyclinD1 是调控细胞周期的关键蛋白,可促进细胞由G1 期向S 期转变,缩短细胞周期[18]。 半胱天冬酶(caspase)级联反应在细胞凋亡过程中发挥关键作用,caspase-3 是caspase 级联反应的重要调控蛋白,其活化后诱导细胞凋亡[19]。 本研究显示, 过表达miR-579-3p 可降低CAL33 细胞中CyclinD1 蛋白水平,提高C-caspase-3蛋白水平, 提示miR-579-3p 可能通过影响细胞中CyclinD1 和C-caspase-3 蛋白水平抑制细胞增殖及诱导细胞凋亡。
为了进一步探讨miR-579-3p 影响OSCC 细胞增殖和凋亡的作用机制,本研究通过生物信息学软件预测,ACTR3B可能是miR-579-3p 的靶基因。ACTR3B参与肌动蛋白细胞骨架形成,其在心脏、大脑、 白细胞中呈高表达。 本研究显示,ACTR3B的mRNA 和蛋白在OSCC 细胞系中表达升高, 沉默ACTR3B可降低CAL33 细胞存活率及CyclinD1 蛋白水平, 并提高细胞凋亡率及C-caspase-3 蛋白水平, 提示ACTR3B作为促癌基因参与OSCC 发生、发展,抑制其表达是OSCC 治疗的新途径。本研究双荧光素酶实验显示,miR-579-3p 可与ACTR3B的3′UTR 靶向结合, 且过表达细胞中miR-579-3p 后,ACTR3B 蛋白水平降低, 而抑制miR-579-3p 表达,ACTR3B 蛋白水平升高,证实了miR-579-3p 在OSCC 细胞中靶向负调控ACTR3B表达。 本研究还显示, 过表达ACTR3B逆转了过表达miR-579-3p 对CAL33 细胞增殖、 凋亡的影响, 提示过表达miR-579-3p 通过靶向抑制ACTR3B表达发挥抗OSCC的作用。
综上所述,miR-579-3p 在OSCC 细胞系中呈低表达, 过表达miR-579-3p 可抑制OSCC 细胞增殖,并诱导细胞凋亡,其可能通过靶向抑制ACTR3B发挥作用。 但本研究仅在细胞层面进行了初步探讨,接下来将通过动物实验深入探讨miR-579-3p 在体内对肿瘤生长的影响及其他可能的作用机制,以期为OSCC 的靶向分子治疗提供新途径。
