唾液代谢组学在流行性腮腺炎和急性化脓性腮腺炎中的初步分析
2020-06-30郑义彩肖国岫洪文伟
郑义彩, 肖国岫, 洪文伟, 吴 情, 徐 斌
(复旦大学附属上海市第五人民医院口腔科,上海 200240)
流行性腮腺炎由腮腺炎病毒引起,近年来,流行性腮腺炎发病率在中国丙类传染病中排在前3 位,是导致儿童群体发生突发公共卫生事件的主要病种之一[1]。 根据流行病学接触史及临床特征,该病一般不难与化脓性腮腺炎鉴别,鉴别要点见表1。但在疾病发生的早期,准确鉴别急性化脓性腮腺炎和流行性腮腺炎常常存在困难[2],主要有以下原因:①急性化脓性腮腺炎早期,炎症未液化,腮腺导管无溢脓。 ②急性化脓性腮腺炎早期,患者血白细胞计数及中性粒细胞比例不一定升高。 ③急性化脓性腮腺炎患者由于腮腺导管阻塞,血淀粉酶也可升高。 ④部分患者流行病学接触史不详。 虽然流行性腮腺炎为自限性疾病,一般可痊愈,但如合并脑膜脑炎、睾丸炎等并发症将严重危害患者的身体健康[3]。 急性化脓性腮腺炎和流行性腮腺炎病原体不同, 治疗原则不同。 流行性腮腺炎潜伏期长、传播能力强、防控难度大,若误诊为急性化脓性腮腺炎,造成交叉感染,可能导致疫情暴发;若误诊导致病情延误,可能引发严重并发症[4]。 急性化脓性腮腺炎在就诊初期容易被误诊为流行性腮腺炎,导致未及时使用合适的抗生素及其他治疗措施,病情延误致感染进一步加重,可能引发严重的并发症或后期反复发作。 因此,早期鉴别诊断急性化脓性腮腺炎和流行性腮腺炎至关重要。
代谢组学是继基因组学和蛋白质组学之后新近发展起来的一门学科,是系统生物学的重要组成部分[5]。 代谢组学主要研究生物整体对外源性物质所引起的病理、生理反应,对遗传变异的反应及内源性代谢产物的动态变化等,它通过对生物体液和组织中随时间改变的代谢产物进行检测、 鉴定、定量和分类,将这些代谢信息与病理、生理过程,生化过程及生命活动相关联[6]。 唾液是龈沟液、黏膜渗出液、唾液腺腺泡超渗液的混合体,储存了大量的人类和口腔微生物的基因信息。 唾液中还含有口腔局部组织和身体其他部位感染的微生物和病毒,唾液作为监测健康和疾病的新兴递质,近年来得到了越来越多的关注,在疾病早期诊断中具有明显的作用[7-8]。
本研究将唾液代谢组学应用于流行性腮腺炎和急性化脓性腮腺炎,分析流行性腮腺炎和急性化脓性腮腺炎患者唾液的内源性代谢物差异,筛选潜在的早期诊断代谢标志物,为早期精准鉴别流行性腮腺炎和化脓性腮腺炎寻找新的诊断手段。
1 资料和方法
1.1 一般资料
选择2017-06-01—2019-03-30 就诊于上海市第五人民医院口腔科的18 例流行性腮腺炎患者和18 例急性化脓性腮腺炎患者,根据患者是否为首次确诊分为发现集(流行性腮腺炎组及急性化脓性腮腺炎组,每组各8 例首诊确诊样本)和验证集(流行性腮腺炎组及急性化脓性腮腺炎组, 每组各10 例首诊时无法确诊的样本)。 对于首诊时无法确诊者,根据病情嘱其居家观察, 分别于卧床休息1、3、7 d后来院复查,若症状加重,即刻来院就诊。 在后续诊治中根据临床症状及复查的血常规、 血淀粉酶报告,依据流行性腮腺炎及化脓性腮腺炎的诊断标准,最终确诊。
1.2 诊断与排除标准
流行性腮腺炎诊断标准:流行性腮腺炎患者接触史;单侧或双侧腮腺弥漫性肿大;皮肤红肿,触痛明显;患侧腮腺导管口唾液清亮;白细胞无明显升高,淋巴细胞比例升高,血淀粉酶升高。 急性化脓性腮腺炎诊断标准:无流行性腮腺炎患者接触史;单侧腮腺弥散性肿大;皮肤红肿,触痛明显;患侧腮腺导管口可见脓性分泌液;白细胞升高和(或)中性粒细胞比例升高,血淀粉酶升高或正常。 排除标准:慢性肾病、糖尿病、高血压、肝炎及内分泌疾病等急性或慢性病史;吸烟、喝酒及其他不良嗜好;口腔出血,牙周炎病史,干燥综合征病史;肉眼可见唾液中带血,唾液中含痰液或食物残渣者;初诊不能确诊,后期仍无法确诊并自愈者。 本研究经我院医学伦理委员会批准,参与研究者均知情同意并签署知情同意书。

表1 流行性腮腺炎与急性化脓性腮腺炎鉴别要点Table 1 Key points for distinguishing between mumps and acute suppurative parotitis
1.3 标本采集
发病48 h 内未使用任何药物或其他治疗手段,首次就诊时收集患者唾液标本, 收集唾液前1 h 内禁食、禁饮、禁烟。受试者清水漱口,等待1 min 后采用自然留取法,嘱其头稍向前倾,向标本盒内流入3 mL 唾液,装入4 ℃预冷的无菌EP 管中,即刻置于-80 ℃冰箱中保存。
1.4 方法
1.4.1 材料与试剂 色谱级甲醇、乙腈(默克公司,德国);HPLC 级甲酸(Fluka 公司, 瑞士) ;超纯水 由Milli-Q 水净化系统(密立波公司, 美国)制备得到;2-氯-苯丙氨酸-Aldrich (Sigma 公司,美国)。
1.4.2 样本的制备 将待分析的样品置于室温解冻,涡旋均匀,取50 μL 唾液样本,加入150 μL 的2-氯-苯丙氨酸甲醇溶液(内标)用于蛋白沉淀及代谢物的提取。 涡旋5 min 后,13 000 rpm 在4 °C 下离心15 min。 取100 μL 上清液置于进样小瓶中待液相色谱-质谱分析。 同时每个样品取10 μL 上清液于EP 管中,涡旋混匀,取200 μL 于进样瓶中作为质控(quality control,QC)样本。
1.4.3 代谢组学分析 使用1290 InfinityⅡ超高效液相系统和安捷伦6545 高分辨单四级杆-飞行时间串联质谱联用仪(Agilent 公司,美国)对唾液样本和QC 样本进行分析。 色谱分离使用超高压液相色谱柱(2.5 mm×100 mm×2.5 μm, 沃特世公司,美国),柱温40 °C。 流动相包括0.1%的甲酸溶液,乙腈。 流速:0.35 mL/min。 色谱梯度为0~2 min,5%乙腈;2~13 min,5%~95%乙腈;13~15 min,95%乙腈。运行时间设为5 min,用于平衡系统。 质谱使用正、负离子模式分别采集,具体参数为:毛细管电压, 3.5 kV;干燥器流速,10 L/min;气体温度,325 °C;雾化器压力,20 psi;fragmentor 电压,120 V ;skimmer 电压,45 V。 质谱的采集范围50~1 100 m/z。 序列中,每6 个样本插入1 个QC 样本,用于系统稳定性监测。
采集的原始数据使用安捷伦Masshanter 定性分析软件(B.07.00)转换为mzData 格式。 使用开源R 软件包XCMS 对峰进行提取、对齐和积分。 做内标归一化后,导入SIMCA-P 11.0 软件进行多元统计分析。 将差异离子的精确质荷比数值与在线数据库Metlin(http://metlin.scripps.edu/)对比,并进行鉴别。
1.5 统计学方法
采用SPSS 19.0 统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,使用独立样本t检验对2 组间差异进行统计学分析,P<0.05 认为差异有统计学意义。
2 结果
2.1 两组患者的一般情况比较
比较2 组患者的年龄、性别,差异无统计学意义(P>0.05),具有可比性。 详见表2。
2.2 发现集代谢组学轮廓分析及差异代谢物筛选
正、负离子模式下,唾液样本的典型总离子流色谱图(total ion chromatogram, TIC)见图1。 使用XCMS 软件进行峰的提取后, 正离子模式下共有1 734 个离子,负离子模式下有885 个离子。
将所有唾液样本和QC 样本进行无监督的主成分分析(principal component analysis,PCA),以观测离群值及监测系统的稳定性。PCA 是一种非监督性的模型分析方法,可以可靠地反映各组之间最真实的差异。 所有唾液样本及QC 样本的PCA 得分如图2 所示,在正负模式下QC 的聚集程度良好,表明系统的稳定性良好。
使用有监督的偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA) 来筛选流行性腮腺炎组和急性化脓性腮腺炎组发现样本的差异物质。 2 组的PLS-DA 得分图如图3 所示,其中 正 离 子 模 式 下R2X=0.587, R2Y=0.994, Q2=0.815;负模式下R2X=0.587, R2Y=0.995, Q2=0.898。正、负离子模式下模型均良好。

表2 两组患者临床资料Table 2 Clinical data of patients

图1 唾液样本正、负离子模式下典型的总离子流色谱图Figure 1 Typical total ion chromatogram of saliva sample in positive and negative ion mode

图2 所有唾液样本和QC 样本的PCA 得分图Figure 2 PCA score chart of all saliva samples and QC samples
PLS-DA 的计算变量投影重要度(variable importance for the projection, VIP)值>1,独立样本t检验P<0.05 的离子认为是2 组间差异的离子,共鉴别出32 个差异代谢物,如表3 所示。
2.3 诊断标志物的验证及效能评价
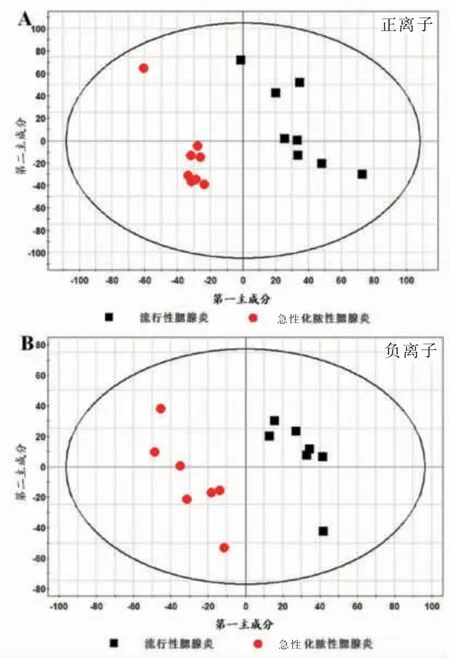
图3 流行性腮腺炎组和急性化脓性腮腺炎组发现样本的PLS-DA得分图Figure 3 PLS-DA scores of samples found in the mumps group and acute suppurative parotitis group
在2 组验证样本(各10 例)中提取32 个差异代谢物的量值, 计算急性化脓性腮腺炎组与流行性腮腺炎组的差异倍数 (fold change,FC) 值及P值, 其中在验证样本中也有显著差异且变化趋势一致的2 个代谢物分别是十一酸(undecanoic acid)和磷脂酰胆碱(phosphatidyl cholines, PC)(P-18:1/18:1)。为了进一步验证此代谢物组合的潜在诊断效能,我们将2 个代谢物使用二元logistic 回归联合构建预测模型 (图4)。 发现样本接受者操作特征曲线(receiver operating characteristic curve, ROC) 最大曲线下面积(area under the cure,AUC)为1,验证样本中得到的ROC 最大AUC 为0.926。 结果表明,我们筛选的十一酸和磷脂酰胆碱(P-18:1/18:1)可以作为唾液样本潜在的标志物组合。

表3 流行性腮腺炎组和急性化脓性腮腺炎组发现样本中的差异代谢物列表Table 3 List of differential metabolites found in the mumps group and acute suppurative parotitis group
3 讨论

图4 两个代谢物在发现样本和验证样本中构建预测模型的ROC曲线Figure 4 ROC curve of the combination of two metabolites in the discovery and verification samples to build a prediction model
基于高效液相色谱-四级杆飞行时间高分辨谱联用技术(UHPLC-QTOF/MS)的唾液代谢组学方法,本研究筛选出急性化脓性腮腺炎与流行性腮腺炎的32 个差异代谢物,并在20 个验证样本中进一步验证了这些差异代谢物的诊断效能,最终筛选出十一酸和磷脂酰胆碱(P-18:1/18:1)2 个代谢物作为唾液样本潜在的标志物组合。
流行性腮腺炎一直受到广泛关注,在其被纳入扩大免疫规划后的几年内, 发病率并未见明显下降;而且随着流行性腮腺炎的病程延长,其并发症的发生率也逐渐增加[9],因此腮腺炎的早期诊断尤为重要。 临床主要根据流行病学接触史、临床特征及实验室检查进行诊断。 对于难以明确诊断的病例, 多项研究通过寻找不同的方法进行辅助诊断。腮腺炎的高频B 超声像图表现为腺体增厚,实质性的腺体回声增粗、增强,分布不均匀;受侵腺体血流信号明显丰富,血流速度增加,重者呈“蜂窝状”改变。 B 超虽然能准确显示出受侵腺体的个数和相邻组织的变化, 且能动态观察患者病情变化, 但在疾病早期,仅从声像图的表现难以鉴别化脓性腮腺炎和流行性腮腺炎[10]。2007-02,加拿大新斯科舍省的1 所大学暴发了流行性腮腺炎。 Hatchette 等[11]利用聚合酶链反应(polymerase chain reaction, PCR)等分子方法通过寻找2 082 名患者的3 410 份口腔或尿液样本的病毒病原体来确诊腮腺炎。 尽管检测流行性腮腺炎病毒的方法非常有效, 但在疫情高峰期,只有14.3% (298/2 082)的病例被确诊。 本研究利用唾液代谢组学方法筛选出十一酸和磷脂酰胆碱(P-18:1/18:1)2 个代谢物, 发现样本ROC 最大AUC为1, 验证样本中得到的ROC 最大AUC 为0.926。结果表明,这一标志物组合可以作为急性化脓性腮腺炎与流行性腮腺炎潜在的早期预测标志物组合。
唾液作为巨大的生物标志物储存库,具有重要的研究价值。 唾液可以以非侵入性的、相对无压力的方式被收集, 而且没有很高的病毒感染风险,在过去10 年间, 其作为诊断工具的研究越来越多。“唾液组学” 一词被用来描述从人类唾液研究中获得的信息,包括基因组学、表观基因组学、转录组学、蛋白质组学及代谢组学,其中基于质谱法的检测方法是最有效的[12]。目前,唾液检测被用于早期诊断阿尔茨海默病[12]、糖尿病[13]、牙周炎[8]、口腔癌[14]等。本研究首次将唾液代谢组学应用于腮腺炎的鉴别诊断,可能为早期鉴别流行性腮腺炎和急性化脓性腮腺炎提供1 种新的诊断手段。
大量流行病学研究显示儿童和青少年是流行性腮腺炎的主要感染人群。 在人群分布上,86.39%的流行性腮腺炎病例集中在年龄<15 岁的人群中,5~9 岁年龄组发病率最高[15]。但由于本研究在口腔科门诊收集病例时, 研究对象主要为成年人,故本研究中流行性腮腺炎组的平均年龄为28~31 岁,此为本研究的局限性。
综上所述,本研究利用唾液代谢组学的方法筛选出十一酸和磷脂酰胆碱(P-18:1/18:1)这一代谢物组合,作为早期鉴别诊断流行性腮腺炎和急性化脓性腮腺炎的潜在标志物,后续仍需在大规模的腮腺炎人群中进一步验证这一代谢物组合的诊断效果。
