白藜芦醇对胰岛素抵抗小鼠糖脂代谢的影响及心肌的保护作用
2020-06-29朱心瑶王志荣
魏 叶, 朱心瑶, 王 坤, 王志荣
(1.徐州医科大学第一临床学院,徐州 221004;2.徐州医科大学附属医院心内科,徐州 221004)
胰岛素抵抗(insulin resistance,IR)即机体靶器官对胰岛素的敏感性降低、胰岛素利用障碍,不能发挥正常生物学效应,并导致胰岛β细胞代偿性的分泌胰岛素水平升高,继而出现高胰岛素血症。IR发生后常可导致一系列的糖脂代谢紊乱,靶器官也出现相应的变化。高脂饮食容易导致肥胖、诱发IR,而白藜芦醇(resveratrol,RES)是一种天然的多酚类抗氧化剂,存在于葡萄,浆果,花生和一些蔬菜中,具有抗炎、抗氧化、抗肿瘤等药理作用[1-3]。研究表明RES是一种核转录因子PPARγ(过氧化物酶增殖物激活受体γ)(peroxisome proliferator-activated receptors γ)的激动剂[4]。基于此,观察RES对IR小鼠的糖脂代谢的影响及通过激动PPARγ改变心肌的变化。
1 材料与方法
1.1 试验材料
高脂饲料D12492、对照组饲料D12450B(Research Diets 公司,美国);RES(Sigma公司,美国)含量>98%;羧甲基纤维素钠(carboxymethyl cellulose sodium,CMC)(Sigma公司,美国); 兔抗小鼠PPARγ、肿瘤坏死因子α(tumor necrosis factor,TNF-α)、脂联素(adiponectin,ADPN)多克隆抗体、辣根过氧化物酶标记二抗、均购自武汉三鹰生物技术有限公司; 羟脯氨酸测试盒(南京建成生物工程研究所,批号:A030-2-1);SuperReal荧光定量预混试剂增强版(天根生化科技北京有限公司,Lot S7104)、FastQuant cDNA第一链合成试剂盒(天根生化科技北京有限公司,批号:Lot R7026)。
1.2 试验分组及动物模型的建立
SPF级6 周龄C57BL/6J小鼠40只,雄性,体重 17~19 g,健康,购自济南朋悦试验动物繁育有限公司[许可证号为 SCXK(鲁)2014-0007];随机分对照组(NC)、高脂组(H)、高脂+CMC组(C)和高脂++CMC+RES组(R),每组10只。NC组以D12450B饲料饲养,另外三组以D12492高脂饲料饲养,每周测量体重。14周后,禁食16 h,剪尾采血行葡萄糖耐量试验(glucose tolerance test,GTT)试验。
1.3 灌胃干预
RES溶于0.5%CMC中制成混悬液,R组以22.5 mg/(kg·d)的RES灌胃处理,C组以等体积CMC灌胃,每日一次,继续饲养8周,小鼠处死前一周分别进行GTT试验和胰岛素耐量试验(insulin tolerance test,ITT)试验。
1.4 试验取材
禁食12 h,以10%水合氯醛腹腔注射麻醉,摘眼球取血后脱颈处死,开胸剪取心脏组织迅速置于预冷的磷酸盐缓冲液中冲洗,滤纸吸干,称心脏湿重。部分心脏组织置于液氮速冻后,-80 ℃保存备用。测量胫骨长度。
1.5 血清指标检测
取血后,全血4 ℃静置30 min,4 000 r/min离心10 min,取血清备用。血清送至徐州医科大学附属医院全自动生化分析仪检测血脂、血糖。采用Merck Milliproe 液相芯片试剂盒,按照试剂盒操作步骤检测胰岛素、瘦素、抵抗素、脂联素。
1.6 心肌指标检测
取左心室心肌依照羟脯氨酸测试盒说明书操作检测羟脯氨酸。western-blot(WB)方法检测心肌PPARγ、TNF-α、ADPN、Ⅰ型胶原、Ⅲ型胶原的蛋白水平以及实时荧光定量PCR(qRT-PCR)检测PPARγ、TNF-α、ADPN、心房利钠肽(atrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide, BNP)、β-肌球蛋白重链(β-Myosin heavy chain,β-MHC)的mRNA,引物序列如表1所示。

表1 各基因的引物序列Table 1 Primer sequences of gene
1.7 统计方法
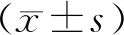
2 试验结果
2.1 动物存活及模型情况
小鼠喂养14周行GTT试验,以对照组GTT试验结果平均曲下面积(area under the curve,AUC)为基准,剔除三组高脂组中AUC低于对照组平均值的小鼠。H组2只,C组3只,R组1只。灌胃干预7周行ITT试验。
2.2 各组小鼠一般情况
2.2.1 小鼠的体重变化
RES干预后,与NC组相比,H及C组体重仍呈升高趋势,而R组趋势明显减缓,如图1(a)所示。试验结束时,H及C组体重与NC组相比P<0.01;R组较H减轻,P<0.01,如图1(b)所示。
2.2.2 各组小鼠的一般情况
高脂喂养的三组小鼠全心重量(heat weight,HW)、空腹血糖(fasting blood glucose,FBG)、空腹胰岛素(fasting insulin,FIN)水平及胰岛素抵抗指数(HOMA-IR)均高于NC组,但胰岛素水平差异无统计学意义。R组的体重及空腹血糖水平明显改善,HW(P<0.01)、FBG(P<0.05),如表2所示。
注:与NC组比较,**表示P<0.01;与H组比较,##表示P<0.01。下同。图1 小鼠体重变化Fig.1 Changes of mice weight

表2 各组小鼠的一般情况Table 2 General conditions of mice in each
注:HOMA-IR=(FBG×FIN)/22.5;与NC组比较,*表示P<0.05,**表示P<0.01; 与HDF组比较,#表示P<0.05,##表示P<0.01。下同。
2.3 RES对糖脂代谢的影响
2.3.1 RES对糖耐量及胰岛素耐量的影响
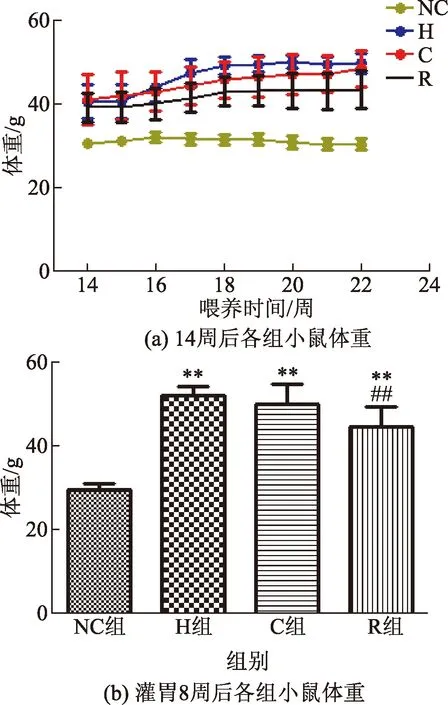
小鼠灌胃7周左右分别行GTT试验及ITT试验。高脂饲养的三组小鼠均出现糖耐量受损,而R组GTT及ITT试验曲下面积明显低于H及C组,P<0.01,图2所示。
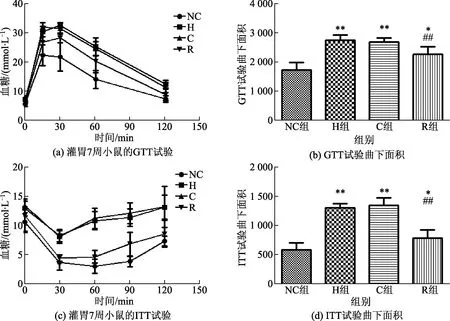
图2 ITT及GTT试验结果Fig.2 The results of ITT and GTT
2.3.2 血清血脂及血糖情况
高脂饲养H及C组小鼠的血糖、总胆固醇(total cholesterol,TC)、低密度脂蛋白(low density lipoprotein,LDL)均高于NC组,P<0.01;而RES干预8周后减轻了该趋势,P<0.05。而甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipoprotein,HDL)的变化无统计学意义,如表3所示。

表3 各组小鼠的血脂情况Table 3 Blood lipids of mice in each
2.3.3 血清激素变化情况
与NC组相比,小鼠血清中瘦素、抵抗素在H及C组均升高趋势,而与H组相比,RES干预后两种激素的血清水平呈下降趋势,但无统计学意义。而ADPN血清水平无明显变化,如表4所示。

表4 小鼠血清中脂肪因子变化情况Table 4 Changes of adipokine in serum of mice

2.4 小鼠心肌变化
2.4.1 心脏重量/胫骨长度比
与NC组小鼠比较,H和C组小鼠的心脏重量/胫骨长度比值明显升高,而RES干预后较H组明显下降,P<0.01,如图3所示。

与H组比较,##表示P<0.01。下同。图3 小鼠心脏重量/胫骨长度比Fig.3 Heart weight/Tibial length ratio in mice
2.4.2 心肌中ANP、BNP、β-MHC的mRNA的表达
H组与C组的ANP、BNP、β-MHC的mRNA的表达水平明显高于NC组;而在R组小鼠心肌中的表达水平呈下降趋势,P<0.01或P<0.05,如图4所示。
图4 心肌中ANP、BNP、β-MHC的mRNA表达Fig.4 The mRNA of ANP,BNP and β-MHC in myocardium
2.4.3 心肌中羟脯氨酸含量
按羟脯氨酸测试盒说明书操作测定心肌中羟脯氨酸含量,H及C组小鼠每克心肌组织中羟脯氨酸含量均高于NC组,P<0.01;R组单位心肌的羟脯氨酸含量也高于NC组,P<0.05,但较另两组明显下降,P<0.05,如图5所示。

图5 心肌中羟脯氨酸含量Fig.5 The content of hydroxyProline in myocardium
2.4.4 心肌中的胶原蛋白表达
与NC组比较,H与C组小鼠心肌中Ⅰ型胶原(collagenI)、Ⅲ型胶原(collagenⅢ)蛋白表达水平均升高,P<0.01,且R组胶原水平均呈下降趋势,见图6(a)~图6(c)。
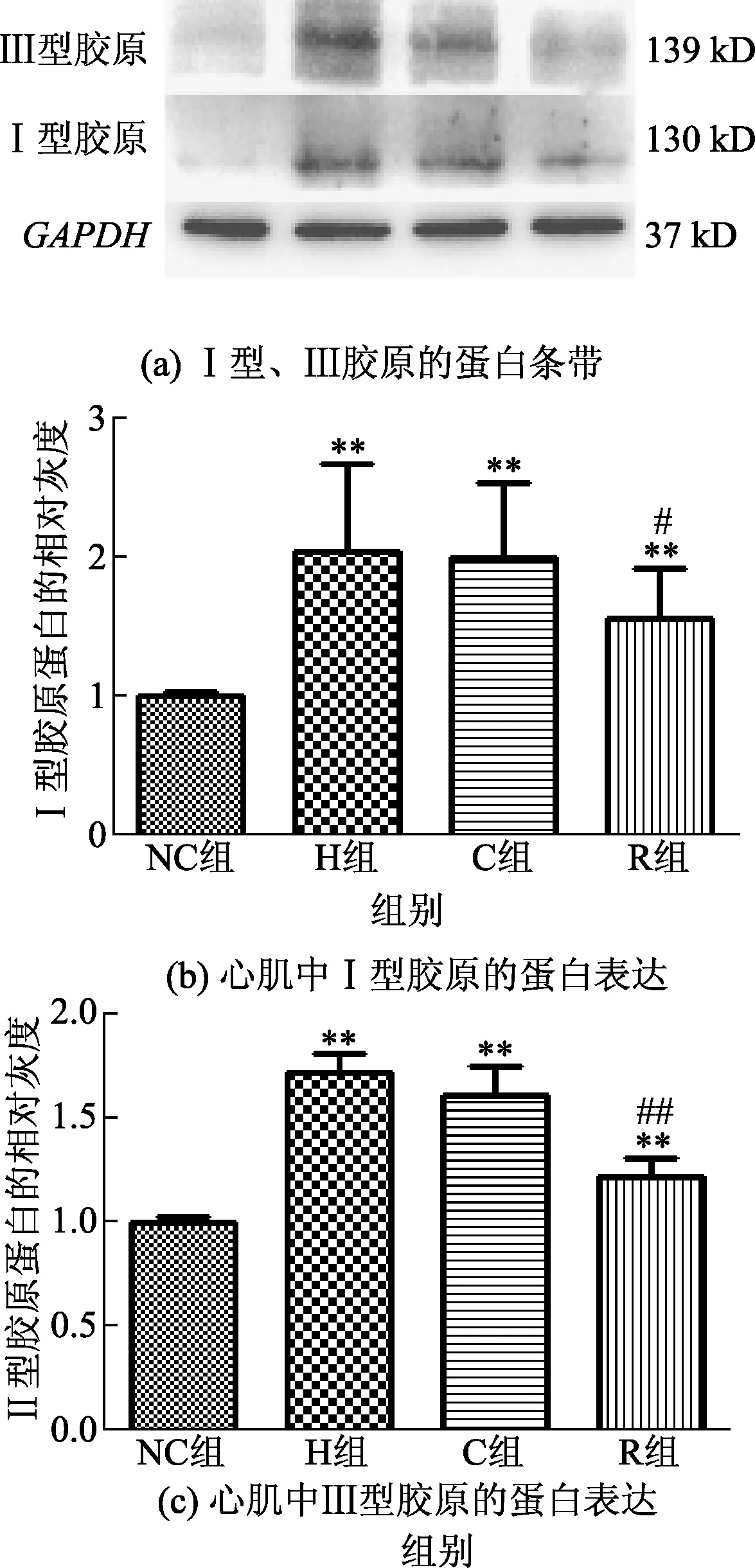
图6 心肌中Ⅰ、Ⅲ型胶原的蛋白条带及蛋白表达Fig.6 Protein bands and expression of CollagenI,CollagenⅢ in myocardium
2.4.5 心肌中PPARγ、TNF-α、ADPN的mRNA及蛋白表达
PCR及WB方法检测心肌中相关基因的mRNA与蛋白的表达水平。与NC组相比,PPARγ、ADPN的mRNA水平在H及C组均降低,TNF-α则在H及C组明显升高,P<0.01或P<0.05,如图7所示。而与H组相比,R组的PPARγ、ADPN的mRNA水平升高,TNF-α降低。同时蛋白表达水平呈相同趋势,如图8所示。

图7 心肌中PPARγ、ADPN和TNF-α 的mRNA表达Fig.7 The mRNA of PPARγ,ADPN and TNF-α in myocardium
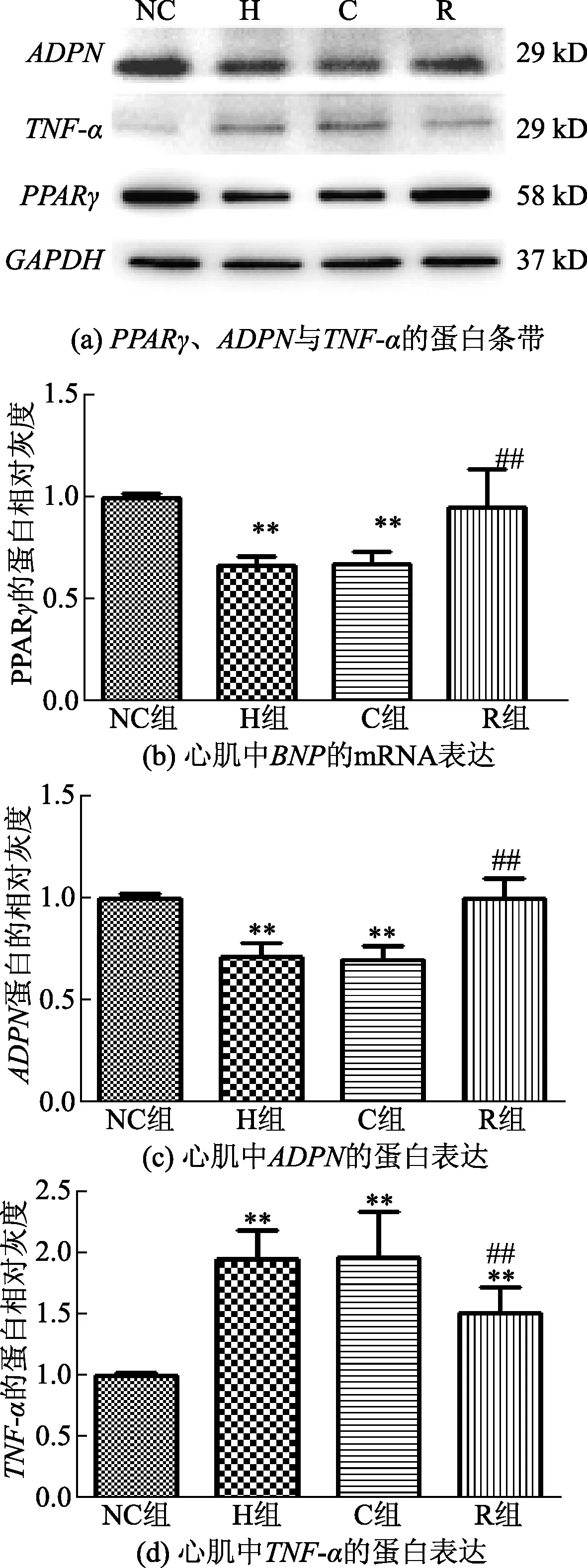
图8 心肌中PPARγ、ADPN和TNF-α的蛋白条带及蛋白表达Fig.8 Protein bands and expression of PPARγ,ADPN and TNF-α in myocardium
3 分析及讨论
RES 是一种非黄酮类多酚化合物,广泛存在于水果、葡萄酒、虎杖等植物中的一种多酚类物质,因“法国悖论”现象引起关注,可抗氧化、抗炎、抗动脉粥样硬化等发挥心血管保护作用。前期已证实RES可以抑制心房重构、减轻心房纤维化、减轻房颤氧化应激损伤等[5-7]。有研究表明RES是一种PPARγ的激动剂[4],当干预剂量为22.5 mg/(kg·d)时,降低小鼠血脂的作用最为明显[8],故RES的干预剂量定为22.5 mg/(kg·d)。试验中,小鼠经高脂饲养14周后GTT与ITT试验后测得的AUC较对照组明显升高,且HOMA-IR也明显升高、均>2.5,提示小鼠达到IR标准。
3.1 RES影响IR小鼠糖脂代谢
研究发现,高脂饲养的小鼠出现体重增加、TC及LDL水平明显升高,TG的血清水平也呈升高的趋势。同时血清中胰岛素、瘦素、抵抗素的水平也有所升高,但差异无统计学意义。而RES干预后血清中的血脂及脂肪因子升高水平均有所缓解。另外,R组GTT及ITT试验的AUC呈下降的趋势,且FBG水平明显降低,表明RES可以改善IR小鼠的糖脂代谢紊乱。
3.2 RES对IR小鼠心肌的保护作用
研究发现高脂饲养的小鼠心肌组织中BNP、ANP、β-MHC的mRNA水平明显升高,且心脏重量/胫骨长度比值升高,提示IR小鼠存在心肌肥厚的表现。羟脯氨酸是胶原蛋白的主要成分之一,其含量反映了胶原组织含量及纤维化程度,经检测高脂饲养小鼠的羟脯氨酸水平升高,且WB检测Ⅰ型胶原、Ⅲ型胶原的蛋白表达明显升高,表明IR小鼠心肌出现了纤维化表现。RES干预后心肌纤维化水平有所减轻。
3.3 RES对IR的心肌作用的机制探讨
PPARγ是一类核转录因子,在多在脂肪组织中表达,但在心肌组织中也有少量表达。它在体内与视黄醇类X受体(retinoid X receptor,RXR)形成异二聚体,结合于靶基因启动子的PPAR反应元件(PPREs)调控靶基因的转录[9]。噻唑烷二酮类(thiazolidinediones,TZDs)药物在糖尿病治疗中通过激动PPARγ增强外周组织的胰岛素敏感性,改善IR,如吡格列酮、罗格列酮等。但此类药物常导致体重增加,水肿,心衰等副作用。研究中,IR小鼠出现PPARγ的mRNA及蛋白表达水平明显降低,同时激活了炎症因子TNF-α的表达,而ADPN的表达水平下降。但RES干预后该趋势明显改善。RES作为PPARγ的激动剂,在高脂饲养IR小鼠心肌组织中激活PPARγ,使其与RXR形成异二聚体作用于TNF-α的PPREs上抑制TNF-α的转录,从而减轻了TNF-α对ADPN的抑制作用,使心肌组织的ADPN表达水平升高。Iwaki等[10]发现ADPN的启动子中含有PPRE的位点,PPARγ激活剂能诱导ADPN的启动子,使其活性升高5~10倍。PPARγ激活剂通过增强ADPN mRNA的稳定性,促进ADPN蛋白的合成、释放,降低组织TNF-α水平,减轻TNF-α介导的对ADPN表达的抑制作用[11]。研究表明ADPN与IR所致的心室重构关系密切,给予外源ADPN可以减轻IR,进而改善心室重构[12]。推测低水平 ADPN诱发心室重塑的机制可能是:①ADPN水平降低,引起炎症因子因子TNF-α释放增加,加重IR的程度;②低水平ADPN可以通过抑制AMPK信号通路促进活性氧(reactive oxygen sepcies,ROS)诱导的心室重构[13];③ADPN水平降低时,使外周血管紧张素激活,增加心脏负荷,进而促进心肌细胞的肥厚与增殖[14]。 因此,RES可能是通过激动PPARγ,调节炎症因子TNF-α、脂肪因子ADPN水平以及两者之间的相互作用,减轻了心肌肥厚及纤维化改变。研究结果为RES应用于治疗IR引起的机体代谢紊乱提供了更多科学依据,也为RES在预防糖尿病心肌病的发生方面提供了理论支持。
4 结论
高脂饮食可以诱导小鼠产生胰岛素抵抗,导致小鼠糖脂代谢紊乱。RES对胰岛素抵抗小鼠的糖脂代谢紊乱有调节作用,并且可以减轻胰岛素抵抗小鼠的心肌肥厚及纤维化,具有心肌保护作用。这种心肌保护左右有可能是通过激动PPARγ调节ADPN、TNF-α来实现的。
