白藜芦醇对肌萎缩侧索硬化症转基因小鼠的疗效及机制
2020-06-28王凤陈星宇
王凤 陈星宇
(厦门大学附属中山医院,福建 厦门 361000)
肌萎缩侧索硬化症(ALS)是一种累及脊髓、脑干和皮质运动神经元的神经变性疾病〔1〕。临床表现为进行性加重的无力、四肢及躯干肌肉萎缩,导致运动功能障碍甚至呼吸肌麻痹,患者多于3~5年内死亡〔2〕。世界流行病学调查结果显示,美国有12 000~15 000例ALS,中国约有20万例ALS〔3,4〕。ALS的发病原因复杂,给患者带来“毁灭性”的影响。放射性损伤、环境因素、重金属中毒、肿瘤、自体免疫等都可能成为患病因素。ALS涉及多种发病机制,目前主要包括氨基酸的兴奋性毒性作用、遗传假说、氧化应激、线粒体功能障碍、神经营养因子障碍、自身免疫机制、病毒感染、神经炎症、蛋白清除障碍及轴突运动障碍等发病假说〔5,6〕。目前没有能给ALS患者带来实质性临床获益的治疗方案,国际承认、且唯一通过美国食品药物监督局批准治疗ALS的药物为Covis Pharma的谷氨酸释放抑制剂利鲁唑〔7〕和田边三菱公司的自由基清除剂依达拉奉〔8〕,但以上药物只能改善患者的生存质量,不能阻止ALS的发病进程。利鲁唑虽然能轻微改善部分患者的功能和生存率,但是其价格昂贵整体受益较差;依达拉奉长期用药出现的毒副作用也限制了它的应用。针对ALS的药物开发情况不容乐观,我国尚缺乏自主研发的ALS治疗药物。白藜芦醇(Res)是多酚类化合物,已被证实可激活沉默信息调节因子2相关酶(SIRT)1且广泛用于各种实验中,是一种研究较多的SIRT1激动剂,它主要来源于蓼科植物的根茎中。Res具有抗炎、抗癌、抗氧化、抗心血管疾病等广泛有益作用。鉴于其抗氧化能力有神经保护的作用,近年来Res逐渐被应用于神经退行性疾病治疗研究〔9~11〕。本实验采用B6SJL-Tg(SOD1-G93A)1Gur/J转基因ALS小鼠为研究对象,观察Res对ALS小鼠的疗效,并对其机制进行初步探索。
1 材料与方法
1.1实验动物与分组给药 12周龄的雄性转基因杂合子小鼠 B6SJL-Tg(SOD1-G93A)1Gur/J(Stock No.002726),平均体重(30±2)g;同窝野生型B6SJL小鼠(WT组),平均体重(30±2)g,购于美国Jackson实验室(Bar Harbor,ME USA 04609)。所有小鼠按照广州中医药大学SPF级实验动物饲养管理规程进行饲养〔实验动物使用许可证号:SYXK (粤)2013-0001〕。房间温度维持(23±3)℃,湿度为40%~70%,房间保持12 h昼夜节律,小鼠自由进食和饮水。实验中所有操作遵循美国国立卫生研究院(NIH)及广州中医药大学实验动物伦理委员会的相关规定。40只12周龄雄性B6SJL-Tg(SOD1-G93A)1Gur/J转基因小鼠被随机分配到SOD1-G93A组、Res组(7.5 mg/kg、15.0 mg/kg、30.0 mg/kg)和利鲁唑组(5 mg/kg),每组8只。同窝出生的小鼠作为野生组(WT 组)。Res组每天灌胃给药对应浓度的Res 2次;利鲁唑组每天灌胃给药利鲁唑2次;WT 组和SOD1-G93A 组每天灌胃给药同等剂量的生理盐水2次。给药3个月后采用爬杆实验、转棒实验、抓力实验和旷场实验等行为学实验评价各组肌肉力量及运动症状的改善效果。
1.2主要实验试剂 丁基苯酞原料药购买于Sigma公司,阳性对照药利鲁唑片购买于万特制药(海南)有限公司,3-硝基酪氨酸(NT)和8-羟基脱氧鸟苷(OHdG)酶联免疫吸附试验(ELISA)试剂盒(Abcam公司),丙二醛(MDA)试剂盒(南京建成生物有限公司),核因子NF-E(Nrf)2和血红素氧合酶(HO)1抗体(Santa Cruz公司),Trizol(Invitrogen),反转录试剂盒(Fermentas,K1622),GT VisionTM Ⅲ抗鼠/兔通用型免疫组化检测试剂盒〔基因科技(上海)有限公司〕。其余试剂均购于Sigma公司。
1.3主要实验仪器 动物称量天平〔梅特勒-特利多仪器(上海)有限公司〕,倒置显微镜(Olympus IX71,日本),石蜡切片机和石蜡包埋机(Leica,德国),多功能酶标仪(BioTEK,美国),自制爬杆装置(长55 cm,直径1 cm),开放场装置(PanLab,西班牙),转棒装置(安徽正华仪器有限公司),YLS-13A大小鼠抓力测定仪(山东省医学科学院),半干式转膜仪和电泳装置(BioRad,美国),实时定量PCR仪(Thermo,美国)。
1.4方法
1.4.1行为学指标测定〔12〕爬竿实验:采用自制长55 cm,直径1 cm,顶端放置一个直径3 cm小球,外表面缠绕2层纱布的爬杆装置。垂直放置在小鼠笼中,将小鼠头部朝下置于杆的顶部球上,让其沿杆自然爬下,记录小鼠前肢碰到杆底所需要的时间,测定时限120 s,小鼠不能持杆、完全自然下滑者或不能调头者,记录其爬杆时间为120 s,每只小鼠测量3次,每次间隔30 min。
旷场实验:握住小鼠尾部1/3处轻放于旷场装置(长×宽×高=50 cm × 50 cm × 40 cm)的正中央,使小鼠适应5 min后,利用自主摄影系统记录小鼠的自发活动,连续记录10 min,并用相关软件分析处理数据,统计小鼠整个自主运动的总距离。鉴于动物的生活习性,实验均在9∶00~12∶00 AM进行,每次实验结束用70%的酒精擦拭旷场。
转棒实验:YSL-4C小鼠转棒式疲劳仪设定起始转速为5 r/min,转速保持20 s后,依次增加5 r/min并保持20 s,最后加速到30 r/min,检测时间共计3 min。手持小鼠尾部置于正在运转的转棒仪上,并开始计时,记录小鼠在转棒仪上停留的时间(即第一次掉落的时间),每只小鼠测定3次,每次间隔1 h。数据用以评价小鼠四肢协调性和平衡性。
抓力实验:YLS-13A小鼠抓力测定仪水平放置,使抓力板呈现水平运动,测量记录小鼠后肢抓力值,每只小鼠测定3次,每次间隔30 min,取平均值作为统计以评价药物对动物肢体力量影响程度。
1.4.2标本采集及相关指标测定 利用微量管牵拉仪牵拉玻璃毛细管(内径为0.75 mm,外径为1.0 mm),在解剖显微镜下用镊子打破尖锐毛细管的尖端,使破碎尖端的内径为10~20 μm,将细管和注射器连接到毛细管支架的另一端,并用三通阀连接细管和注射器。小鼠用氯胺酮和甲苯噻嗪〔(8.7+1.3)mg/100 g〕深度麻醉后,使用小鼠适配器固定小鼠头部(头后部朝上,鼻子指向约45°,使用剪刀和弯曲的镊子,切开皮肤和分离第一层肌肉直到头骨基部只露出一层薄薄的肌肉,并将这些肌肉层移到侧面暴露硬脑膜(三角形状,通常有1~2条大血管穿过该区域;或者血管的一侧),清洁后用干燥的棉花擦干该区域,抽取小鼠脑脊液;用1 ml注射器插入心脏抽取血液,放于1.5 ml离心管中,室温静置30 min后,3 000 r/min离心10 min,吸取上清,分装于-80℃保存备用。待所有标本采集完毕后,严格按照8-OHdG、3-NT和MDA检测试剂盒相关说明对标本进行检测。
1.4.3免疫染色运动神经元〔12〕小鼠用氯胺酮和甲苯噻嗪〔(8.7+1.3)mg/100 g〕深度麻醉后,心脏灌注冲洗至流出的液体为无色,切取小鼠腰4~5段后迅速浸泡于4%多聚甲醛溶液中,随后用梯度乙醇脱水,二甲苯透明后透蜡,包埋后连续切片脊髓为5 μm,进行后续染色。切片在65℃烤箱脱蜡1 h,经二甲苯和梯度乙醇溶液脱蜡复水后,放于0.05 mol/L柠檬酸缓冲液(pH=6.0)中加热煮沸,抗原修复10 min,自然冷却后,放入3%H2O2溶液中避光反应10 min,去除内源性的过氧化物酶,10%胎牛血清封闭1 h后滴加Neuro N一抗(1∶200)4℃孵育过夜,PBS洗涤3次后,加入辣根过氧化物酶(HRP)标记的二抗(1∶200),室温孵育1 h;二氨基苯胺(DAB)工作液显色,自来水终止显色反应,梯度酒精脱水和二甲苯透明后用中性树脂封片,最后,倒置荧光显微镜下拍照小鼠脊髓组织Neuro N染色阳性的运动神经元。
1.4.4Western印迹检测〔13〕分离的各组小鼠脊髓组织,按照V/W(10 μl∶1 mg)加入含1 μg/ml PMSF和1 μl磷酸化酶抑制剂的RIPA缓冲液,冰上匀浆3 min后,4℃条件下12 000 r/min离心15 min,取上清,用Pierce BCA蛋白定量试剂盒进行蛋白定量。上样30 μg蛋白,调节电压至80 V,待溴酚兰刚跑出分离胶底部即可终止电泳,然后将PAGE凝胶放于半干转印槽,恒压15 V条件下转膜2 h,5%奶粉的封闭2 h,TBST缓冲液洗3次,每次5 min,加入抗体稀释液稀释至适当浓度的一抗(1∶1 000),4℃条件下孵育过夜。TBST清洗后加入HRP标记的二抗(HRP-IgG,1∶2 000),室温孵育2 h,TBST洗涤后,加入ECL显影液,在发光成像系统曝光显影并利用该凝胶图象处理系统分析其灰度值。
1.5统计学方法 采用GraphPad Prism5软件进行单因素方差分析。
2 结 果
2.1Res对SOD1-G93A小鼠体重的影响 给药前和给药后每隔1个月称量小鼠体重,计算各组给药后相比给药前的体重变化率。实验结果显示,给药3个月后SOD1-G93A组体重并未明显变化,而WT组体重明显增加,两者比较差异有显著统计学意义(P<0.001)。利鲁唑组相对SOD1-G93A组体重无明显变化,而给药剂量30 mg/kg 的Res组体重与SOD1-G93A组比较差异均有显著统计学意义(P<0.01)。见表1。

表1 各组给药后1~3个月体重变化率
与同时间点SOD1-G93A组比较:1)P<0.001;与同组给药2个月比较:2)P<0.001;与同组给药1个月比较:3)P<0.001;与同组给药时比较:4)P<0.001
2.2Res显著改善SOD1-G93A小鼠的运动行为学症状 SOD1-G93A小鼠肌肉萎缩无力,表现出明显的行为学障碍。在爬杆实验中,SOD1-G93As小鼠的爬杆时间显著高于WT组(P<0.001)。Res给药治疗3个月后(除Res组7.5 mg/kg外),小鼠的运动行为学障碍得到显著改善,爬杆时间与SOD1-G93A组相比显著降低,30.0 mg/kg Res组爬杆时间与利鲁唑组相当。在转棒实验中,WT组平均潜伏期SOD1-G93A组相比差异有显著统计学意义(P<0.001),7.5、15.0和30.0 mg/kg Res治疗后显著增加小鼠在转棒仪上的时间。在旷场实验中,与WT组相比,SOD1-G93A组运动距离明显下降(P<0.001),不同给药剂量的Res组可以显著提高运动距离(P<0.05)。在抓力实验中,与WT组相比,SOD1-G93A组抓力显著下降(P<0.001),15.0、30.0 mg/kg Res治疗后显著增加小鼠的后肢抓力(P<0.001)。见表2。

表2 各组给药后运动行为比较
与WT组比较:1)P<0.001;与SOD1-G93A组比较:2)P<0.01;3)P<0.001;下表同
2.3Res显著降低SOD1-G93A小鼠血清和脑脊液中3-NT和8-OHdG的含量 在血清和脑脊液标本中,与WT组相比,SOD1-G93A组3-NT和8-OHdG的含量明显上升(P<0.001),15.0、30.0 mg/kg Res组可显著降低3-NT和8-OHdG的含量(P<0.001)。见表3。
表3 各组血清和脑脊液中8-OHdG和3-NT含量比较
2.4Res显著降低SOD1-G93A小鼠血清和脑脊液中MDA的含量 在血清和脑脊液中,与WT组相比,SOD1-G93A组MDA含量明显上升(P<0.001),15.0、30.0 mg/kg Res治疗后可显著降低SOD1-G93A小鼠血清和脑脊液中MDA的含量,并且效果优于利鲁唑组。见表4。
2.5Res显著增加小鼠脊髓前角运动神经元数量 WT组、SOD-G93A组、7.5、15.0、30.0 mg/kg Res组和利鲁唑组平均运动神经元数目分别为(19.1±0.67)、(8.4±1.01)、(10.0±0.98)、(13.4±1.05)、(16.4±0.76)和(14.9±1.06)个。与WT组相比,SOD1-G93A组脊髓前角运动神经元明显减少(P<0.001),病变的神经元逐渐出现核固缩,细胞边界模糊不清和细胞体积减小。与SOD1-G93A组相比,15.0、30.0 mg/kg Res组脊髓前角的运动神经元显著增多,胞体增大,未见明显细胞核固缩现象。见图1。
表4 各组血清和脑脊液中MDA含量比较
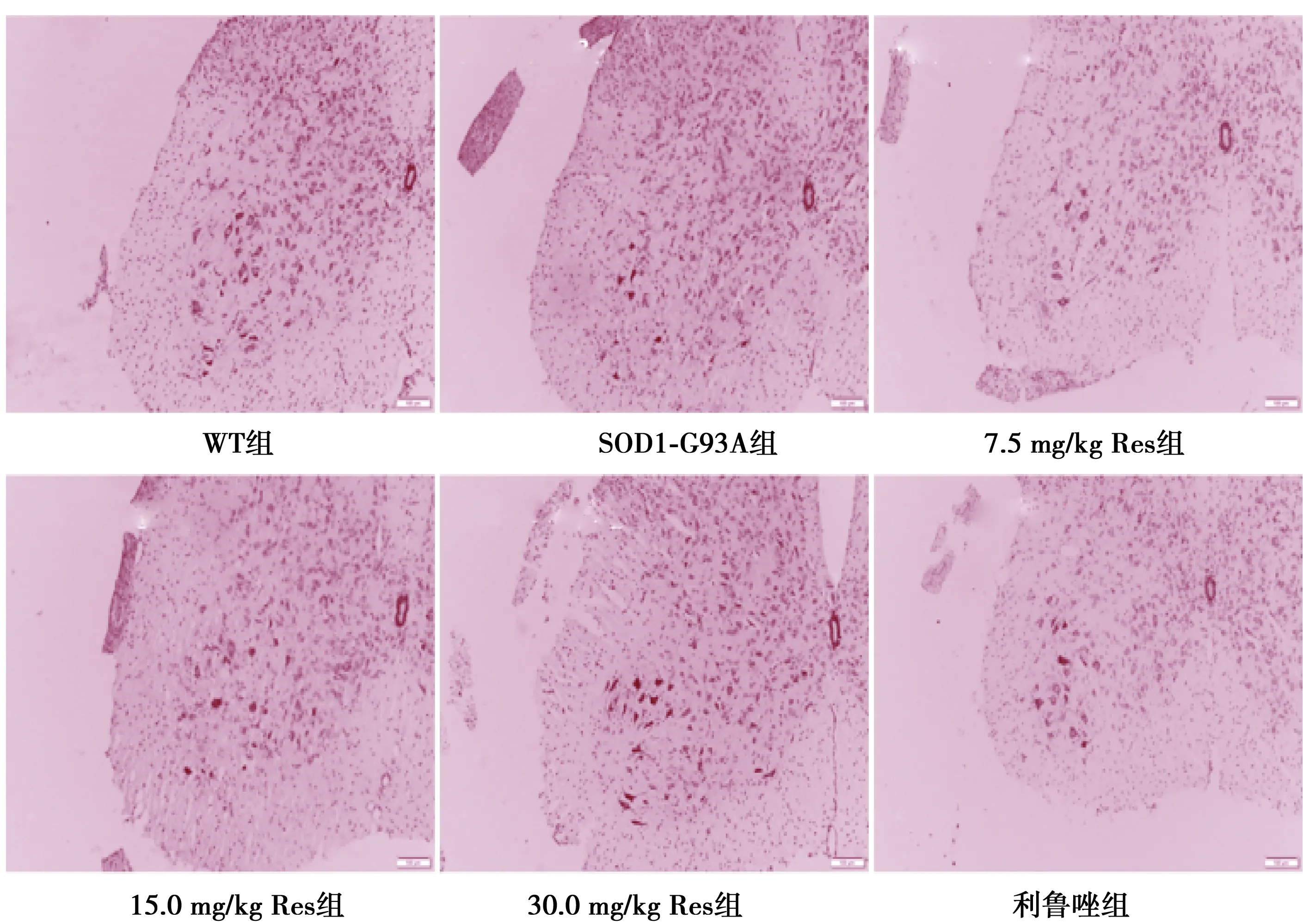
图1 各组小鼠脊髓组织Neuro N阳性运动神经元免疫组化检测(DAB,×50)
2.6Res显著增加SOD1-G93A小鼠脊髓组织Nrf2和HO-1蛋白的表达 与WT组相比,SOD1-G93A小鼠脊髓组织Nrf2和HO-1的蛋白含量显著降低(P<0.001),7.5、15.0、30.0 mg/kg Res组可显著增加Nrf2和HO-1的蛋白表达(P<0.01)。见图2、表5。
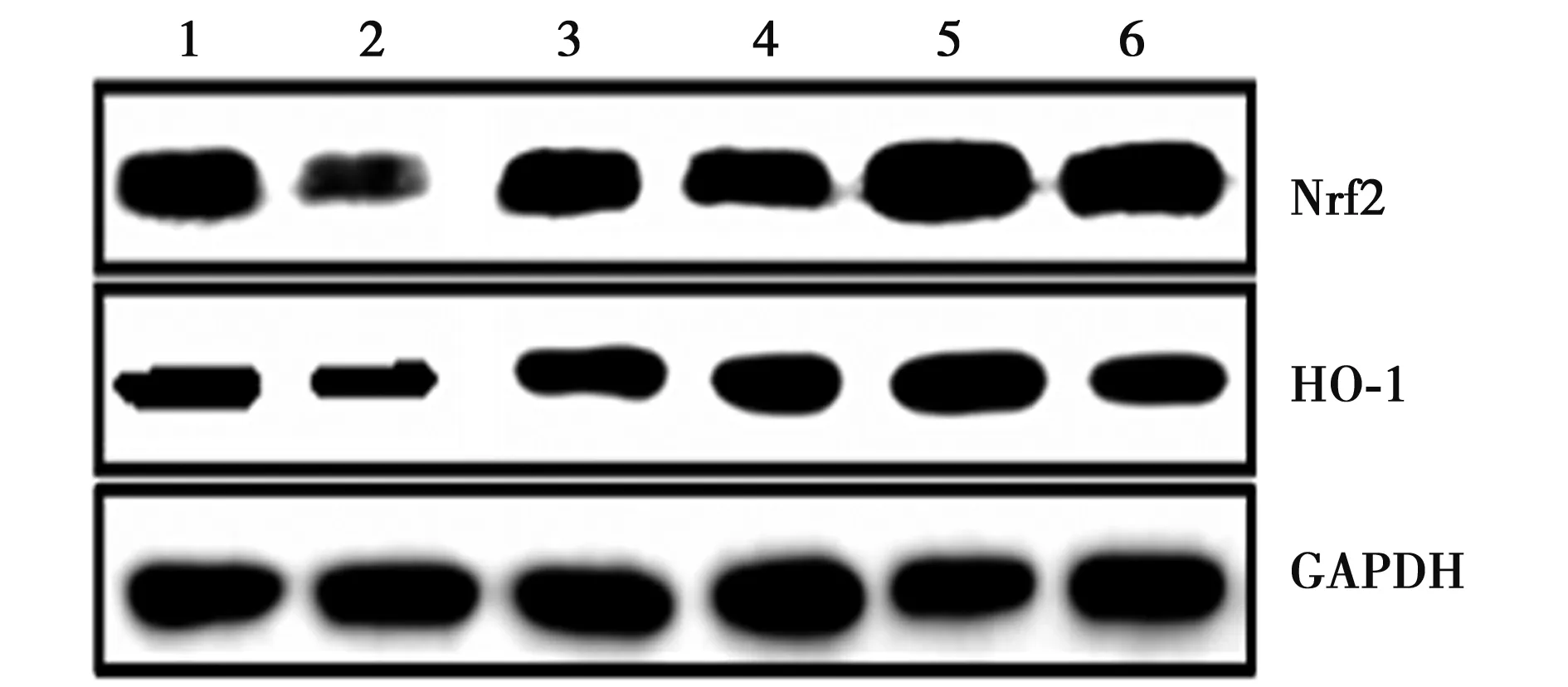
1~6:WT组、SOD1-G93A组、7.5 mg/kg Res组、15.0 mg/kg Res组、30.0 mg/kg Res组、利鲁唑组图2 各组脊髓组织中Nrf2和HO-1的蛋白水平

表5 各组Nrf2和HO-1蛋白相对灰度值
3 讨 论
B6SJL-Tg(SOD1-G93A)1Gur/J转基因小鼠是目前研究ALS较为流行的动物模型之一。其运动症状开始于后肢,以双后肢肌力减退和瘫痪为主,并逐渐发展累及躯干和前肢。B6SJL-Tg(SOD1-G93A)1Gur/J转基因小鼠的主要病理学特征是腰段脊髓前角运动神经元数目丢失,小鼠肌肉萎缩无力,出现明显的运动行为学障碍,ALS小鼠出现运动功能障碍时运动神经元的数目丢失可达44%以上。因此脊髓前脚运动神经元数目和运动功能是ALS转基因小鼠疾病进展最可靠和最客观的评价指标〔14〕。本研究结果表明Res在一定程度上延缓了运动神经元的丢失,改善了ALS小鼠的运动障碍,对SOD1 G93A转基因小鼠脊髓前角运动神经元具有显著的保护作用。氧化应激产生的活性氧可直接或间接地损伤细胞内蛋白质、脂质、核酸等大分子物质的生理功能,是包括ALS疾病在内发生的病理生理基础。8-OHdG是活性氧自由基如羟自由基、单线态氧等攻击DNA分子中的鸟嘌呤碱基第8位碳原子而产生的一种氧化性加和物,是DNA氧化损伤最常用的生物标志物之一〔15〕;3-NT是蛋白质氧化损伤的标记物〔16〕;MDA是生物膜中的多不饱和脂肪酸脂质过氧化作用产物。本研究结果说明,Res抵抗氧化损伤保护脊髓运动神经元。机体细胞本身具有一套复杂的抗氧化系统,该系统组成Nrf2-抗氧化反应元件(ARE)-抗氧化酶通路,Nrf2是细胞氧化应激的重要因子,其通过与ARE相互作用调节编码抗氧化蛋白,是机体内源性抗氧化应激的重要通路〔17〕。本研究结果说明,Res可通过激活Nrf2-HO 1抗氧化应激通路抵抗自由基对组织的氧化损伤,从而降低8-OHdG、3-NT和MDA的含量。Res在阿尔茨海默病、帕金森病等多种神经退行性疾病中具有神经保护作用,其保护作用是通过抑制自由基产生、神经细胞凋亡及改善线粒体功能等实现。Res极有可能成为新的以神经元保护为特点的抗 ALS药物,因此其在临床治疗ALS及其他神经变性疾病中的意义有必要深入研究。
